
- •1. Отримання і хімічні властивості алканів
- •4.Одерж.Та хім.Власт. Гідркосикислот.
- •1.Для карбоксильної групи
- •2. Для спиртових гідроксидів
- •3. Для гідрокислот
- •3. Алкенові вуглеводні.
- •6. Одержання та власт. Ароматичних вуглеводнів.
- •9. Отримання і хімічні властивості альдегідів
- •11. 2,4,6 Триметилнонан
- •12.Реакції альдегідів та кетонів.
- •15.Гідроксикислоти.Одержання, власт,оптична ізомерія
- •18.Жири, їх будова, класифікація та властивості.
- •Отримання і хімічні властивості естерів
- •2 Бром 3 метил пентан
- •3Метилбутан-1-ол
- •33.Отримання і хімічні властивості альдегідів
- •39 Отримання і хімічні властивості альдегідів
- •Отримання і хімічні властивості кетонів
- •48.Методи одержання і властивості багатоатомних спиртів
- •49.Ацетилен-бензен-толуен-бенз кис---м-нітробенз кис –хлорангідрид бенз кис--ізопропіловийестер м-нітробенз кис
- •51. Методи одержання та властивості галогенопохідних вуглеводнів.
- •2. Отримання етанолу
- •57. Отримання і хімічні властивості циклоалканів
- •60. Отримання і хімічні властивості ароматичних вуглеводнів
- •63. Отримання і властивості дієнових вуглеводнів.
- •2. Піроліз метану
- •140. Реакції
- •151. CoSo4
- •157. CaCo3
2. Піроліз метану
Лабораторні методи
1. отримання через галогенпохідні
![]()
2. отримання через галогенпохідні і ацетиленид натрію
R-Cl + NaCCH R-CCH + NaCl
Хімічні властивості
1. приєднання галогенів (Cl2, Br2)
HCCH + Cl2 → ClCH=CHCl;
ClCH=CHCl + Cl2 → Cl2CH-CHCl2
2. приєднання галогеноводнів (HCl, HBr) за правилом Марковникова
![]()
3. гідрогенізація
![]()
4. реакція Кучерова (реакція приєднання води)
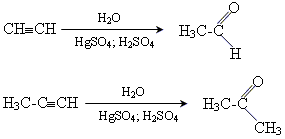
5. реакція Реппе (тримеризація ацетилену)
6. реакції утворення ацетиленідів
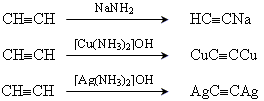
7. димеризація ацетилену з утворенням вінілацетилену
2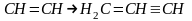
69. хім.. вла-ті і методи одержання алканів
Алкани, насичені вуглеводні— насичені ациклічні вуглеводні, що мають загальну формулу CnH2n+2, їх також називають парафінами.
ОтриманняПромислові методи
1. У промислових умовах насичені вуглеводні з довжиною ланцюга до одинадцяти атомів Карбону отримують звичайно наступними методами:• фракційна перегонка нафти;• переробка природного газу;• гідрогенізація вугілля:
2. Синтез Фішера – Тропша
Лабораторні методи
1. Гідроліз карбіду алюмінію
Al4C3 +12H2O 4Al(OH)3+3CH4
2. Декарбоксилювання
Синтез Вюрца
2СН3Сl+2Na → C2H6+2NaCl;
2R-Br+2Na → R-R+2NaBr
3. Гідрування (гідрогенізація) алкенів
Хімічні властивості
1. Реакції окиснення:
горінняCnH2n+2 + (3n+1)/2O2 = nCO2 + (n+1)H2O
отримання синтез-газу (промисловий метод)
отримання формальдегіду
![]()
2. Піроліз метану
промисловий метод отримання сажі і водню
промисловий метод отримання ацетилену
3. Крекінг алканів
4. Дегідрогенізація (дегідрування) алканів
5. Галогенування (Cl2, Br2)
72. Хім вла-ті та методи одерж. Ненасиченим вуглеводням протиставляються алкани — насичені вуглеводні. Ненасиченими називаються вуглеводні, що мають хоча б один подвійний або потрійний (кратний) карбон-карбонний зв’язок.
Отримання
Промислові методи
1. Крекінг алканів нафти
Лабораторні методи
1. Дегідратація спиртів
2. Відщеплення галогенів (Cl, Br)
3. Гідрування алкінів
Хімічні властивості
1. Реакція гідрування
2. Реакція Вагнера (окиснення перманганатом Калію у лужному середовищі)
4. Реакції приєднання HBr і HCl
Правило Марковникова: У результаті приєднання галогеноводнів до несиметричних алкенів Гідроген приєднується до найбільш гідрогенізованого атому Карбону.
5. Реакції приєднання Br2 і Cl2
6. Реакції приєднання води (за правилом Марковникова)
7. Реакції полімеризації
75.хім в-ті і методи одержання спиртів
Спирти є досить поширеними сполуками у природі і виконують в живих організмах різноманітні функції. Ще більш поширеними сполуками є похідні спиртів, серед яких перш за все слід відзначити складні ефіри Отримання
1. Отримання етиленгліколю
• отримання з етилену
CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl
Cl-CH2-CH2-Cl + H2O → OH-CH2-CH2-OH • отримання за реакцією Вагнера
2. Отримання гліцерину
звичайно гліцерин отримують при лужному гідролізі жирів
Етиленгліколь вступає у всі реакції, що є характерними для одноатомних спиртів, але є і особливості пов'язані з наявністю двох гідроксогруп.
1. реакція з лужними металами дає два ряди гліколятів
OH-CH2-CH2-OH + Na → OH-CH2-CH2-ONa + 1/2H2;
OH-CH2-CH2-OH + 2Na → Na-CH2-CH2-ONa + H2
2. при взаємодії з галогеноводневими кислотами (HCl або HBr) легко заміщується лише одна гідроксогрупа
OH-CH2-CH2-OH + HCl → Cl-CH2-CH2-OH + H2O
3. на відміну від одноатомних спиртів, характерною особливістю етиленгліколю є реакція взаємодії з гідроксидом Купруму, в результаті якої утворюється розчинний комплекс яскраво-синього забарвлення
![]()
Гліцерин за своїми властивостями більш подібний до етиленгліколю, ніж до одноатомних спиртів Як і етиленгліколь, гліцерин при взаємодії з гідроксидом Купруму утворює з комплекс яскраво-синього забарвлення.
1. реакція гліцерину з гідроксидом Купруму(ІІ)
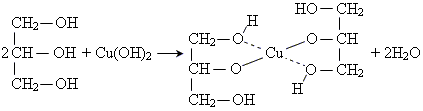
78 хім. В-ті і методи одержання
Карбонові кислоти — це органічні сполуки, до складу молекул яких входить карбоксильна функціональна група:сооh
Отримання
1. окислення спиртів або альдегідів
Отримання мурашиної кислоти
1. каталітичне окислення метану
2CH4 + 3O2 → 2H-COOH + 2H2O
2. Взаємодія оксиду Карбогену(ІІ) з гідроксидом Натрію при нагріванні
CO + NaOH → H-COONa;
H-COONa + H2SO4 → H-COOH + NaHSO4
Отримання оцтової кислоти
1. каталітичне окислення бутану
2CH3–CH2–CH2–CH3 + 5O2 → 4CH3COOH + 2H2O
2. Взаємодія оксиду Карбогену(ІІ) з метанолом
CH3OH + CO → CH3COOH
Хімічні властивості
1. карбонові кислоти проявляють всі властивості характерні для неорганічних кислот і є слабкими електролітами:
2СH3COOH + 2Na → 2CH3COONa + H2
2СH3COOH + Na2O → 2CH3COONa + H2O;
СH3COOH + NaOH → CH3COONa + H2O;
2СH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2
СH3COOH + NaHCO3 → CH3COONa + H2O + CO2
СH3COONa + H2SO4 → CH3COOH + NaHSO4
2. утворення складних ефірів (реакція етерифікації) у присутності каталізатора - сульфатної кислоти:
Зворотна реакція називається омиленням або гідролізом складного ефіру.
81)Найважливішою хімічною властивістю естерів є реакція з водою – гідроліз. При нагріванні естеру в присутності розчину лугу естер взаємодіє з водою, знову перетворюючись на кислоту і спирт.
Взаємодія естеру з водою, що призводить до утворення вихідних спирту і кислоти, називається реакцією гідролізу, або омилення.
*кислотний гідроліз (каталізатор - йони Гідрогену) оборотний: C2H5OOCCH3 +Н2О= C2H5OH + CH3COOH
*лужний гідроліз (каталізатор - йони гідроксигрупи) необоротний, оскільки утворюється сіль карбонової кислоти:
C2H5OOCCH3 + NaOH = C2H5OH + CH3COONa
84) Алкани є найпростішими вуглеводнями. Всі атоми вуглецю в молекулах алканів сполучені один з одним простими, одинарними зв'язками. Алкани називають також парафінами, насиченими вуглеводнями. CnH2n+2.За агрегатним складом алкани діляться на газоподібні (С1-С4), рідкі (С5-С17) і тверді (починаючи з С18. Першим членом гомологічног ряду алканів, який має ізомери, є бутан С4Н10.
87) Етиленові вуглеводні (алкени)- вуглеводні аліфатичного ряду, які містять один подвійний зв’язок. Загальна формула СnH2n. Вони становлять гомологічний ряд, першим представником якого є етилен СН2=СН2. починаючи з С4Н8, характерна структурна ізомерія (ізомерія вуглецевого скелета, ізомерія положення подвійного зв’язку), а також геометрична (цис-, транс-) ізомерія, що зумовлено значним бар’єром обертання навколо подвійного зв’язку.
90)К належить до 1 аналіт групи катіонів. 2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6]+ 2NaCl, утвориться кристал. осад подвійної комплексної солі жовтого кольору
Йод належить до 2 аналіт групи аніонів. 2КI + Cl2 = I2 + 2КCl. Колір стає рожево-фіолетовим
91) KNO3- білий CuSo4- блакитний NaCl - мутний NiCl2- салатовий Co(NO3)2- рожевий FeCl3-помаранчевий KMnO4- малиновий K2Cr2O7- помаранчево-червоний
92) К належить до 1 аналіт групи катіонів. 2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6]+ 2NaCl, утвориться кристал. осад подвійної комплексної солі жовтого кольору
Бром належить до 2 аналіт групи аніонів. 2NaBr + Cl2 = 2NaCl + Br2. Бензол, що екстрагує вільний бром, утворює кільце жовтого кольору.
96) Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl– = AgCl¯;
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–
CoCl2+ 2AgNO3 = 2AgCl¯ + Co(NO3)2
97) 2KMnO4 + 16 HCl = 2 MnCl2 + 2 KCl + 5 Cl2↑ + 8 H2O
Mn7++ 5ел = Mn 2+ –окиснення, відновник
2Cl-1 – 2ел = Cl20 – відновлення, окисник
K2Cr2O7 + 14HCl = 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Cr6++ 3ел = Cr 3+ –окиснення, відновник
2Cl-1 – 2ел = Cl20 – відновлення, окисник
98) Sr належить до 3 аналіт групи катіонів. SrCl2 + CaSO4= SrSO4↓+ CaCl2 утвориться кристал. осад білого кольору
NO3- належить до 3 аналіт групи аніонів. Дифеніламін окислюється аніонами NO3- до продукту темно-синього кольору. Тому треба додати конц р-н Н2SO4 і дифеніламін.
100) Al належить до 4 аналіт групи катіонів. AlCl3+ NH4OH + NH4Cl + C14H6O2(OH)2=алізарин=комплексна сполука р-н червоного кольору
SO4 належить до 1 аналіт групи аніонівvNa2SO4 + BaCl2 = BaSO4↓+ утворюється білий осад не розчинний у кислотах.
101-102. 1) 2 KMnO4 +3 Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
Mn+7 + 3e = Mn+4 |3|6|2 – окисник
S+4 – 2e = S+6 |2| |3 – відновник
2) 6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O
Fe+2 – 1е = Fe+3 |1|3|3 - відновник
N+5 + 3e = N+2 |3| |1 – окисник
103. CrCl3 – зелений колір (хром) – 4 аналітична група катіонів, 2 – аніонів
Катіон: CrCl3 + 4 NaOH = Na[Cr(OH)4]↓ + 3NaCl – осад , нагріти до зміни забарвлення із зеленого на жовте.
Аніон: СrCl3 + AgNO3 = AgCl↓ + Cr(NO3)3 – білий осад
104. 1) (NH4)2C2O4 + CaCl2 = 2NH4Cl + CaC2O4↓
2 NH4+ + C2O42- + Ca2+ + 2Cl- = 2 NH4+ + 2Cl- + CaC2O4↓
C2O42- + Ca2+ = CaC2O4↓
2) SrCl2 + CaSO4 = SrSO4↓ + CaCl2
Sr2+ + 2Cl- + Ca2+ + SO42- = SrSO4↓ + 2Cl- + Ca2+
Sr2++ SO42- = SrSO4↓
105. Ni(NO3)2 – зелений колір (нікель), 6 аналітична група катіонів, 3 – аніонів
Катіон: Ni(NO3)2 + 6NH3 = [Ni(NH3)6] (NO3)2 ↓ - реактив Чугаєва дає забарвлений в малиновий колір осад
Аніон: Дифеніламін (C6H5)2NH у сильнокислому середовищі взаємодіє з нітрат-йонами (та іншими окисниками в тому числі NO2--іонами), утворюючи сполуку синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
106. Ca2+ - цеглисто-червоний
Sr2+ - карміново-червоний
Ba2+ - жовто-зелений
Na+ - яскраво жовтий
K+ - фіолетовий
107. Al(NO3)3
Катіон 4: Al(NO3)3 + Алізарин (1,2-діокси-антрахінон) = утворює комплексну сполуку червоного кольору Алюміній алізаринат Al(OH)2[C14H6O3(OH)], яка не розчиняється в ацетатній кислоті.
Аніон 3: Al(NO3)3 + дифеніламін (C6H5)2NH = утворюється сполука синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
108. 1) К+ Натрій гексанітрокобальтат (III) Na3[Co(NO2)6] (фармакопейна реакція). Ця комплексна сполука у нейтральному або ацетатнокислому середовищі утворює з йонами K+ важкорозчинний жовтий кристалічний осад подвійної солі K2Na[Co(NO2)6]: 2K+ + Na3[Co(NO2)6] = K2Na[Co(NO2)6]¯ + 2Na+
2) Na+ Мікрокристалоскопічна реакція з цинкуранілацетатом Zn(UO2)3(CH3COO)8. Йони Na+ в оцтовокислому середовищі взаємодіють з (Zn(UO2)3(CH3COO)8 + СН3СООН), при цьому утворюється осад зеленувато-жовтого кольору: NaCl + Zn(UO2)3(CH3COO)8 + СН3СООН = Na Zn(UO2)3(CH3COO)9 + HCl
3) NH4+ Їдкі луги (NaOH або KOH) (фармакопейна реакція) під час нагрівання з розчинами солей амонію виділяють аміак: NH4+ + OH– = NH3 +H2O.
Калій тетрайодомеркурат (II) K2[HgI4] у KOH (реактив Неслера) з йонами NH4+ утворює червоно-бурий осад : NH4+ + 2[HgI4]2– + 4OH– = [NH2Hg2O]I¯ + 7I– + 3H2O
109. Na3PO4
Катіон1: Na3PO4 + 3Zn(UO2)3(CH3COO)8 + 3СН3СООН = 3Na Zn(UO2)3(CH3COO)9 + H3PO4 - утворюється осад зеленувато-жовтого кольору
Аніон 1: Na3PO4 + 12(NH4)2MoO4 + 21HNO3 = (NH4)3[P(Mo3O10)4]¯ +21NH4NO3 + NaNO3 +12H2O – осад білого кольору
110. 108
111. ZnSO4
Катіон4: Дитизон (дифенілтіокарбазон) у розчині чотирихлористого вуглецю (або хлороформу) з іонами Zn2+ утворює внутрішньокомплексну сполуку яскраво-червоного кольору
Аніон 1: ZnSO4 + BaCl2 = BaSO4¯ + Zn Cl2 - утворює білий кристалічний осад, який майже не розчиняється у воді й кислотах
112-113. [Ag(NH3)2]Cl – диамінаргентум(І) хлорид. Центр атом Ag+, координат. число – 2.
[NH2Hg]Cl – амін меркурій хлорид. Центр атом Нg2+, координат. число – ?.
114. КІ
Катіон1 : 2KІ + Na3[Co(NO2)6] = K2Na[Co(NO2)6]¯ + 2NaІ – кристалічний осад жовтого кольору
Аніон 1: 2КI + Cl2 = I2 + 2КCl – утворюється кільце рожево-фіолетового кольору.
115-116. K3[Fe(CN)6] – трикалій гексаціаноферат(ІІІ). Центр атом Fe 3+, координат. число – 6.
Na[Cr(OH)4] - натрій тетрагідроксохромат(ІІІ). Центр атом С r3+, координат. число – 4.
117. NH4NO3
Катіон1: NH4 NO3+ KOH = NH3 + KNO3+H2O – характерний запах, посиніння вологого лакмусового папірця
Аніон3: Дифеніламін (C6H5)2NH у сильнокислому середовищі взаємодіє з нітрат-йонами (та іншими окисниками в тому числі NO2--іонами), утворюючи сполуку синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
118-119. [Cu(NH3)4](NO2)2 – тетраамін купрум(ІІ) динітрит. Центр атом Сu 2+, координат. число – 4.
K2[HgI4] – дикалій тетрайодомеркурат(ІІ). Центр атом Hg2+, координат. число – 4.
120. Характерна реакція на катіон Mg2+
Натрій або амоній гідрогенфосфат (фармакопейна реакція) з йонами Mg2+, якщо є водний розчин аміаку і NH4Cl, утворює білий кристалічний осад MgNH4PO4 × 6H2O:
Mg2+ + HPO42– + NH3 + 6H2O = MgNH4PO4 × 6H2O¯
Mg(NO3)2 + Na2HPO4 + NH4OH = MgNH4PO4¯ + 2NaNO3 + H2O
Характерна реакція на аніон NO3-
Дифеніламін (C6H5)2NH у сильнокислому середовищі взаємодіє з нітрат-йонами (та іншими окисниками в тому числі NO2--йонами), утворюючи сполуку синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
121. 1) Гексанітрокобальтат(III) натрія
2) Гексаціаноферат(III) заліза(II)
123. Характерна реакція на катіон Mg2+
Натрій або амоній гідрогенфосфат (фармакопейна реакція) з йонами Mg2+, якщо є водний розчин аміаку і NH4Cl, утворює білий кристалічний осад MgNH4PO4 × 6H2O:
Mg2+ + HPO42– + NH3 + 6H2O = MgNH4PO4 × 6H2O¯
MgSO4+ Na2HPO4 + NH4OH = MgNH4PO4¯ + Na2SO4 + H2O
Характерна реакція на аніон SO42–
Барій хлорид (фармакопейна реакція), взаємодіючи з сульфат-йонами, утворює білий кристалічний осад, який майже не розчиняється у воді й кислотах:
SO42– + Ba2+ = BaSO4¯
MgSO4 + BaCl2 = BaSO4¯ + MgCl2
127. Характерна реакція на катіон Mg2+
Натрій або амоній гідрогенфосфат (фармакопейна реакція) з йонами Mg2+, якщо є водний розчин аміаку і NH4Cl, утворює білий кристалічний осад MgNH4PO4 × 6H2O:
Mg2+ + HPO42– + NH3 + 6H2O = MgNH4PO4 × 6H2O¯
MgСl2 + Na2HPO4 + NH4OH = MgNH4PO4¯ + 2NaCl + H2O
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl– = AgCl¯;
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–
MgCl2 + 2AgNO3 = 2AgCl¯ + Mg(NO3)2
131. Характерна реакція на катіон Mn2+
Натрій бісмутат у розчині нітратної кислоти окиснює йони Mn2+ до MnO4– за рівнянням:
2Mn2+ + 5BiO3– + 14H+ = 2MnO4– + 5Bi3+ + 7H2O
2MnSO4 + 16HNO3 + 5NaBiO3 = 2HMnO4 + 5Bi(NO3)3 + 2Na2SO4 + NaNO3 + 7H20
За наявності катіонів Mn2+ розчин набирає малино-фіолетового кольору.
Характерна реакція на аніон SO42–
Барій хлорид (фармакопейна реакція), взаємодіючи з сульфат-йонами, утворює білий кристалічний осад, який майже не розчиняється у воді й кислотах:
SO42– + Ba2+ = BaSO4¯
MnSO4 + BaCl2 = BaSO4¯ + MnCl2
135. Характерна реакція на катіон Mn2+
Натрій бісмутат у розчині нітратної кислоти окиснює йони Mn2+ до MnO4– за рівнянням:
2Mn2+ + 5BiO3– + 14H+ = 2MnO4– + 5Bi3+ + 7H2O
2MnCl2 + 5HNO3 + 16NaBiO3 = 2HMnO4 + 5Bi(NO3)3 + 4NaCl + NaNO3 + 7H20
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl– = AgCl¯;
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–
MnCl2 + 2AgNO3 = 2AgCl¯ + Mn(NO3)2
139. Характерна реакція на Cd2+
Амоній або Натрій сульфід (NH4)2S або Na2S. Йони Cd2+ з сульфід-йонами утворюють жовтий осад Кадмій сульфіду. Реакція відбувається в нейтральному або кислому середовищі:
Cd2+ + HS- = CdS¯ + H+
Cd(NO3)2 + H2S = CdS¯ + 2HNO3
Характерна реакція на аніон NO3-
Дифеніламін (C6H5)2NH у сильнокислому середовищі взаємодіє з нітрат-йонами (та іншими окисниками в тому числі NO2--йонами), утворюючи сполуку синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
