
- •1. Отримання і хімічні властивості алканів
- •4.Одерж.Та хім.Власт. Гідркосикислот.
- •1.Для карбоксильної групи
- •2. Для спиртових гідроксидів
- •3. Для гідрокислот
- •3. Алкенові вуглеводні.
- •6. Одержання та власт. Ароматичних вуглеводнів.
- •9. Отримання і хімічні властивості альдегідів
- •11. 2,4,6 Триметилнонан
- •12.Реакції альдегідів та кетонів.
- •15.Гідроксикислоти.Одержання, власт,оптична ізомерія
- •18.Жири, їх будова, класифікація та властивості.
- •Отримання і хімічні властивості естерів
- •2 Бром 3 метил пентан
- •3Метилбутан-1-ол
- •33.Отримання і хімічні властивості альдегідів
- •39 Отримання і хімічні властивості альдегідів
- •Отримання і хімічні властивості кетонів
- •48.Методи одержання і властивості багатоатомних спиртів
- •49.Ацетилен-бензен-толуен-бенз кис---м-нітробенз кис –хлорангідрид бенз кис--ізопропіловийестер м-нітробенз кис
- •51. Методи одержання та властивості галогенопохідних вуглеводнів.
- •2. Отримання етанолу
- •57. Отримання і хімічні властивості циклоалканів
- •60. Отримання і хімічні властивості ароматичних вуглеводнів
- •63. Отримання і властивості дієнових вуглеводнів.
- •2. Піроліз метану
- •140. Реакції
- •151. CoSo4
- •157. CaCo3
48.Методи одержання і властивості багатоатомних спиртів
1. Добування етиленгліколю. Вихідною речовиною для синтезу етиленгліколю є етилен, з якого одержують етиленгліколь в одну стадію – окисненням калій перманганатом в слабколужному середовищі за реакцією Вагнера
або в дві стадії
– при дії на етилен бромом спочатку
одержують 1,2-диброметан, який далі
обробляють водним розчином лугу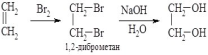
2.
Добування
гліцерину.
Гліцерин добувають гідролізом рослинних
чи тваринних жирів.
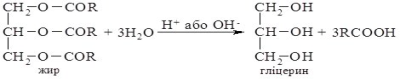
Фізичні властивості.
Етиленгліколь та гліцерин – безбарвні в’язкі рідини, з високою температурою кипіння, солодкі на смак. Змішуються у всіх співвідношеннях з водою та етиловим спиртом.
Хімічні властивості
1. Кислотні властивості. Порівняно з одноатомними спиртами, багатоатомні спирти виявляють сильніші кислотні властивості. Це зумовлено електроноакцепторним впливом гідроксильних груп одна на одну і, як наслідок, більшою поляризацією зв’язку О–Н. Етиленгліколь при взаємодії з натрієм, залежно від співвідношення реагентів, утворює як повні так і неповні гліколяти:
Особливістю багатоатомних спиртів є їх здатність розчиняти купрум (ІІ) гідроксид, при цьому з’являється характерне синє забарвлення розчину. При взаємодії багатоатомних спиртів з Cu(OH)2 утворюються комплексні сполуки, у яких поряд з ковалентними зв’язками Cu–O є і донорно-акцепторні зв’язки Cu←O:
Взаємодія з Cu(OH)2 – якісна реакція на багатоатомні спирти.
2. Утворення естерів. Етиленгліколі та гліцерин, як і одноатомні спирти, здатні утворювати естери з мінеральними та карбоновими кислотами.Тринітрат гліцерину або тринітрогліцерин – важка масляниста рідина, яку застосовують у виробництві ліків та вибухових речовин.
49.Ацетилен-бензен-толуен-бенз кис---м-нітробенз кис –хлорангідрид бенз кис--ізопропіловийестер м-нітробенз кис
2)С6Н6+СН3CL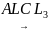 C6H5CH3+HCL
C6H5CH3+HCL
3)C6H5CH3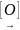 C6H5
C6H5
4)C6H5COOH+HNO3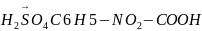 +H2O
+H2O
5)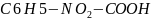 +PCL5=C6H5-NO2-CO-CL+POCL3+HCL
+PCL5=C6H5-NO2-CO-CL+POCL3+HCL
6)C6H5-NO2-CO-CL+H3C-H2C-COOH C6H5-NO2-COOC3H7+H2O
C6H5-NO2-COOC3H7+H2O
50. 2-метилпента-1,3-дієн
2-метилпента-1,3-дієн СН2=С(СН3)-СН=СН-СН3
2)малеїнова
к-та НООС-СН=СН-СООН
СН2=С(СН3)-СН=СН-СН3
2)малеїнова
к-та НООС-СН=СН-СООН
51. Методи одержання та властивості галогенопохідних вуглеводнів.
До галогенпохідних вуглеводнів відносять органічні сполуки, що є продуктами заміщення одного або декількох атомів Гідрогену на галоген у молекулі вуглеводню.
Отримання
1. фторування CnH2n+2 + (3n+1)F2= nCF4 + (2n+2)HF;
R-H + 2CoF3=R-F + 2CoF2 + HF
2. хлорування і бромування CnH2n+2 + Hal2=CnH2n+1Hal + Hhal.
3. отримання похідних йоду R-Cl + NaI=R-I + NaCl.
4. взаємодія галогеноводнів зі спиртами R-OH + HCl = R-Cl + H2O
взаємодія протікає зворотно лише у присутності сильних мінеральних кислот, наприклад, концентрованої сульфатної кислоти.
5. взаємодія галогеноводнів або галогенів з ненасиченими вуглеводнями
Хімічні властивості
1. гідроліз галогенпохідних вуглеводнів СH3–СH2–Br + H2O « СH3–CH2–OH + HBr
для зміщення рівноваги вправо додають луги, які зв'язують HBr: СH3–СH2–Br + NaOH « СH3–CH2–OH + NaBr
У присутності Ag2O гідроліз протікає практично незворотно завдяки утворенню галогенідів Срібла
2СH3–СH2–Br + Ag2O + H2O → 2СH3–CH2–OH + 2AgBr¯
2. взаємодія галогенпохідних вуглеводнів зі спиртовим розчином лугу
Правило Зайцева: При від'єднанні НХ (Х= Cl, Br. OH) атом Гідрогену відщеплюється від найменш гідрогенізованого атому Карбогену
![]()
3. реакції обміну
R-Hal + NH3=R-NH2 + NH4Hal {Hal=Cl, Br};
R-Hal + NaCN=R-CN + NaHal {Hal=Cl, Br}
54. Методи одерж та властивості одноатомних спиртів
Способи добування.
1.Гідроліз галогенопохідних. При обробці галагенопохідних водним розчином лугу, іде заміщення галогену на гідроксил.
СН3СН2Br + NaOH → СН3СН2OH + NaBr
2.Гідратація алкенів. Приєднання води до алкенів відбувається в присутності кислот (сульфатної або фосфатної):
СН2=СН2 + Н2О → СН3СН2OH
3. Відновлення
альдегідів та кетонів.
При відновленні альдегідів утворюються
первинні спирти, а кетонів – вторинні.
![]()
![]()
Отримання метанолу
• піроліз деревини
• отримання із синтез-газу СО + 2Н2 → СН3ОН
