
- •1. Отримання і хімічні властивості алканів
- •4.Одерж.Та хім.Власт. Гідркосикислот.
- •1.Для карбоксильної групи
- •2. Для спиртових гідроксидів
- •3. Для гідрокислот
- •3. Алкенові вуглеводні.
- •6. Одержання та власт. Ароматичних вуглеводнів.
- •9. Отримання і хімічні властивості альдегідів
- •11. 2,4,6 Триметилнонан
- •12.Реакції альдегідів та кетонів.
- •15.Гідроксикислоти.Одержання, власт,оптична ізомерія
- •18.Жири, їх будова, класифікація та властивості.
- •Отримання і хімічні властивості естерів
- •2 Бром 3 метил пентан
- •3Метилбутан-1-ол
- •33.Отримання і хімічні властивості альдегідів
- •39 Отримання і хімічні властивості альдегідів
- •Отримання і хімічні властивості кетонів
- •48.Методи одержання і властивості багатоатомних спиртів
- •49.Ацетилен-бензен-толуен-бенз кис---м-нітробенз кис –хлорангідрид бенз кис--ізопропіловийестер м-нітробенз кис
- •51. Методи одержання та властивості галогенопохідних вуглеводнів.
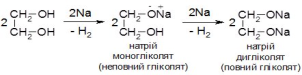
- •2. Отримання етанолу
- •57. Отримання і хімічні властивості циклоалканів
- •60. Отримання і хімічні властивості ароматичних вуглеводнів
- •63. Отримання і властивості дієнових вуглеводнів.
- •2. Піроліз метану
- •140. Реакції
- •151. CoSo4
- •157. CaCo3
3Метилбутан-1-ол
CH3-CH2 – СН(СН3)- OH
33.Отримання і хімічні властивості альдегідів
Отримання
1. окислення первинних спиртів
2. каталітична дегідрогенізація первинних спиртів
Отримання кетонів
1. окислення вторинних спиртів
34.1)CH2=CH2+HBR→CH3-CH2(-BR)
2) CH3-CH2(-BR)+KCN→CH3-CH2(-CN)+KBR
3) CH3-CH2(-CN)+2H2O→CH3-CH2-C(=O-OH)+NH3
4) CH3-CH2-C(=O-OH)+PCL5→CH3-CH2-C(=O-CL)+HCK…
5) CH3-CH2-C(=O-CL)+CH-CH(-CH3-CH3)→CH3-CH2-C(=O-O-CH(-CH3-CH3)
35. 3,5-диметилпент-1-ену
CH2=CH-CH(-CH3)-CH(-CH3)-CH3
Акролеїн(проп-2-еналь)
CH2=CH-C(=O-H)
36
Отримання і хімічні властивості фенолу
Отримання
Промислові методи отримання
1. з кам'яновугільної смоли
2. отримання з бензолу і пропену
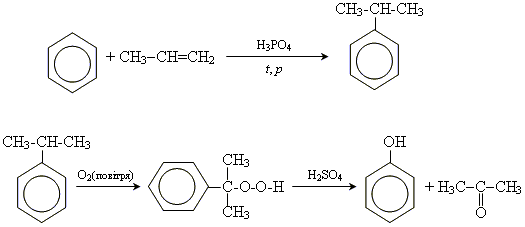
Хімічні властивості
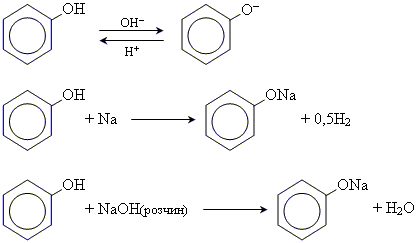
1. кислотні властивості фенолів
Кислотні властивості фенолу виражені значно сильніше, ніж у спиртів. Так феноли реагують не тільки з лужними металами, але і з водними розчинами лугів. Фенол є дуже слабкою кислотою і тому феноляти легко гідролізуються і руйнуються навіть такими слабкими кислотами, як карбонатна кислота
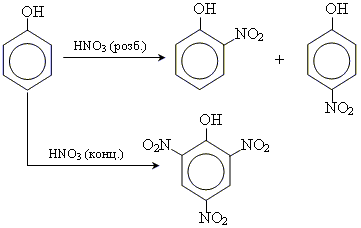
2. реакції заміщення
реакції заміщення протікають значно легше, ніж у випадку бензолу, оскільки гідроксогрупа суттєво активує бензольне ядро.
• реакція нітрування
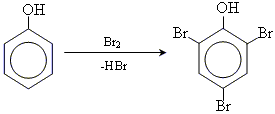
• реакції галогенування (Cl, Br)
• реакція сульфування
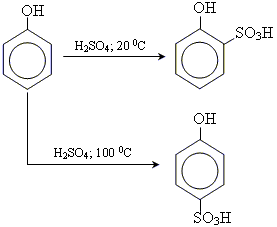
3. утворення простих ефірів
![]()
4. утворення складних ефірів
![]()
5. заміщення гідроксогрупи на галоген (протікає значно гірше, ніж у випадку спиртів)
![]()
6. відщеплення гідроксогрупи
![]()
38. 2,5-диметилгекс-3-ену
CH3-CH(-CH3)-CH=CH-CH(-CH3)-CH3
Пропанова(акрилова) к-та
CH2=CH-C(=O-OH)
39 Отримання і хімічні властивості альдегідів
Отримання
1. окислення первинних спиртів
2. каталітична дегідрогенізація первинних спиртів
Отримання оцтового альдегіду
1. каталітичне окислення етилену
2. отримання за реакцією Кучерова
Хімічні властивості
1. приєднання водню
2. реакції окислення
• окислення біхроматом калію
• реакція срібного дзеркала
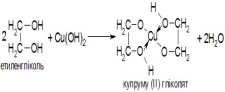
• реакція окислення гідроксидом Купруму(ІІ)
Отримання і хімічні властивості кетонів
Отримання
1. окислення вторинних спиртів
2. отримання за реакцією Кучерова
3. піроліз кальцієвих солей карбонових кислот
Хімічні властивості
1. приєднання водню
2. реакції окислення для кетонів протікають лише під дією дуже сильних окислювачів і супроводжуються розривом вуглецевого ланцюга. кетони не дають реакцію срібного дзеркала і не окислюються гідроксидом Купруму(ІІ).
40
С2Н4-С2Н5ОН-СН3СООН-СН3СОСl-(СН3СО)2О-СН3СООСН(СН3)2
С2Н4+Н2О=С2Н5ОН
С2Н5ОН+О2=СН3СООН+Н2О
СН3СООН+РСl5=СН3СОСІ+РОСІ3+НСІ
СН3СОСІ+СН3СООNa=( СН3СО)2О+NaCl
( СН3СО)2О+С3Н7= СН3СООСН(СН3)2
41.1) 4-етилгекс-3-ен СН3-СН2 –СН=С-С2Н5-СН2-СН3
2)втор-пропіловий спирт Н3С-СН-ОН-СН3
42.хімічні властивості альдегідів та кетонів
Хімічні властивості альдегідів та кетонів визначаються наявністю в їх складі карбонільної групи.
Атоми Карбону та
Оксигену в карбонільній групі перебувають
у стані sp2‑гібридизації
і зв’язані подвійним зв’язком,
![]()
Альдегіди, як правило, більш реакційноздатні, ніж кетони
Всі реакції альдегідів та кетонів можна умовно поділити на групи:
– реакції приєднання;
– реакції окиснення і відновлення;
– реакції полімеризації.
Реакції приєднання.
Приєднання ціанідної
кислоти
відбувається по карбонільній групі
альдегідів або кетонів з утворення
ціангідринів (гідроксинітрилів).
![]()
Приєднання натрій гідроген сульфіту до альдегідів і найпростіших кетонів веде до утворення “бісульфітних сполук”. Реакція проходить без каталізатора.
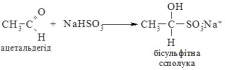
Реакції відновлення та окиснення.
Реакції відновлення
альдегідів та кетонів широко застосовують
для одержання спиртів (альдегіди
відновлюються до первинних, а кетони
– до вторинних спиртів). У промисловості
проводять гідрування карбонільних
сполук у присутності каталітичних
кількостей кобальту, нікелю або платини:
![]()
Окиснення альдегідів та кетонів відбувається по-різному. Альдегіди дуже легко окиснються, навіть при дії слабких окисників (Ag+, Cu+), вони перетворюються в карбонові кислоти:
![]()
Окиснення кетонів відбувається лише сильними окисниками – калій перманганатом або дихроматом, реакція супроводжується розривом зв’язків С‑С у молекулі кетону.
Реакції полімеризації.
Альдегіди, на
відміну від кетонів здатні полімеризуватись.
Процес проходить за звичайних умов і
прискорюється кислотами. Полімеризація
формальдегіду проходить з утворенням
![]() полімеру
лінійної структури:
полімеру
лінійної структури:
43.Ацетилен-бензен-етилбензен-бензойнакислота-хлорангідрид бен кти-амід бенз.ки-ти- бензонітрил.
1)3СН=-СН ---(акт. Вуг. 600°С)С6Н6
2)С6Н6+СН2=СН2 --- С6Н5СН2-СН3
3) С6Н5СН2-СН3 ---(О,t,p,k)С6Н5СООН +СО2+Н2О
4) С6Н5СООН+PCL5=С6Н5СОCL+POCL3+HCL
5)C6Н5СОCL+2NH3=С6Н5СОNH2+NH4CL
6) С6Н5СОNH2+POCL3=С6Н5СN+HPO2CL2+ HCL
45.методи одержання та властивості етерів
Отримання
Промислові методи отримання
1.алкілування, тобто введення в молекулу спирту алкільного залишку замість атома Гідрогену гідроксильної групи, зумовлює утворення етеру.
2.дегідратація спиртів сульфатною кислотою
2C2H5OH → C2H5─O─C2H5 + H2O
Лабораторні методи отримання
2. отримання при взаємодії галогенпохідних алканів з алкоголятами або фенолятами
2C6H5ONa + CH3I → C6H5─O─CH3 + NaI
Фізичні властивості
Перші два члени гомологічного ряду – гази, наступні – безбарвні, леткі і горючі рідини, легші за воду. Вищі етери, починаючи від (C17H35)2O –тверді речовини. Температура кипіння етерів нижчі, ніж темп кип спиртів, із яких вони добуті. Це пояснюється відсутністю водневих зв’язків між їх молекулами і неможливістю утворення асоціатів.
Хімічні властивості
Прості ефіри, за деяким виключенням, не відрізняються різноманітністю хімічних властивостей і характеризуються інертністю до багатьох хімічних речовин.За звичайних умов на холоді етери є стійкими і мало реакційними сполуками. Вони надзвичайно важко гідролізують, не взаємодіють з металевим натрієм, лугами, більшістю кислот. Серед реакцій етерів слід зазначити, перш за все, реакції утворення міжмолекулярних комплексів і реакції окиснення з утворенням пероксидів.
1.горіння.
вони легше горять і ця реакція може відбуватися з вибухом.
2.взаємодія з йодоводнем відбувається під час нагрівання і зумовлює розрив зв’язку С-О: R-O-R+HI = R-I(алкіліодид) + R-OH(спирт)
3. утворення пероксидів у присутності кисню повітря: 2(C2H5)2O + O2 → 2C2H5─O─O─C2H5
4. взаємодія з металічним натрієм під час нагрівання також зумовлює розщеплення етерів: R-O-R’ +2Na = R-ONa(алкоголят) + Na –R’(натрій органічна сполука)
46.ацетилен-бензен-ізоропілбензен-бензойна кис-амідбенз кисл-бензонітрил
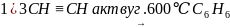
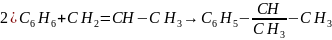

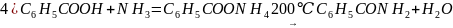
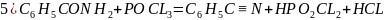
47.1)2-метилпент-1-ен
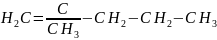
2)НСООС2Н5 етилформіат
