
- •1. Отримання і хімічні властивості алканів
- •4.Одерж.Та хім.Власт. Гідркосикислот.
- •1.Для карбоксильної групи
- •2. Для спиртових гідроксидів
- •3. Для гідрокислот
- •3. Алкенові вуглеводні.
- •6. Одержання та власт. Ароматичних вуглеводнів.
- •9. Отримання і хімічні властивості альдегідів
- •11. 2,4,6 Триметилнонан
- •12.Реакції альдегідів та кетонів.
- •15.Гідроксикислоти.Одержання, власт,оптична ізомерія
- •18.Жири, їх будова, класифікація та властивості.
- •Отримання і хімічні властивості естерів
- •2 Бром 3 метил пентан
- •3Метилбутан-1-ол
- •33.Отримання і хімічні властивості альдегідів
- •39 Отримання і хімічні властивості альдегідів
- •Отримання і хімічні властивості кетонів
- •48.Методи одержання і властивості багатоатомних спиртів
- •49.Ацетилен-бензен-толуен-бенз кис---м-нітробенз кис –хлорангідрид бенз кис--ізопропіловийестер м-нітробенз кис
- •51. Методи одержання та властивості галогенопохідних вуглеводнів.
- •2. Отримання етанолу
- •57. Отримання і хімічні властивості циклоалканів
- •60. Отримання і хімічні властивості ароматичних вуглеводнів
- •63. Отримання і властивості дієнових вуглеводнів.
- •2. Піроліз метану
- •140. Реакції
- •151. CoSo4
- •157. CaCo3
Отримання і хімічні властивості естерів
Отримання
1. Етерифікація за Фішером (взаємодія спиртів і карбонових кислот у присутності сильних неорганічних кислот, наприклад, сульфатної кислоти)
C2H5OH + CH3COOH = C2H5OOCCH3
Дана реакція є зворотною і умови її протікання залежать від природи вихідних речовин.
Хімічні властивості
1. Кислотний гідроліз
C2H5OOCCH3 = C2H5OH + CH3COOH
2. Лужний гідроліз
C2H5OOCCH3 + NaOH = C2H5OH + CH3COONa
На відміну від кислотного лужний гідроліз естерів протікає незворотно.
22.1.CH2=CH-CH3+HOH→CH3-CH(-OH)-CH3
2.CH3-CH(-OH)-CH3+HBR→CH3-CH(-BR)-CH3+H20
3.CH3-CH(-BR)-CH3+CH3-CH2-OH→CH3-CH3-CH-O-CH2-CH3+HBR
23. 2-бром-3-метилгептану
CH3-CH(-BR)-CH(-BR)-CH2-CH3
Втор бромистий бутил
CH3-CH2-CH(-OH)-CH2BR
22.
Пропілен – ізопропіловий спирт-2бромпропан-ізопропіловий естер
СН₂=СН-СН₃+ Н₂O= C3H7-ОН
C3H7-ОН+НВr =СН3-СН(-Вr)-СН3 +Н2
СН3-СН(-Вr)-СН3 + CH₃-CH₂-OH=С3Н7ОС2Н5+НВr
23
2 Бром 3 метил пентан
СН3-СН2(-Вr)-СН2(-С2Н5)-СН2-СН3
Втор бутил бромистий
Вr-СН(-СН3)-СН2-СН3
24
Отримання і хімічні властивості двоосновних карбонових кислот Методи отримання дикарбонових кислот Найбільш поширеним способом синтезу вищих двоосновних кислот є окислення циклічних кетонів. Також вищі дикарбонові кислоти можна одержувати з тетрахлоралканов. Необхідні галогеналкани синтезують з реакції теломеризації з етилену і чотирьоххлористого вуглецю. Кислоти з парним числом вуглецевих атомів у скелеті можуть бути отримані електролізом солей кислих ефірів нижчих двоосновних кислот. Властивості дикарбонових кислот Двохосновні карбонові кислоти виявляють властивості, характерні для одноосновних кислот - вони утворюють солі, складні ефіри, хлорангідриди та аміди. Крім цього, вони здатні вступати в специфічні реакції, наприклад, освіта циклічних ангідридів, двох різних рядів складних ефірів (кислих і повних) і змішаних похідних. Дикарбонові кислоти мають дві константи дисоціації, що відповідають кожній з двох карбоксильних груп. Зі збільшенням кількості вуглецевих атомів між групами і стають практично рівними і прагнуть до відповідної одноосновної кислоти. Проте, коли карбоксігруппи розташовані поруч, їх константи істотно відрізняються один від одного. Це обумовлено тим, що коли відривається перший протон, молекула стає зарядженим іоном, і їй вже набагато складніше віддати другий атом водню.
25. 1)CH2-(CH2)-CH2+BR2→CH2(-BR)-CH2-CH2(-BR)
2) CH2(-BR)-CH2-CH2(-BR)+2KCN→ CH2(-CN)-CH2-CH2(-CN)+2KBR
3) CH2(-CN)-CH2-CH2(-CN)+4H2O→CH2(-C=O-OH)-CH2-CH2(-C=O-OH)+2NH3
4) CH2(-C=O-OH)-CH2-CH2(-C=O-OH)+2PCL5→ CH2(-C=O-CL)-CH2-CH2(-C=O-CL)+2HCL+2POCL3
26.6-метилгепт-3-ину
CH3-CH2-C≡C-CH2-CH(-CH3)-CH3
3,3-диметилбутен-2-олу
CH3-C(-CH3-CH3)-CH(-OH)-CH3
27.
Отримання і хімічні властивості одноосновних карбонових кислот
Отримання
1. окислення спиртів або альдегідів
![]()
Отримання мурашиної кислоти
1. каталітичне окислення метану
2CH4 + 3O2 → 2H-COOH + 2H2O
2. Взаємодія оксиду Карбогену(ІІ) з гідроксидом Натрію при нагріванні
CO + NaOH → H-COONa;
H-COONa + H2SO4 → H-COOH + NaHSO4
Отримання оцтової кислоти
1. каталітичне окислення бутану
2CH3–CH2–CH2–CH3 + 5O2 → 4CH3COOH + 2H2O
2. Взаємодія оксиду Карбогену(ІІ) з метанолом
CH3OH + CO → CH3COOH
Отримання ароматичних кислот
1. окислення гомологів бензолу
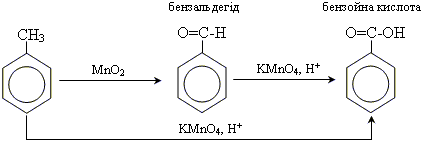
Хімічні властивості
1. карбонові кислоти проявляють всі властивості характерні для неорганічних кислот і єслабкими електролітами:
2СH3COOH + 2Na → 2CH3COONa + H2
2СH3COOH + Na2O → 2CH3COONa + H2O;
СH3COOH + NaOH → CH3COONa + H2O;
2СH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2
СH3COOH + NaHCO3 → CH3COONa + H2O + CO2
СH3COONa + H2SO4 → CH3COOH + NaHSO4
2. утворення складних ефірів (реакція етерифікації) у присутності каталізатора - сульфатної кислоти:
![]()
Зворотна реакція називається омиленням або гідролізом складного ефіру.
28. 1)CH2=CH2+CL2→CH2(-CL)-CH2(-CL)
2) CH2(-CL)-CH2(-CL)+2KCN→ CH2(-CN)-CH2(-CN)+2KCL
3) CH2(-CN)-CH2(-CN)+4H2O→ CH2(-C=O-OH) -CH2(-C=O-OH)+2NH3
4) CH2(-C=O-OH) -CH2(-C=O-OH)+2CH3-CH2-OH→ CH2(-C=O-O-CH2-CH3) -CH2(-C=O-O-CH2-CH3)+2H2O
29. 5-метилгекс-2-ину
CH3-C≡C-CH2-CH(-CH3)-CH3
Метилетилкетон
CH3-C(=O)-CH2-CH3
31
Пропан-1-ол-пропілен-ізопропіловий спирт-ацетон-2.2дихлорпропан
С3Н8О = СН₂=СН-СН₃+Н2О
СН₂=СН-СН₃+Н2О=С3Н7ОН
СН3-СН(-ОН)-СН3=СН3СОСН3+Н2
СН3-СО-СН3+РСl5=CH3-CCL2-CH3+POCl3
32.
Ізобутилен
![]()
