
- •1. Отримання і хімічні властивості алканів
- •4.Одерж.Та хім.Власт. Гідркосикислот.
- •1.Для карбоксильної групи
- •2. Для спиртових гідроксидів
- •3. Для гідрокислот
- •3. Алкенові вуглеводні.
- •6. Одержання та власт. Ароматичних вуглеводнів.
- •9. Отримання і хімічні властивості альдегідів
- •11. 2,4,6 Триметилнонан
- •12.Реакції альдегідів та кетонів.
- •15.Гідроксикислоти.Одержання, власт,оптична ізомерія
- •18.Жири, їх будова, класифікація та властивості.
- •Отримання і хімічні властивості естерів
- •2 Бром 3 метил пентан
- •3Метилбутан-1-ол
- •33.Отримання і хімічні властивості альдегідів
- •39 Отримання і хімічні властивості альдегідів
- •Отримання і хімічні властивості кетонів
- •48.Методи одержання і властивості багатоатомних спиртів
- •49.Ацетилен-бензен-толуен-бенз кис---м-нітробенз кис –хлорангідрид бенз кис--ізопропіловийестер м-нітробенз кис
- •51. Методи одержання та властивості галогенопохідних вуглеводнів.
- •2. Отримання етанолу
- •57. Отримання і хімічні властивості циклоалканів
- •60. Отримання і хімічні властивості ароматичних вуглеводнів
- •63. Отримання і властивості дієнових вуглеводнів.
- •2. Піроліз метану
- •140. Реакції
- •151. CoSo4
- •157. CaCo3
157. CaCo3
Характерна реакція на катіон Са2+
Амоній оксалат утворює з йонами Са2+ кристалічний осад кальцію оксалату білого кольору, який розчиняється у НСl, але не розчиняється в СН3СООН:
CaCO3 + (NH4)2C2O4 = (NH4)2CO3 + CaC2O4
Характерна реакція на аніон CO32-
Мінеральні кислоти (фармакопейна реакція) (розведені повільно, концентровані енергійніше), а також ацетатна кислота, виділяють вуглекислий газ:
CO32- + 2H+ = CO2 + H2O
Ca(OH)2 + CO2 = CaCO3 ¯ + H2O
158. Дано:V(HCl)=20мл=0,02л
V(NaOH)=15мл=0,015л
Сн(NaOH)=0,2Н
Сн(HCl)=?
С1 V1= С2 V2
Сн(HCl)* V(HCl)= Сн(NaOH)* V(NaOH)
Сн(HCl)= Сн(NaOH)* V(NaOH) / V(HCl)= 0,2*0,015/0,02=0,15Н
Відповідь: 0,15Н
159. Na2CO3
Характерна реакція на катіон Na+
Мікрокристалоскопічна реакція з цинкуранілацетатом Zn(UO2)3(CH3COO)8. Йони Na+ в оцтовокислому середовищі взаємодіють з (Zn(UO2)3(CH3COO)8 + СН3СООН), при цьому утворюється осад зеленувато-жовтого кольору:
Na2CO3 + 2Zn(UO2)3(CH3COO)8 + 2СН3СООН = 2Na Zn(UO2)3(CH3COO)9 + H2CO3
Характерна реакція на аніон CO32-
Мінеральні кислоти (фармакопейна реакція) (розведені повільно, концентровані енергійніше), а також ацетатна кислота, виділяють вуглекислий газ:
CO32- + 2H+ = CO2 + H2O
NaOH + CO2 = NaCO3 ¯ + H2O
161. Характерна реакція на катіон Na+
Мікрокристалоскопічна реакція з цинкуранілацетатом Zn(UO2)3(CH3COO)8. Йони Na+ в оцтовокислому середовищі взаємодіють з (Zn(UO2)3(CH3COO)8 + СН3СООН), при цьому утворюється осад зеленувато-жовтого кольору:
NaCl + Zn(UO2)3(CH3COO)8 + СН3СООН = Na Zn(UO2)3(CH3COO)9 ¯+ HCl
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl– = AgCl¯;
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–
NaCl + AgNO3 = AgCl¯ + NaNO3
162. Наведіть класифікацію об’ємних методів аналізу
Залежно від типу реакцій, на якій ґрунтується об’ємно-аналітичне визначення , виділяють такі методи титриметричного аналізу:
Кислотно-основне титрування(нейтралізація) – ґрунтується на реакції нейтралізації , яка супроводжується зміною концентрації йонів гідроксонію
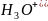 і відповідною зміною рН середовища.
і відповідною зміною рН середовища.Оксидометрія – в основі методів оксидиметрії лежать окисно-відновні реакції.
Осаджуваньне титрування – використовують рекції, в результаті яких утворюються важкорозчинні осади.
Комплексонометричне титрування – ґрунтується на реакція комплексоутворення.
163. Характерна реакція на катіон Ва2+
Калій дихромат осаджує з розчинів Ва2+ у вигляді осаду BaCrO4 жовтого кольору:
2Ba(NO3)2 + K2Cr2O7 + 2CH3COONa + H20 = 2BaCrO4 ¯ + 2KNO3 + 2NaNO3 + 2CH3COOH
Характерна реакція на аніон NO3-
Дифеніламін (C6H5)2NH у сильнокислому середовищі взаємодіє з нітрат-йонами (та іншими окисниками в тому числі NO2--йонами), утворюючи сполуку синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
165. Характерні реакції на катіон Fe3+
Калій гексаціаноферат (II) K4[Fe(CN)6] (фармакопейна реакція) утворює з йонами Fe3+ темно-синій осад Fe4[Fe(CN)6]3, так звану берлінську блакить:
4Fe3+ + 3[Fe(CN)6]4– = Fe4[Fe(CN)6]3¯
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3¯ + 12KCl
Калій або амоній тіоціанат (KSCN або NH4SCN) – з іонами Fe3+ утворює низку забарвлених у червоний колір розчинних комплексних сполук: [FeSCN]2+, [Fe(SCN)2]+, [Fe(SCN)3], [Fe(SCN)4]- тощо.
FeCl3 + 3NH4SCN = Fe(SCN)3 + 3NH4(Cl)
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl– = AgCl¯;
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–
FeCl3 + 3AgNO3 = 3AgCl¯ + Fe(NO3)3
166.
Дано: N(NaON)=0,15н V(HCl)=21,0мл N(HCl)=0,113н Знайти:V(NaOH)-?
Розв’язання:
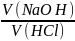 =
=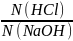 ; V(NaOH) =
; V(NaOH) =
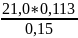 =15,82
мл.
=15,82
мл.
167. Характектерна реакція на катіони Fe2+
Калій гексаціаноферат (III) K3[Fe(CN)6] (фармакопейна реакція) утворює з йонами Fe2+ синій осад Fe3[Fe(CN)6]2, так звану турнбулеву синь:
3Fe2+ + 2[Fe(CN)6]3– = Fe3[Fe(CN)6]2¯
3FeCl2 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2¯ + 6KCl
Характерна реакція на аніон SO42–
Барій хлорид (фармакопейна реакція), взаємодіючи з сульфат-йонами, утворює білий кристалічний осад, який майже не розчиняється у воді й кислотах:
SO42– + Ba2+ = BaSO4¯
FeSO4 + BaCl2 = BaSO4¯ + FeCl2
168.
Дано:
N(NaON)=0,12н
V(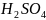 )=25,0мл
N(
)=0,2н
Знайти:V(NaOH)-?
)=25,0мл
N(
)=0,2н
Знайти:V(NaOH)-?
Розв’язання:
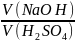 =
=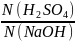
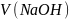 =
=
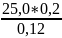 =41,6
мл.
=41,6
мл.
169. Характерна реакція на Сu2+
Водний розчин аміаку (фармакопейна реакція), доданий у надлишку, утворює з іонами Cu2+ комплексну сполуку інтенсивно-синього кольору:
2CuCl2 + 2NH4OH = (CuOH)Cl¯ + (NH4)Cl
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl– = AgCl¯;
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–
CuCl2 + 2AgNO3 = 2AgCl¯ + Cu(NO3)2
171. Характерна реакція на Сu2+
Водний розчин аміаку (фармакопейна реакція), доданий у надлишку, утворює з іонами Cu2+ комплексну сполуку інтенсивно-синього кольору:
2CuSO4 + 2NH4OH = (CuOH)2SO4¯ + (NH4)2SO4
Характерна реакція на аніон SO42–
Барій хлорид (фармакопейна реакція), взаємодіючи з сульфат-йонами, утворює білий кристалічний осад, який майже не розчиняється у воді й кислотах:
SO42– + Ba2+ = BaSO4¯
CuSO4 + BaCl2 = BaSO4¯ + CuCl2
172. Характерна реакція на катіон Ва2+
Калій дихромат осаджує з розчинів Ва2+ у вигляді осаду BaCrO4 жовтого кольору:
2BaCl2 + K2Cr2O7 + 2CH3COONa + H20 = 2BaCrO4 ¯ + 2KCl + 2NaCl + 2CH3COOH
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl– = AgCl¯;
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–
BaCl2 + 2AgNO3 = 2AgCl¯ + Ba(NO3)2
173. Метод нейтралізації застосовується для визначення концентрації кислот ,основ,а також солей,які піддаються гідролізу. Так цей мето лежить в основі визначення кислотного числа олій, кислотності молока, маргарину та деяких інших продуктів.
