
- •1. Отримання і хімічні властивості алканів
- •4.Одерж.Та хім.Власт. Гідркосикислот.
- •1.Для карбоксильної групи
- •2. Для спиртових гідроксидів
- •3. Для гідрокислот
- •3. Алкенові вуглеводні.
- •6. Одержання та власт. Ароматичних вуглеводнів.
- •9. Отримання і хімічні властивості альдегідів
- •11. 2,4,6 Триметилнонан
- •12.Реакції альдегідів та кетонів.
- •15.Гідроксикислоти.Одержання, власт,оптична ізомерія
- •18.Жири, їх будова, класифікація та властивості.
- •Отримання і хімічні властивості естерів
- •2 Бром 3 метил пентан
- •3Метилбутан-1-ол
- •33.Отримання і хімічні властивості альдегідів
- •39 Отримання і хімічні властивості альдегідів
- •Отримання і хімічні властивості кетонів
- •48.Методи одержання і властивості багатоатомних спиртів
- •49.Ацетилен-бензен-толуен-бенз кис---м-нітробенз кис –хлорангідрид бенз кис--ізопропіловийестер м-нітробенз кис
- •51. Методи одержання та властивості галогенопохідних вуглеводнів.
- •2. Отримання етанолу
- •57. Отримання і хімічні властивості циклоалканів
- •60. Отримання і хімічні властивості ароматичних вуглеводнів
- •63. Отримання і властивості дієнових вуглеводнів.
- •2. Піроліз метану
- •140. Реакції
- •151. CoSo4
- •157. CaCo3
1. Отримання і хімічні властивості алканів
Отримання
Промислові методи
1. У промислових умовах насичені вуглеводні з довжиною ланцюга до одинадцяти атомів Карбону отримують звичайно наступними методами:
• фракційна перегонка нафти;
• переробка природного газу;
• гідрогенізація
вугілля: ![]()
2. Синтез Фішера – Тропша
![]()
Лабораторні методи
1. Гідроліз карбіду алюмінію
Al4C3 +12H2O = 4Al(OH)3+3CH4
2. Декарбоксилювання
![]()
Синтез Вюрца
2СН3Сl+2Na → C2H6+2NaCl;
2R-Br+2Na → R-R+2NaBr
3. Гідрування (гідрогенізація) алкенів
![]()
Хімічні властивості
1. Реакції окиснення:
горіння
CnH2n+2 + (3n+1)/2O2 = nCO2 + (n+1)H2O
отримання синтез-газу (промисловий метод)
![]()
2. Піроліз метану
промисловий метод отримання сажі і водню
![]()
промисловий метод отримання ацетилену
![]()
3. Крекінг алканів
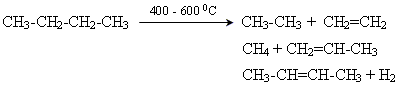
4. Дегідрогенізація (дегідрування) алканів
![]()
5. Галогенування (Cl2, Br2)
![]()
2.етилен = 1,2-дихлоретан= ацетилен=оцтовий альдегід= оцтова кисл.=етилацетат
1.CH2=CH2 + CL2 →CH2CL-CH2CL
2.CH2CL-CH2CL + 2KOH→CHΞCH + 2KCL + 2H2O
3. CHΞCH + H2O→(H2SO4,HgSO4) H3C-COH
4. H3C-COH→([O]) H3C-COOH
5. H3C-COOH + CH3-OH→ H3C-C=O-O-CH3
3. 2,4-диметил-3-ізопропілдекан
CH3-CH(CH3)-CH(CH(CH3)2)-CH(CH3)-(CH2)5-CH3
Втор. бутиловий спирт CH3-CH2-CH(OH)-CH3
4.Одерж.Та хім.Власт. Гідркосикислот.
Гідрокислоти –це похідні карбонових кислот, у радикалах яких один або кілька атомів Гідрогену заміщені на гідроксильні групи – ОН.
1) Неповне окиснення гліколей:
ОН-СН2-СН2-ОН + [O]→ ОН-СН2-СОН + H2O
ОН-СН2-СОН + [O]→ ОН-СН2-СОOН(гліколева к-та)
2) гідроліз оксинітрилів:
СН3-СН(ОН)-СΞN + 2H2O (HCL)→СН3- СН(OH)-СОOН + NH4CL
3)одержання з альдегідів
R-COH + HCN→R-(H)C(OH)-CΞN + H2O→R-CH(OH)-COOH + NH3
ХІМ. ВЛАСТ.
1.Для карбоксильної групи
1)дисоціація: СН2ОН-СООН↔ СН2ОН-СО- + ОН+
2)утв. Солей: СН3-СНОН-СООН + NaOH→
→ СН3-СНОН-СОONa + H2O
3)естерефікація: СН3-СНОН-СООН + С2Н5ОН→
→ СН3-СНОН-С=О-О- С2Н5 + Н2О
2. Для спиртових гідроксидів
1)окиснення:2СН3-СНОН-СООН + О2→2СН3-С=О-СООН+2Н2О
2)етерифікація:
СН3-СНОН-СООН + СН3ОН→ СН3-СН(-О-СН3)-СООН + Н2О
3)з галогеноводнями:
СН3-СНОН-СООН+НBr→ СН3-СНBr-СООН + H2O
3. Для гідрокислот
1)розщеплення гідрокислот:
R-(H)C(OH)-COOH→(H2SO4)→R-C(=O)-H + HCOOH
R-(R)C(OH)-COOH→( H2SO4)→ R-C(=O)-R + HCOOH
Оптична ізомерія:
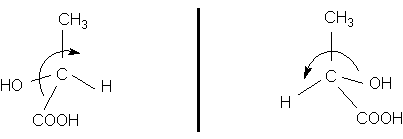
Правообертаюча молочна к-та Лівообертаюча
1.акрилова к-та = 3-бромпропанова к-та = хлорангідрид 3- бромпропанова к-ти = ізобутиловий естер 3-бромпропанова к-ти
1.CH2=CH-COOH + HBr →CH2(Br)-CH2-COOH
2. CH2(Br)-CH2-COOH + SOCL2→ CH2(Br)-CH2-COCL + SO2 + HCL
3. CH2(Br)-CH2-COCL + HO-CH2-CH(CH3)2→ CH2(Br)-CH2-C=O-O- CH2-CH(CH3)2 + HCL
2. 2,3-диметил-4-етилнонан
СН3-СН(СН3)- СН(СН3)-СН(СН2-СН3)-(СН2)3-СН3
Ізомасляний альдегід СН3-СН(СН3)-СОН
