- •1. Основные этапы развития физики полупроводников.
- •Главные направления развития электроники
- •2. Классификация веществ по удельной электрической проводимости. Основные представления о свойствах полупроводников.
- •3.Химические связи
- •7.Обратная решетка
- •8.Кристаллические структуры материалов электроники.
- •9. Дефекты кристаллического строения.
- •10.Фонон
- •1.1. Выращивание кристаллов кремния.
- •II. Следствие фазовой диаграммы ( очистка кристалла ).
- •1.1 Фазовые диаграммы и твердые растворы.
- •13. Качественная модель зонной структуры твердого тела.
- •14. Уравнение Шредингера для кристалла.
- •2.2 Уравнение Шредингера для кристалла
- •15.Адиабатическое приближение (приближение Борна - Оппенгеймера).
- •Первая зона Бриллюэна полупроводника типа алмаза
- •19.Зона Брюллеэна.
- •20. Эффективная масса носителей заряда.
- •21. Циклотронный (диамагнитный) резонанс.
- •22. Классификация материалов с позиции зонной теории.
- •23. Электронная теория примесных состояний.
- •24. Плотность квантовых состояний.
- •§ 28. Концентрация электронов и дырок
- •29. Закон действующих масс
- •30. Собственном полупроводнике
- •31. Зависимость положения уровня Ферми от концентрации примеси и температуры.
- •32. Дрейфовая и диффузная электропроводности.
- •33.Подвижность
- •34.Соотношение Эйнштейна
- •34.Эффект Холла р ассмотрим ток, протекающий в бруске из некоторого материала.
- •35,37. Механизмы рассеяния носителей тока. Зависимость подвижности от температуры.
- •38.Явление переноса в сильных электрических полях.
- •39.Электростатическая ионизация (эффект Зинера)
- •Термоэлектронная ионизация (эффект Френкеля)
- •Ударная ионизация.
- •Эффект Ганна.
- •40.Оптические свойства полупроводников.
- •42. Рекомбинация носителей заряда в полупроводниках.
- •49 Фотоэлектрические явления в полупроводниках.
II. Следствие фазовой диаграммы ( очистка кристалла ).
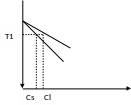
CL– концентрация примеси в расплаве,
СS - конц.примеси в закристаллизованном Si,
СS= kSCL;
kS– коэф. сегрегации (по опр. kS=CS/CL),
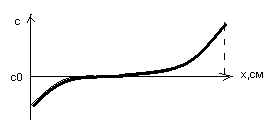
Если состав расплава равен СL, то при
охлаждении до Т=Т1 (пересечение с кривой
ликвидус) происходит кристаллизация части
расплава с сод. примеси kSCL
Из рассмотренного выше следует:
Не вся примесь, содержащаяся в расплаве, будет захватываться растущим кристаллом. Следовательно, кристалл будет более чистым по сравнению с расплавом. В этом и состоит суть очистки кристаллов при их выращивании из расплава.
По мере выращивания кристалла( вытягивания слитка из расплава ), в расплаве увеличивается концентрация примеси ( относительно массы основного материала(Si). В связи с этим:
а) на фазовой диаграмме происходит сдвиг в сторону больших концентраций и, соответственно,
кристаллизация происходит при более низкой температуре.
б) в вытягиваемом кристалле увеличивается концентрация захваченной примеси. Т.е. на заключительных этапах вытягивания кристалла его качества ухудшаются!
3) качество кристалла (однородность примесей и дефектов) сильно зависит от стабильности (однородности) температуры на границе раздела кристалл-жидкость (как вдоль границы раздела так и в перпендикулярном направлении).
Метод Степанова : направленная кристаллизация. Подобна методу Ч., но – через фильеру. => Качество хуже, но дешевле. Не подходит для изготовления СБИС, но может быть использованы для датчиков, микромашин, солнечных эл-тов и т.д.
Метод зонной плавки (безтигельный метод).
(метод зонной чистки)
Недостатки метода Чохральского:
высокая концентрация дислокаций и других дефектов
выращивание из тигля => загрязнения расплава на С, О
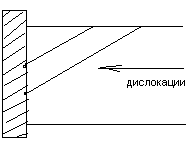
Преимущества метода зонной плавки:
- эффективное удаление примесей при многократном прохождении гидуктора
- возможность получения без дислокационного кремния
Недостатки метода зонной плавки:
- трудности контроля над температурами градиентами в зоне расплава
- сильный разброс по диаметру слитка.
1.1 Фазовые диаграммы и твердые растворы.
Фаза - однородная часть системы, отделённая от других частей поверхностью раздела, при переходе через которую скачком изменяются структура вещества или химический состав.
Диаграммы состояния – графики, которые изображают фазовые состояния веществ в зависимости от давления, объёма и температуры.
Д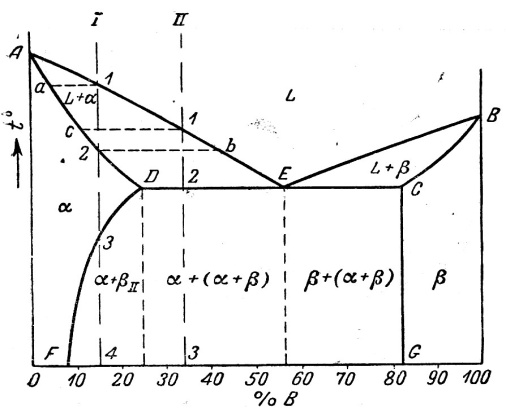 войные
фазовые диаграммы изображают состояния
системы с двумя компонентами. Обычно
представляет собой графики, изображающие
состояние системы в зависимости от
температуры и состава системы.
войные
фазовые диаграммы изображают состояния
системы с двумя компонентами. Обычно
представляет собой графики, изображающие
состояние системы в зависимости от
температуры и состава системы.
А, В – компоненты веществ А и В,
α - вещество А растворёнными атомами В,
β – вещество В с растворёнными атомами А,
L – жидкая фаза,
α+ β – смесь фаз,
Е – точка эвтетики (смесь имеющая самую низкую температуру плавления).
Анализируя фазовые диаграммы, можно предсказывать (определять) фазовый состав и количество материала в отдельных фазах для любого соотношения А и В.
Существует 3 типа фазовых диаграмм двойных систем:
1. Эвтектические диаграммы состояния.
2. Дистектические диаграммы сост. образуются в случае, когда в системе А-В образуются химические соединения (например АВ и др.).
3. Диаграмма состояния систем с неограниченной растворимостью компонент.
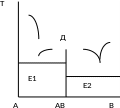
Дистектическая диаграмма состояния.
АВ – химическое соединение
Е1Е2 – точки эвтектики
D – точка дистектики
С неограниченной растворимостью
неограниченной растворимостью
Системы с неограниченной растворимостью
образуются в случаях, когда:
1.Различие в атомных радиусах не менее 15%
2.Одинаковая валентность
3.Одинаковая кристаллическая решётка
4.Одинаковая электроотрицательность
Рассмотрим участок фазовой диаграммы, по которому можно определить предельную растворимость примеси в основном материале (эвтектическая фазовая диаграмма). Рассмотрим типичную фазовую диаграмму вблизи точки плавления кремния: Кривая солидус определяет растворимость примеси в кремнии при различных То. Кривая растворимости с максимумом (сначала рост растворимости а затем убывание с ростом То) называется ретроградной кривой растворимости.
Ретроградная кривая растворимости типична для таких полупроводников, как кремний и германий .
Следствия ретроградной кривой растворимости:
Имеется предел растворимости примеси в кристаллы. Выше этой концентрации
примесь переходит в другое фазовое состояние – образует преципитаты.
Кристаллы могут иметь концентрацию примеси, превышающую их
растворимость при заданной температуре. Такая примесь будет находиться в междоузельных положениях кристаллической решётки.