
- •1. Основные этапы развития физики полупроводников.
- •Главные направления развития электроники
- •2. Классификация веществ по удельной электрической проводимости. Основные представления о свойствах полупроводников.
- •3.Химические связи
- •7.Обратная решетка
- •8.Кристаллические структуры материалов электроники.
- •9. Дефекты кристаллического строения.
- •10.Фонон
- •1.1. Выращивание кристаллов кремния.
- •II. Следствие фазовой диаграммы ( очистка кристалла ).
- •1.1 Фазовые диаграммы и твердые растворы.
- •13. Качественная модель зонной структуры твердого тела.
- •14. Уравнение Шредингера для кристалла.
- •2.2 Уравнение Шредингера для кристалла
- •15.Адиабатическое приближение (приближение Борна - Оппенгеймера).
- •Первая зона Бриллюэна полупроводника типа алмаза
- •19.Зона Брюллеэна.
- •20. Эффективная масса носителей заряда.
- •21. Циклотронный (диамагнитный) резонанс.
- •22. Классификация материалов с позиции зонной теории.
- •23. Электронная теория примесных состояний.
- •24. Плотность квантовых состояний.
- •§ 28. Концентрация электронов и дырок
- •29. Закон действующих масс
- •30. Собственном полупроводнике
- •31. Зависимость положения уровня Ферми от концентрации примеси и температуры.
- •32. Дрейфовая и диффузная электропроводности.
- •33.Подвижность
- •34.Соотношение Эйнштейна
- •34.Эффект Холла р ассмотрим ток, протекающий в бруске из некоторого материала.
- •35,37. Механизмы рассеяния носителей тока. Зависимость подвижности от температуры.
- •38.Явление переноса в сильных электрических полях.
- •39.Электростатическая ионизация (эффект Зинера)
- •Термоэлектронная ионизация (эффект Френкеля)
- •Ударная ионизация.
- •Эффект Ганна.
- •40.Оптические свойства полупроводников.
- •42. Рекомбинация носителей заряда в полупроводниках.
- •49 Фотоэлектрические явления в полупроводниках.
3.Химические связи
Основную роль в процессе объединения атомов в кристалл играют электроны. Межатомная связь возникает благодаря тому, что атомы в веществе расположены близко друг к другу.
По физической природе сил, действующих между частицами решетки, различают связи ионные, металлические, межмолекулярные (Ван дер Вальсовые) и ковалентные.
При ионной связи электроны перемещаются от одних атомов к другим. Как следствие, в структуре возникают ионы. При металлической связи кристаллическая решетка из положительно заряженных ионов окружена «электронным газом». Наконец, в случае ковалентной связи внешние, так называемые валентные, электроны становятся общими для ближайших соседних атомов.
Большинство элементарных полупроводников и полупроводниковых соединений образуют кристаллические решетки с ковалентной связью.
алентная связь образуется между одинаковыми или близкими по свойствам элементами в результате появления обменного эффекта.
Для наглядности рассмотрим образование ковалентной связи на примере молекулы водорода. При сближении атомов происходит взаимное перекрытие электронных оболочек и между атомами возникают силы электростатического взаимодействия. Перекрытие электронных оболочек сближающихся атомов приводит к обобществлению электронов для обоих ядер. Этот эффект носит название обменного взаимодействия. Силы такого взаимодействия называют обменными силами, а их энергию – обменной энергией. В зависимости от ориентации спинов обобществленных электронов обменное взаимодействие может приводить к образованию либо сил притяжения, либо сил отталкивания. Если спины параллельны, то между сближающимися атомами возникают силы отталкивания и молекула не образуется. При антипараллельных спинах возникают силы притяжения, способствующие образованию молекулы. В области перекрытия электронных оболочек возрастает плотность отрицательного заряда, способствующего сближению ядер взаимодействующих атомов, в результате чего молекула становится устойчивой. Отметим, что обобществленные электроны чаще всего находятся в области перекрытия, так как там на них действуют силы притяжения обоих ядер.
В образовании ковалентной связи участвуют только валентные электроны, а поскольку все атомы стремятся иметь устойчивую оболочку инертного газа, что соответствует минимальной энергии, то количество пар обобществленных электронов соответствует валентности элемента. Ковалентную связь называют еще гомеополярной или валентной
.
Надо добавить модельные представления о связи
(всю главу об электропроводности быть может есть смысл обозвать отдельно) типа
4-5.Кристаллические решётки. Операции симметрии.
Кристаллическая решётка – это пространственная сетка, в узлах которой расположены частицы (атомы, молекулы) вещества.
Элементарная ячейка – наименьший многогранник, который можно выделить в кристаллической решётке и при перемещении которого по трём взаимно перпендикулярным направлениям можно получать эту решётку.
Кристаллическая решётка может быть охарактеризована (описана) набором величин:
a, b, c – длины рёбер элементарной ячейки;
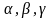 - углы между рёбрами.
- углы между рёбрами.
Это
постоянные (параметры) решётки. Любую
точку кристаллической решётки (узел)
можно вычислить путём операции трансляции
(переноса). Три вектора
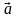 ,
,
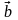 ,
,
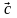 ,
определяющие ту или иную решётку,
называют примитивными векторами
трансляции. Любую точку кристаллической
решётки (узел) можно определить вектором
,
определяющие ту или иную решётку,
называют примитивными векторами
трансляции. Любую точку кристаллической
решётки (узел) можно определить вектором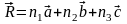 (
(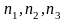 - целые числа). Кристаллическое строение
приводит к симметрии внешних форм
кристалла, а следовательно – симметрии
внутренних свойств материала.
- целые числа). Кристаллическое строение
приводит к симметрии внешних форм
кристалла, а следовательно – симметрии
внутренних свойств материала.
Симметрия может быть описана следующими операциями:
Центр симметрии (центр инверсии): точка, пересечение линий, соединяющих части фигуры, противоположные, равные и параллельные, но противоположно направленные!
Ось симметрии n-ого порядка – ось, при повороте вокруг которой на угол 360/n кристалл полностью совместиться.
Плоскость симметрии – делит кристалл на 2 части, являющимися зеркальным отражением.
Сингония – совокупность элементов симметрии одной категории с одинаковым числом осей одного порядка.
Все кристаллы, существующие в природе, можно отнести только к 7 сингония и 14 решёткам Браве.
Таблица. Семь сингоний и четырнадцать решеток Браве в кристаллографии
Сингония |
Длина осей и углы |
Решетка Браве |
Кубическая |
a = b = c, = = = 90O |
Простая Объемно-центрированная Гране-центрированная |
Тетрагональная |
a = b c, = = = 90О |
Простая Объемно-центрированная |
Орторомбическая |
a b c, = = = 90О |
Простая Объемно-центрированная Гране-центрированная Базо-центрированная |
Ромбоэдрическая (тригональная) |
a = b = c, = = 90О |
Простая |
Гексагональная |
a = b c, = = 90О, = 120О |
Простая |
Моноклинная |
a b c, = = 90О |
Простая Базо-центрированная |
Триклинная |
a b c, 90О |
Простая |
Наиболее высокая симметрия – КУБИЧЕСКАЯ. Чем выше симметрия – тем более изотропен материал.
Полиморфизм: явление, когда вещество одного и того же химического состава существует в различных кристаллических модификациях (аллотропных состояниях).
Примеры: 1) Углерод (графит, алмаз, фуллерен и т. д.);
2) Олово (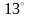 C
и ниже – куб.
C
и ниже – куб.
 ,серое).
,серое).
6.Положение и ориентация плоскостей в кристалле.
Кристаллы – анизотропны (т. е. свойства зависят от направления).
От ориентации кристалла зависят: скорости травления, диффузии, окисления, а следовательно характеристики полупроводниковых приборов.
Для обозначения плоскостей и ориентаций в кристалле используются специальные обозначения – индексы Миллера (h, k, l).
Индексы Миллера – обратно пропорциональны длинам отрезков, отсекаемых плоскостью на осях координат.
На практике их определяют следующим образом:
- Находят точку пересечения плоскости с координатными осями;
- Измеряют длину отсечённых отрезков, используя в качестве единицы длины – постоянную решётки;
- Находят обратные величины и округляют результат до ближайших целых чисел.
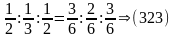
 - Индексы Миллера
- Индексы Миллера
Направление перпендикулярное плоскости: [323].
Обозначения:
- плоскости: (111)
-
совокупность плоскостей: (111), (1 1)
… {111}
1)
… {111}
- направление: [111]
- совокупность направлений: <111>
- знак минус - ставится над цифрой.
Для обобщённого обозначения индексов Миллера используют буквы hkl: (hkl), [hkl], etc.
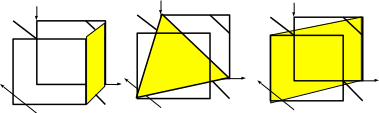
(010) (111) (110)
