
- •Класифікація
- •Номенклатура
- •Добування
- •Фізичні властивості
- •Хімічні властивості
- •Застосування
- •Загальна характеристика неметалічних елементів. Положення їх у періодичній системі, будова атомів і молекул, поширення у природі.
- •Органічна хімія
- •Амінокислоти: будова, номенклатура, ізомерія. Утворення біполярного йона. Властивості амінокислот. Пептидний зв’язок. Добування і застосування амінокислот.
- •Білки: склад, будова, структура білків, їх класифікація.
- •Склад, будова
- •Структура
- •Класифікація
Загальна характеристика неметалічних елементів. Положення їх у періодичній системі, будова атомів і молекул, поширення у природі.
Немета́ли — прості речовини, які не мають властивостей металів, а саме: металічного блиску, непридатні для кування, погано проводять тепло, електричний струм.
Неметали у вигляді простих тіл знаходяться в твердому або газоподібному стані (виключаючи бром - рідину). Вони не мають фізичних властивостей, властивих металам. Тверді неметали не мають характерного для металів блиску, вони зазвичай крихкі, погано проводять електричний струм і тепло (за винятком графіту).
За електронною будовою зовнішнього енергетичного рівня атомів більшість неметалічних елементів є р-елементи, а Гідроген і Гелій — s-елементами. На зовнішньому енергетичному рівні мають від 3 до 8 електронів, крім гідрогену та гелію (1 та 2 електрони відповідно). У хімічних реакціях атоми неметалів, як правило, приєднують електрони і перетворюються на негативно заряджені йони — аніони. Неметалічний характер елементів і хімічна активність неметалів посилюються в періодах зліва направо, а в головних підгрупах — знизу догори.
До неметалів зараховують 22 хімічних елементи: водень (гідроґен), азот, арсен, силіцій, кисень (оксиґен), флуор, хлор, інертні гази, бром, карбон, фосфор, сульфур, селен, йод, астат, телур, бор. Типові оксиди неметалів є ангідридами. Різкої межі між металами, металоїдами та неметалами немає.
Частина неметалів має атомну будову. Із окремих атомів складаються інертні гази — гелій, неон, аргон, криптон, ксенон і радон. У графіті, алмазі, силіції, борі, червоному фосфорі всі атоми сполучені один з одним. Водень, азот, кисень, фтор, хлор, бром, йод мають двохатомні молекули. Більшу кількість атомів містять молекули озону О3, білого фосфору Р4, сірки S8, фулерену С60. Атоми в неметалах сполучені ковалентними неполярними зв'язками.
У молекулярній формі у вигляді простих речовин у природі зустрічаються азот, кисень і сірка. Найчастіше неметали знаходяться в хімічно зв'язаному вигляді: це вода, мінерали, гірські породи, різні силікати, фосфати, борати. За поширеністю в земній корі неметали істотно розрізняються. Найбільш поширеними є кисень, кремній, водень; найбільш рідкісними - миш'як, селен, йод.
Органічна хімія
№30
Амінокислоти: будова, номенклатура, ізомерія. Утворення біполярного йона. Властивості амінокислот. Пептидний зв’язок. Добування і застосування амінокислот.
Амінокислота — органічна сполука, молекули якої одночасно містять аміно- (-NH2) та карбоксильну (-СООН) групи. Амінокислоти є мономерними одиницями білків, у складі яких залишки амінокислот з'єднані пептидними зв'язками.
Будова
Усі амінокислоти містять карбоксильну й аміногрупи. В α-амінокислот вони приєднані до одного і того ж атома карбону. Решту молекули називають бічним ланцюгом або R-групою. Ці групи відрізняються за розміром, формою, гідрофільністю, електричним зарядом, схильністю формувати водневі зв'язки і загальною реакційною здатністю надаючи кожній амінокислоті унікальних властивостей. У найменшої амінокислоти — гліцину — бічного ланцюга немає, біля α-атома карбону крім каброксильної і аміногрупи розташовані два атоми водню.
Номенклатура
За систематичною номенклатурою назви амінокислот утворюються з назв відповідних кислот додатком приставки аміно-і зазначенням місця розташування аміногрупи по відношенню до карбоксильної групі. Нумерація вуглецевого ланцюга з атома вуглецю карбоксильної групи.
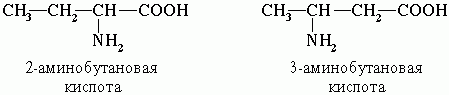
Ізомерія
1. Ізомерія вуглецевого скелета
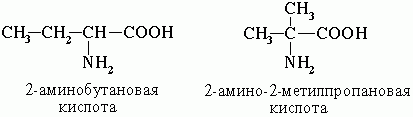
2. Ізомерія положення функціональних груп

3. Оптична ізомерія
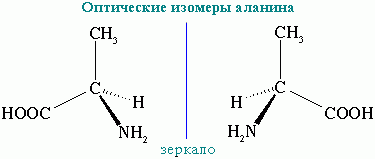
α-амінокислоти, крім гліцину NН2-CH2-COOH
ФІЗИЧНІ ВЛАСТИВОСТІ
Амінокислоти являють собою кристалічні речовини з високими (вище 250 ° С) температурами плавлення, які мало відрізняються у індивідуальних амінокислот і тому не характерні. Плавлення супроводжується розкладанням речовини. Амінокислоти добре розчиняються у воді і нерозчинні в органічних розчинниках, чим вони схожі на неорганічні сполуки. Багато амінокислоти володіють солодким смаком.
Хімічні властивості
Оскільки до складу амінокислот входять дві функціональні групи, то амінокислоти проявляють властивості двох класів сполук: карбонових кислот та органічних амінів.
1. Кислотно-основні взаємодії. У нейтральних водних розчинах амінокислот карбоксильна група відщеплює іон Гідрогену, що може приєднатися до аміногрупи. При цьому утворюється так звана внутрішня сіль, яка існує у вигляді біполярних йонів (цвітеріонів). Вони поводяться як амфотерні сполуки, тобто проявляють властивості і кислот, і основ:
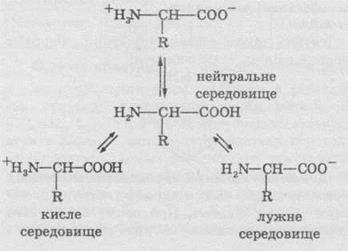
Амінокарбонові кислоти, як уже згадувалося раніше, мають амфотерні властивості через наявність основних аміногруп та кислотних карбоксильних груп, це позначається й на їхніх хімічних властивостях. При взаємодії з кислотами й лугами утворюють солі:

2. Утворення пептидного зв'язку. Карбоксильна група є донором протона в проявляє, відповідно, кислотні властивості. Властивості аміногрупи аналогічні до властивостей амоніаку, зокрема, вона є акцептором протонів і проявляє, відповідно, основні властивості. Отже, амінокислоти — це амфотерні сполуки, й їхня особливість полягає в тому, що кислотні й основні властивості проявляють різні групи атомів у молекулі, причому просторово розділені.
Саме цим обумовлена властивість молекул амінокислот реагувати одна з одною:
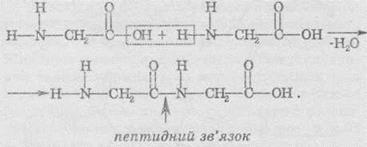
Пептидний зв’язок утворюється в результаті відщеплення молекули води при взаємодії аміногрупи однієї амінокислоти з карбоксильною групою іншої. Утворений ковалентний нітроген-карбоновий зв’язок називають пептидним зв’язком. Сполука, яка утворюється в результаті конденсації двох амінокислот, називається дипептид. На одному кінці його молекули перебуває вільна аміногрупа, а на іншому — карбоксильна група. Завдяки цьому дипептид може також приєднувати до себе наступні молекули амінокислот.
3. Взаємодія з нітратною кислотою (дезамінування). Подібно до первинних амінів, амінокислоти реагують із нітритною кислотою, при цьому аміногрупа перетворюється в гідроксогрупу, а амінокислота — у гідроксикислоту:
![]()
Вимірювання об’єму виділеного азоту дозволяє визначити кількість амінокислоти (метод Ван-Слайка).
4. Взаємодія зі спиртами (естерифікація). Амінокислоти можуть реагувати зі спиртами в присутності хлороводню, перетворюючись у естер (точніше, у хлороводневу сіль естеру):
![]()
Естери амінокислот не мають біполярної структури і є леткими сполуками.
5. Якісні реакції.
1) Усі амінокислоти окиснюються нінгідрином
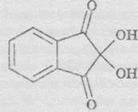
з утворенням продуктів, забарвлених у синьо-фіолетовий колір. Амінокислота пролін утворює з ніпгідрином жовтий колір. Ця реакція може бути використана для кількісного визначення амінокислот спектрофотометричним методом:

2) При нагріванні ароматичних амінокислот із сумішшю концентрованої сульфатної та нітратної кислот відбувається нітрування бензенового кільця й утворюються сполуки, забарвлені в жовтий колір. Цю реакцію називають ксантопротеїновою (від грец, ксантос — жовтий).
Добування
1. З карбонових кислот за схемою:
1 стадія:
2 1
R-CH2-COOH + Cl2 t, hν → R-CH-COOH + HCl (р. заміщення)
│
Cl
2-хлоркарбонова кислота
2 стадія:
α
R-CH-COOH + 2NH3 → R-CH-COOH + NH4Cl
│ │
Cl NH2
α -амінокарбонова кислота
2. Гідроліз поліпептидів (білків):
CH2-CO-NH-CH-COOH + H2O ↔ CH2-COOH + CH3-CH-COOH
│ │ │ │
NH2 CH3 NH2 NH2
гліцил-аланін (дипептид) гліцин аланін
3. Мікробіологічний синтез. Відомі мікроорганізми, які в процесі життєдіяльності продукують α - амінокислоти білків.
ЗАСТОСУВАННЯ 1) амінокислоти широко поширені в природі; 2) молекули амінокислот - це ті цеглинки, з яких побудовані всі рослинні і тваринні білки; амінокислоти, необхідні для побудови білків організму, людина і тварини отримують у складі білків їжі; 3) амінокислоти прописуються при сильному виснаженні, після важких операцій; 4) їх використовують для харчування хворих; 5) амінокислоти необхідні як лікувальний засіб при деяких хворобах (наприклад, глутамінова кислота використовується при нервових захворюваннях, гістидин - при виразці шлунку); 6) деякі амінокислоти застосовуються в сільському господарстві для підгодівлі тварин, що позитивно впливає на їх ріст; 7) мають технічне значення: амінокапронова і аміноенантовая кислоти утворюють синтетичні волокна - капрон і енант.
№31
