
- •15. Тиоцианатометрия и меркуриметрия. Сущность методов, титранты, их приготовление, стандартизация, индикаторы, применение методов в фарманализе.
- •6. Сульфатометрия, гексацианоферратометрия. Сущность методов, титранты, их приготовление, стандартизация, индикаторы, применение методов в фарманализе.
- •4. Сильные и слабые электролиты, определение, примеры. Степень диссоциации, формула расчета. Общая концентрация и активности ионов в растворе. Ионная сила раствора.
- •5. Влияние ионной силы на коэффициент активности ионов. Закон Льюиса – Рендалла. Уравнение первого и второго приближения Дебая – Хюккеля.
- •6. Химическое равновесие. Константа химического равновесия (истинная, термодинамическая, концентрационная). Условная константа химического равновесия.
- •16. Уравнение Гендерсона, выводы из него. Основные характеристики буферных растворов. Буферная емкость. Использование буферных систем в анализе.
- •22. Хроматография. Сущность метода. Виды хроматографии. Теоретические основы хроматографических методов анализа. Адсорбционная и распределительная хроматография.
- •Ch3coo- - III гр анионов, гр реагент отсутствует.
- •Аналитические реакции сульфат-иона so42- so42- - анион I аналит.Гр., водный раствор ВаС12.
- •V аналитической группы
V аналитической группы
Групповым реагентом на катионы V аналитической группы являются щелочи или гидроксид аммония, получаются гидроксиды металлов, нерастворимые в избытке реагента.
1. Реакция с щелочами и аммиаком: Mg2+ + 2 ОН- --> Mg(OH)2 (белый аморфный)
Mg2+ + 2 NH4 OH= Mg(OH)2 + 2 NH4+
Осадок не растворяется в щелочах, растворяется в НСl, H2SO4, CH3COOH: Mg(OH)2 + 2 Н+ -> Mg2+ + 2 Н2О
2. Реакция с гидрофосфатом натрия Na2HPO4 (фармакопейная).
Реакцию проводят в аммиачном буфере:
Mg2+ + HPO42- + NH4OH = MgNH4PO4↓ + H2O. (белый кристаллический) При проведении реакции в отсутствии катионов аммония и аммиака выпадает белый аморфный осадок MgHPO4. Избыток NH4 мешает выпадению NH4MgPO4. Осадок NH4MgPO4 растворяется в минеральных кислотах и в уксусной кислоте:
NH4MgPO4 + 3 НС1 - Н3РО4 + MgCl2 + NH4C1
NH4MgPO4+ 2 CHjCOOH = NH4H2PO4 + (CH3COO)2Mg
Проведению реакции мешают катионы Li+, Ca2+, Sr2, Ba2+ и др.
3. Реакция с магнезоном I - п - нитробензолазорезорцином.
В щелочной среде магнезон I, имеющий красную окраску, образует с катионами Мg2+,комплекс синего цвета, сорбирующийся на осадке Mg(OH)2:
При малых концентрациях Mg2+ осадок не выделяется, а раствор окрашивается в синий цвет. Проведению реакции мешают Cd2+, Sn2+, Cr3+, Fe2+, Co2+, Ni2+.
4.Реакция с 8- оксихинолином.
Реакцию проводят в аммиачной среде при рН = 8--13 (при нагревании).
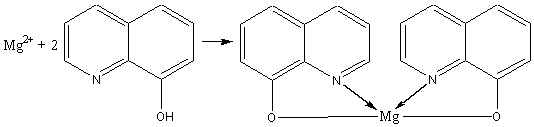
Осадок растворим в минеральных кислотах и в уксусной кислоте. Проведению реакции мешают катионы, также образующие комплексы с 8 -оксихинолином (Cu2+, Zn2+. Cd2+, Fe3+ и др.).
5. Реакция с хинализарином.
Реакцию проводят в щелочной среде. Образуется синий осадок комплексного соединения - хинализарината магния состава MgL(OH), где НL - условное обозначение молекулы хинализарина:
При небольшом содержании катионов Mg2+в растворе осадок не выпадает, а раствор окрашивается в цвет. Проведению реакций мешают катионы алюминия.
6. Реакция с растворимыми карбонатами (Nа2С03).
2 Mg2++ 2 Nа2С03 + Н2О = (МgОН)2С0з (белый аморфный) +4 Nа + СО2. Осадок (МgОН)2С0з,растворим в кислотах и в солях аммония.
7. Реакция с оксалатом аммония (NH4)С2О4.
Mg2++ (NH4)С2О4 = Mg С2О4 (белый) + 2 NH4
8. Катионы Mg2+ с дифенилкарбазидом (С6Н5 NHNH)2С0 образуют комплекс красно-- фиолетового цвета.
Аналитические реакции сульфат-иона SO42-
Анион первой аналитической группы,групповой реагент - хлорид бария ВаСl2 в нейтральном или слабощелочном растворе
1.Реакция с катионами бария (фармакопейная).
Ва2+ + SO42- --> BaSO4 (белый мелкокристаллический)
BaSO4 не растворяется в минеральных кислотах, за исключением концентрированной H2SO4, в которой он частично растворим с образованием Ba(HSO4)2:
BaSO4 + H2SO4->Ba(HSO4)2
2.Реакция с катионами свинца.
РЬ2т + SO42- -> PbSO4. (белый кристаллический)
Осадок PbSO4 частично растворяется в минеральных кислотах; растворяется в щелочах и в водных растворах ацетатов натрия CH3COONa или аммония CH3COONH4 с образованием комплексных соединений:
PbSO4 + 4 NaOH -- Na2[Pb(OH)4] + Na2SO4
3. Реакция с родизонатом бария.
На листок фильтровальной бумаги наносят каплю раствора ВаС12 и 1 каплю раствора родизоната натрия Na2C6Oe или родизоновый кислоты Н2Сб06. На бумаге возникает красное пятно родизоната бария. На это пятно наносят 1-2 капли раствора, содержащего сульфат - ионы (Na2SO4, K2~SO4 или H2SO4 разбавленной). Пятно обесцвечивается.
28. Приведите уравнения реакций идентификации ацетата ртути (I). Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Hg22+
Вторая группа катионов.
1.Групповой реагент – соляная кислота.
Hg22+ + 2Cl- = Hg2Cl2↓.
Хлорид ртути взаимодействует с гидроксидом аммония, образуя хлорид меркураммония [Hg(NH2)]Cl, и металлическую ртуть, вследствие чего осадок чернеет:
Hg2Cl2 + 2NH4OH = [Hg(NH2)]Cl↓ + Hg↓ + NH4Cl + 2H2O.
2. Катион ртути способен восстанавливаться в присутствии восстановителей (Sn2+, Cu) до металлической ртути:
Hg22+ + Sn2+ = 2Hg↓ + Sn4+;
Hg22+ + Cu = 2Hg↓ + Cu2+.
Образуется осадок черного цвета.
3. Реакция с солями йодистоводородной кислоты:
Hg22+ + 2I- = Hg2I2↓.
Образуется грязно-зеленый осадок йодида ртути (I), растворимый в избытке реагента с образованием тетраиодо(II)меркурата калия и черного осадка металлической ртути:
Hg2I2 + 2KI = K2[HgI4] + Hg↓.
4. Реакция со щелочами:
Hg22+ + 2OH- = Hg2O↓ + H2O.
В результате реакции образуется неустойчивый гидроксид ртути (I), разлагающийся на оксид ртути (I) черного цвета и воду.
5. Реакция с хроматом калия:
Hg22+ + CrO42- = Hg2CrO4v.
Образуется кирпично-красный осадок хромата ртути, растворимый в азотной кислоте.
ацетат - ион CH3COO'
Общего группового реагента нет. Анионы III группы
1.Реакция с хлоридом железа (III) (фармакопейная).
При рН = 5-8 ацетат - ион с катионами Fe(III) образует растворимый темно - красный (цвета крепкого .чая) ацетат или оксиацетат железа (III).
В водном растворе он частично гидролизуется; подкисление раствора минеральными кислотами подавляет гидролиз и приводит к исчезновению красной окраски раствора.
3 СНзСООН + Fe -->* (CH3COO)3Fe + 3 Н+
При кипячении из раствора выпадает красно-бурый осадок основного ацетата железа (III):
(CH3COO)3Fe + 2 Н2О <- Fe(OH)2 CH3COO + 2 СН3СООН
2.Реакция с серной кислотой.
Ацетат - ион в сильно кислой среде переходит в слабую уксусную кислоту, пары которой имеют характерный запах уксуса:
CH3COO- + H+ =CH3COOH.
3.Реакция образования уксусноэтилового эфира (фармакопейная).
CH3COO- + H+ =CH3COOH,
CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
В кислой среде выделяется уксусная кислота, которая со спиртами образует летучие эфиры, обладающие характерным запахом.
29. Приведите уравнения реакций идентификации сульфида стронция. Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Sr2+-Третья группа катионов. Групповой реагент - разбавленная серная кислота и ее соли, образующие с катионами данной группы малорастворимые сульфаты, нерастворимые в воде, кислотах и щелочах:
1. Sr2+ + SO42- = SrSO4↓.
2. Окрашивание пламениЛетучие соли стронция окрашивают пламя горелки в карминово-красный цвет.
3. Карбонат аммония (NH4)2CO3 При взаимодействии с растворами солей стронция осаждает карбонат стронция белого цвета, растворимый в уксусной, соляной и азотной кислотах:
SrCl2 + (NH4)2CO3 = SrCO3+ 2NH4Cl
4. Насыщенный раствор гипса CaSO4 . 2H2O (гипсовая вода) образует с ионами Sr2+ белый осадок сульфата стронция:
Sr2+ + SO42- = SrSO4
Сульфид-ион:вторая аналитическая группа. Групповой реагент - Нитрат серебра AgNO3 и присутствии HNO3
1. 2Ag+ + S2- = Ag2S↓ Черный
2. Реакция с кислотами
Na2S + H2SO4 = H2S + Na2SO4.
Выделение сероводорода легко обнаружить по запаху или по почернению бумажки, смоченной раствором ацетата свинца:
Pb(CH3COOH)2 + H2S = PbS + 2CH3COOH.
3. Реакция с солями кадмия
Na2S + Cd(NO3)2 = CdS + 2NaNO3.
При добавлении к раствору, содержащему сульфид-ион, солей кадмия образуется желтый осадок сульфида кадмия.
4. Реакция с нитрозопентациано(II)ферратом натрия (нитропруссидом натрия)
Na2[Fe(CN)5NO] + Na2S = Na4[Fe(CN)5NOS].
Раствор окрашивается в красно-фиолетовый цвет вследствие образования комплекса
5. Реакция с нитратом серебра:
S2- + 2Ag+ = Ag2S↓.
Нитрат серебра образует с сульфид-ионом черный осадок сульфида серебра, нерастворимый в NH4OH, Na2S2O3 и KCN, но растворимый при нагревании в 2 М HNO3. Мешающих обнаружению анионов нет.
6. Реакция с гидроксокомплексом свинца Pb(OH)42-:
Pb2+ + 2OH- = Pb(OH)2↓,
Pb(OH)2 + 2OH- = Pb(OH)42-,
S2- + Pb(OH)42- = PbS + 4OH-.
Гидроксокомплекс свинца образует с сульфид-ионом черный осадок PbS, растворимый при нагревании в 2 М HNO3:
3PbS + 8HNO3 = 3Pb(NO3)2 + 3S + 2NO + 4H2O.
30. Приведите уравнения реакций идентификации калия фосфата. Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Катион калия
I Аналитическая группа характеризуется отсутствием группового реагента
1 . Реакция с гидротартратом натрия или (винной кислотой) в присутствии ацетата натрия (рН=7)
K+ + HC4H4O6- = KHC4H4O6↓.бел. крист.
2. Реакция с гексанитрокобальтатом (III) натрия (рНлюбая кроме сильных кислот и сильных щелочей, т.к. реагент разлагается)
2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6]↓ + 2Na+. желт, крист.,
Реакция с гексанитрокупратом (II) натрия и свинца.
2К+ + Na2Pb[Cu(NO2)6] = K2Pb[Cu(NO,)6] | черн. кубические крист. + 2Na+
4. Окрашивание пламени газовой горелки - в фиолетовый цвет.
Фосфат-ион
анион I аналитической группы-глорид бария BaCl2 или нитрат бария Ba(NO3)2. При взаимодействии анионов первой группы с катионом бария в растворе образуются осадки соответствующих бариевых солей:
1.Реакция с ВаС12.
2 РО43- + 3 Ва2+ -= Ва3(РО4)2 (белый)
НРО42- + Ва2+ -+ ВаНРО4 (белый)
В аммиачной среде реакция гидрофосфат- ионов с катионами бария приводит к образованию осадка среднего ортофосфата бария Ва3(РО4)2:
2 НРО42- + 3 Ва2+ + 2 NH3 -> Ва3(РО4)2 + 2 NH4+
Свежеосажденный осадок Ва3(РО4)2 растворяется в FfNO3, HC1, СН3СООН.
2.Реакция с нитратом серебра (фармакопейная).
Реакцию проводят в нейтральной среде:
РО43- + 3 Ag+ -> Ag3PO4 (желтый)
Осадок растворяется в азотной кислоте, в концентрированном аммиаке.
3.Реакция с магнезиальной смесью (фармакопейная)
Гидрофосфат - ион НРО42~ при взаимодействии с магнезиальной смесью (MgCI2 + NH4CI + NH3) образует белый мелкокристаллический осадок магнийаммонийфосфата NH4MgPO4:
HPO42- + NH4OH + Mg2+ = MgHPO4↓ + H2O.
4. Реакция с молибдатом аммония (фармакопейная). Реакцию проводят в азотнокислой среде при нагревании:
PO43- + NH4+ + 12MoO42- + 24H+ = (NH4)3P(Mo3O10)4↓ + 12H2O.
Выпадает желтый осадок фосфоромолибдата аммония.
Эта формула к первому разделу к 10 вопросу к нитритомерии.
Нитритометрическое определение стрептоцида основано на реакции диазотирования:
NH2 N ≡N+
![]() +
NaNO2
+ НС1
↔
+
NaNO2
+ НС1
↔
![]()
![]() Сl
-
+ NaC1+ 2Н2О
Сl
-
+ NaC1+ 2Н2О
SO3H SO3H
