
- •15. Тиоцианатометрия и меркуриметрия. Сущность методов, титранты, их приготовление, стандартизация, индикаторы, применение методов в фарманализе.
- •6. Сульфатометрия, гексацианоферратометрия. Сущность методов, титранты, их приготовление, стандартизация, индикаторы, применение методов в фарманализе.
- •4. Сильные и слабые электролиты, определение, примеры. Степень диссоциации, формула расчета. Общая концентрация и активности ионов в растворе. Ионная сила раствора.
- •5. Влияние ионной силы на коэффициент активности ионов. Закон Льюиса – Рендалла. Уравнение первого и второго приближения Дебая – Хюккеля.
- •6. Химическое равновесие. Константа химического равновесия (истинная, термодинамическая, концентрационная). Условная константа химического равновесия.
- •16. Уравнение Гендерсона, выводы из него. Основные характеристики буферных растворов. Буферная емкость. Использование буферных систем в анализе.
- •22. Хроматография. Сущность метода. Виды хроматографии. Теоретические основы хроматографических методов анализа. Адсорбционная и распределительная хроматография.
- •Ch3coo- - III гр анионов, гр реагент отсутствует.
- •Аналитические реакции сульфат-иона so42- so42- - анион I аналит.Гр., водный раствор ВаС12.
- •V аналитической группы
16. Уравнение Гендерсона, выводы из него. Основные характеристики буферных растворов. Буферная емкость. Использование буферных систем в анализе.
Уравнение
показывает как зависит
кислотно-основное
равновесие
буферного
раствора
от свойств
компонентов кислотно-основной
буферной системы
и от количественного соотношения этих
компонентов в растворе.
Показателем
кислотно-основного равновесия в растворе
является водородный
показатель,
pH.
Свойство кислоты
(её способность распадаться на ионы),
как составляющей буферной системы,
характеризуется значением
константы
равновесия,
константы диссоциации
кислоты, Ka.
(или в логарифмической форме
pKa = – lgK,
в частности, если K = 10–11,
то pK = 11).
Количественая структура
(состав) буферной системы может быть
оценена
в виде отношения
соль/кислота (эквиваленты, эквивалентная
масса).
Учитывая сказанное, уравнение
Гендерсона-Гассельбаха выглядит
следующим образом:pH = pKa + lg (соль/кислота).
С
помощью этого уравнения можно оценить
любую из его переменных,
если известны две другиеБуферные
растворы-это
растворы, способные сохранять
приблизительно постоянное значения
рН при добавлении к ним небольших
количеств сильных к-т или сильных
оснований. Содержат либо одно индивид.в-во,
либо смесь в-в.Примеры-к р-ам индив.в-в
относятся насыщенный водный раствор
гидротартрата калия KHC4H4O6,
водный раствор тетрабората натрия(буры)
Na2B4O7*10H2O,
пример буферных систем из смеси в-в
могут служить водные растворы, содержащие
хлороводородную к-ту и глицин, ацетатный
буфер – водный р-р уксусной к-ты и
ацетата натрия, универсальная буферная
смесь(смесь ортофосфорной, уксусной и
борной к-т с р-ом гидроксида
натрия)..Определение
буферной емкости
(β)по ГФ-БЕ называют выраженное в
грамм-эквивалентах количество сильного
основания(В), прибавления которого к 1
л.буферного раствора вызывает возрастание
величины рН этого раствора на единиц.
β=![]() .
Дистил.вода, применяемая для определения
буферных растворов, должна иметь
значения рН=5,8-7,0.Вкачественном и
количественном анализе буферные системы
испол-ют тогда, когда необходимо
поддерживать постоянное значения рН
среды.Н-р, при комплексонометрич.определении
катионов некоторых металлов(Mg,
Ca,
Pb
и др) применяют аммиачно-буферную смесь,
ацетатный буфер используют при отделении
ионов бария отионов кальция и стронция
с помощью дхромат ионов.
.
Дистил.вода, применяемая для определения
буферных растворов, должна иметь
значения рН=5,8-7,0.Вкачественном и
количественном анализе буферные системы
испол-ют тогда, когда необходимо
поддерживать постоянное значения рН
среды.Н-р, при комплексонометрич.определении
катионов некоторых металлов(Mg,
Ca,
Pb
и др) применяют аммиачно-буферную смесь,
ацетатный буфер используют при отделении
ионов бария отионов кальция и стронция
с помощью дхромат ионов.
17. Окислительно – восстановительные системы. Окислительно – восстановительные потенциалы редокс – пар (стандартный окислительно – восстановительный потенциал, реальный условный потенциал, формальный окислительно – восстановительный потенциал). Типы электродов (электроды сравнения, индикаторные электроды, их строение, функции). Уравнение Нернста.
Окислительно-восстановительные системы. ОВР используются как в качественном, так и в количественном анализе.В любой ОВР участвуют две редокс пары. Редокс пара-это система из окислительно, восстановительных форм данного вещества, в котором окисленная форма является акцептором электронов и восстанавливается, принимая электроны, а восстановленная форма –донор электронов и окисляется отдавая электроны.Существуют вещества, которые в одних реакциях окислители, в др.-восстановители(зависит от природы партера реагента и условий протекания ОВР)-н-р,Н2О2, нитрит-ионNO2-2 и др.Окислительно-восстан.потенциалы редокс пар-мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Биологически важной системой является система:Fe3+/Fe2+.Примером окислительно-восстановительного электрода:Pt/Fe3+,Fe2+Стандартный ОВП – когда все участники ОВР нах-ся в стандартных состояниях, их активности =1.Реальный условный потенциал –это потенциал редокс пары при условии, что участники р-и находятся в реальных условиях, а не в стандартных состояниях.Формальный ОВП системы-это условный потенциал редокс пары при формальных конц. реагентов.(т.е.при конц.=1 моль/л).Типы электродов. Электроды сравнения - электрохимические системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения абс. величины потенциала отдельного электрода.В качестве электрода сравнения может служить любой электрод в термодинамически равновесном состоянии, удовлетворяющий требованиям воспроизводимости, постоянства во времени всех характеристик и относительной простоты изготовления. Для водных электролитов наиболее часто применяют в качестве электродов сравнения водородный, каломельный, галогеносеребряные, оксидно-ртутный и хингидронный электроды. Уравнение Нернста - уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.
![]() ,где
,где
![]() -
электродный потенциал, E0
- стандартный электродный потенциал,
измеряется в вольтах;
-
электродный потенциал, E0
- стандартный электродный потенциал,
измеряется в вольтах;![]() —
универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);
—
универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);![]() —
абсолютная температура;
—
абсолютная температура;![]() —
число
Фарадея,
равное 96485,35 Кл/моль;
—
число
Фарадея,
равное 96485,35 Кл/моль;![]() —
число моль
электронов,
участвующих в процессе;
—
число моль
электронов,
участвующих в процессе;![]() и
и
![]() —
активности
соответственно окисленной
и восстановленной
форм вещества, участвующего в полуреакции.
—
активности
соответственно окисленной
и восстановленной
форм вещества, участвующего в полуреакции.
18. Потенциал реакции (ЭДС реакции). Направление протекания окислительно – восстановительной реакции. Связь ЭДС с энергией Гиббса Влияние различных факторов на значения о. – в. потенциалов и направления протекания реакций. Использование окислительно – восстановительных реакций в анализе.
Потенциал
реакции(Е)-величина
равная разности ОВ потенциалов
редокс-пар(т.е.их электродных
потенциала)Н-р, в реакции
Се+4+Fe+2=Ce+3+Fe+3(число
электроноы здесь=1), уравнение для
потенциала(ЭДС) р-ии - Е=Е0
-
-![]() ln
ln ,
где Е0
-
стандартный
потенциал реакции.В числители под
знаком логарифма записано произведение
активности продуктов реакции, а в
знаминателе –произведение активности
исходных в-в.В общем случае для ОВР ее
потенциал(ЭДС) – Е=Е1-Е2,
где Е1иЕ2-окислительно-восстанов.потенциалы
двух редокс-пар.Направления
протекания ОВР.
Учет знака потенциала ОВР позволяет
определить направление протекания
р-ии.Если потенциал Е больше нуля(Е=Е1-Е2>0),
то р-ия протекает в прямом направлении
в соответствии с записью уравнения
р-ии.Если <0, р-ия протекает в обратном
направлении, если он равен 0, то система
находится в состоянии устойчивого хим.
Равновесия. Связь
ЭДС с энергией Гиббса. Потенциал
реакции(ееЭДС) Е связан с изменением
энергии Гиббса ∆Gпри
протекания данной реакции соотношением:
∆G=-nFE,
изменении энергии Гиббса при любой
химической р-ии меньше нуля,тор-ия
протекает в прямом наравлении в
соответствии с записью в уравнении.Если
∆G>0,
р-ия идет в обратном направлении, ∆G=0
–устойчивое хим.равновесие.Всегда n>0
и F>0,
можно сделать вывод:при ∆G<0,
потенциал р-ии Е>0, ∆G>0,
потенциал р-ии Е<0, ∆G=0
– Е=0.Влияние
факторов на значение ОВ потенциалов.Зависят
от природы р-ии(природа реагента,
растворителя), конц.реагентов, рН среды,
темпер., присутствие др.в-в в
растворе.Использование.
ОВР
широко испол.как в качественном, так и
в колич.анализе.в качественном
анализе-(н-р, катионы одновалентной
ртути, открывают действуя на него
хлоридные комплексы олова в соляной
к-те-выпадает белый осадок каломелиHg2Cl2.,
анионы, облад-ие выраж. восстановительными
св-ми окисляются йодом(н-р, анионы S-2,
SO3-2,
S2O3-2.)
или раствором перманганата калия в
серно кислой среде. В количественном
агравиметрическом анализе используется
ОВР (для определения железа(11) его
предварительно окисляют до железа
(111) прибавляя конц. азотную к-ту., после
чего осаждают р-ом аммиака, затем
прокаливают до оксида Fe2O3
и взвешивают), при анализе ЛРС измельченный
образец озоляют(путем окислительного
нагревания и прокаливания) в фарфоровом
тигле превращают в минеральный остаток
–золу, которую затем анализируют.
,
где Е0
-
стандартный
потенциал реакции.В числители под
знаком логарифма записано произведение
активности продуктов реакции, а в
знаминателе –произведение активности
исходных в-в.В общем случае для ОВР ее
потенциал(ЭДС) – Е=Е1-Е2,
где Е1иЕ2-окислительно-восстанов.потенциалы
двух редокс-пар.Направления
протекания ОВР.
Учет знака потенциала ОВР позволяет
определить направление протекания
р-ии.Если потенциал Е больше нуля(Е=Е1-Е2>0),
то р-ия протекает в прямом направлении
в соответствии с записью уравнения
р-ии.Если <0, р-ия протекает в обратном
направлении, если он равен 0, то система
находится в состоянии устойчивого хим.
Равновесия. Связь
ЭДС с энергией Гиббса. Потенциал
реакции(ееЭДС) Е связан с изменением
энергии Гиббса ∆Gпри
протекания данной реакции соотношением:
∆G=-nFE,
изменении энергии Гиббса при любой
химической р-ии меньше нуля,тор-ия
протекает в прямом наравлении в
соответствии с записью в уравнении.Если
∆G>0,
р-ия идет в обратном направлении, ∆G=0
–устойчивое хим.равновесие.Всегда n>0
и F>0,
можно сделать вывод:при ∆G<0,
потенциал р-ии Е>0, ∆G>0,
потенциал р-ии Е<0, ∆G=0
– Е=0.Влияние
факторов на значение ОВ потенциалов.Зависят
от природы р-ии(природа реагента,
растворителя), конц.реагентов, рН среды,
темпер., присутствие др.в-в в
растворе.Использование.
ОВР
широко испол.как в качественном, так и
в колич.анализе.в качественном
анализе-(н-р, катионы одновалентной
ртути, открывают действуя на него
хлоридные комплексы олова в соляной
к-те-выпадает белый осадок каломелиHg2Cl2.,
анионы, облад-ие выраж. восстановительными
св-ми окисляются йодом(н-р, анионы S-2,
SO3-2,
S2O3-2.)
или раствором перманганата калия в
серно кислой среде. В количественном
агравиметрическом анализе используется
ОВР (для определения железа(11) его
предварительно окисляют до железа
(111) прибавляя конц. азотную к-ту., после
чего осаждают р-ом аммиака, затем
прокаливают до оксида Fe2O3
и взвешивают), при анализе ЛРС измельченный
образец озоляют(путем окислительного
нагревания и прокаливания) в фарфоровом
тигле превращают в минеральный остаток
–золу, которую затем анализируют.
19.Общая характеристика комплексных соединений, классификация комплексных соединений. Строение комплексных соединений. Равновесия в растворах комплексных соединений. Константы устойчивости и нестойкости комплексных соединений. Условные константы устойчивости. Влияние различных факторов на процесс комплексообразования.
Комплексные
соединения-
это соединения, образованные из простых,
способных к самостоятельному
существованию.КС образуют как металлы,
так и не Ме.(чаще Ме).КС состоит из атома
металла-компексообразователя М, с
которым связаны лиганды L.
Атом М и лиганды L
образуют внутреннюю сферу
комплекса(внутреннюю координац.сферу),
она заключается в квадратные скобки.
Если внутренняя сфера комплекса несет
отриц. Или полож. Заряд, то для компенсации
этого заряда необходимы ионы, обр-щие
внешнюю сферу.K4[Fe(CN)6]·3H2O-тригидрат
гексацианоферрата(11) калия.Атом
металла-комплексообразователя выступает
железо(11), лиганд- CN-.Железо(11)
и шесть цианогрупп образуют внутреннюю
координац.сферу комплекса, внешняя
сфера –четыре катиона К+
и 3 молекулы воды. На первом месте
записывается комплексообразователь,
а за ним – лиганды. Число лигандов
отмечается цифрой в нижнем индексе.
Формулу комплексного иона (внутренняя
сфера) заключают в квадратные скобки,
и тогда заряд комплексного иона
записывается в верхнем индексе за
скобками.В формуле комплексной соли
(или соединения) частицы внешней сферы
записывают перед скобками, если ионы
имеют положительный заряд (катионы), и
после скобок, если их заряд отрицателен
(анионы). Числа ионов внешней сферы
отмечаются нижним индексом при формуле
иона. Классификация.
1.По
принадлежности КС к определенному
классу соединений(комплексные к-ты,
комп.основания, комп.соли)2.По природе
лиганда(аквакомплексы, аммиакаты,
ацидокомплексы,гидрокомплексы 3.По
знаку заряда комплекса(катионные,
анионные, нейтральные –заряд
комплекса=0)4.По внутренней структурекомплекса.
КС катионного и анионного типа чаще
всего растворимы в воде.В их водных
растворах устанавливается
хим.равновесие.Комплексы-не электролиты-мало
растворимы, растворившая часть этих
комплекса введет себя как слабый
электролит.Н-р, при растворении
ферроцианида калия K4[Fe(CN)6]→4K++[Fe(CN)6]4-
это электролитическая диссоциация-отщепляются
ионы внешней сферы, затем происходит
вторичная диссоциация комплекса-
отщепляются леганды внутренней
сферы[Fe(CN)6]4-+
H2O=[
Fe(CN)5(H2O)]-3+
CN-,
[ Fe(CN)5(H2O)]-3+
H2O=[
Fe(CN)4(H2O)2]-2+
CN-,
[Fe(CN)(H2O)5]++
H2O=[Fe(H2O)6]+2+
CN-,каждая
ступень диссоциации внутренней сферы
комплекса характеризуется своей
константой химического равновесия.
Прочность комплексного иона характеризуется
его константой диссоциации, называемой
константой
нестойкости.
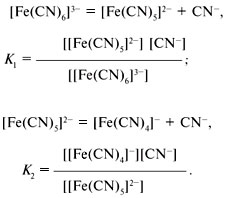
Аналогично составляются выражения для К3, К4, К5, К6, в которых квадратными скобками обозначены равновесные концентрации ионов.В аналитической химии вместо констант нестойкости в последнее время пользуются константами устойчивости комплексного иона:
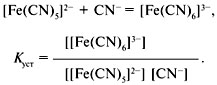
Константа устойчивости относится к процессу образования комплексного иона и равна обратной величине константы нестойкости:Куст = 1/Кнест.Константа устойчивости характеризует равновесие образования комплекса.Константы нестойкости или константы устойчивости определяются различными физико-химическими методами. Использование химических методов затруднено, т.к. измерение равновесных концентраций веществ часто приводит к смещению равновесия. Условная константа устойчивости меньше, чем реальная, почти в 10м раз. Условные константы устойчивости имеют большое практическое значение, поскольку при фиксированных рН и концентрации лиганда побочной реакции они постоянны и ими можно пользоваться в расчетах так же, как и обычными константами устойчивости. В то же время расчеты с использованием условных констант значительно менее трудоемки, так как коэффициенты побочных реакций можно рассчитать заранее и табулировать. Условные константы устойчивости сохраняют постоянное значение только при строго конкретных условиях, например при постоянных значениях рН и ( или) постоянных концентрациях посторонних лиган-дов. Их следует применять в тех случаях, когда известны значения а и их зависимость от рН или концентрации постороннего лиганда. Условные константы можно использовать в расчетах точно так же, как и обычные константы, однако результаты таких расчетов относятся к конкретным частным условиям. Влияние факторов на процесс комплексообразование. Влияние рН среды, конц.лиганда(чем больше конц. Лиганда, тем полнее металл связывается в комплекс), влияние посторонних ионов, образующих малорастворимые соединения с металлом-комплексообразователем(введение посторонних ионов, может привести к разрушению комплексов), влияние ионной силы раствора(изменение ионной силы р-ра изменяются равновесные активности ионов),влияние температуры.
20. Методы разделения и концентрирования веществ в аналитической химии. Основные понятия. Классификация методов разделения и концентрирования. Осаждение и соосаждение. Применение экстракции в аналитической химии. Принцип метода жидкостной экстракции. Основные понятия жидкостной экстракции.
Методы
разделения и конц.в-в.Понятие.
Разделение –это операция(процесс), в
результате которой компоненты,
составляющие исходную смесь отделяются
друг от друга.Концентрирование –это
операция(процесс), в результате повышается
отношение конц.(кол-ва) микрокомпонента
к конц. Макрокомпонента(или
основы).Результаты конц.количественно
хар-ют коэффициентом концентрирования
Кконц= Кконц-коэфф.концентрирования(>1),
Кконц-коэфф.концентрирования(>1), конц.
в-ва в исходном р-ре и после
концентрирования,
конц.
в-ва в исходном р-ре и после
концентрирования, объем
исходного р-ра и после
концентрирования.Классификация.
Физические методы –упаривание(неполное
испарение растворителя), выпаривание(испарения
растворителя досуха),перегонка(отделение
летучих компонентов).Химические
методы-осаждения,
соосождение.Осаждение-разделение(систематический
ход анализа),концентрирование(осаждение
определяемого иона из большого объема
анализируемого раствора и растворение
осадка в малом объеме).Физ-хим.
Методы-экстракция, хромотография.Соосаждение-это
одновременное осаждение из одного и
того же р-ра растворимого в данных
условиях микрокомпонента с выпадающим
в осадок макрокомпонентом. Соосаждение-
осаждение с коллектором. Причины
соосаждения-поверхностная
абсорбция(соосажденное в-во адсорбируется
на поверхности коллектора и осаждается
с ним), окклюзия(механический захват
части маточного р-ра с соосаждаемым
ионом внутрь осадка коллектора),
инклюзия(включение соосаждаемого в-ва
в кристаллическую решетку
коллектора).Экстракция – это когда из
водного р-ра в-во извлекается в
несмешивающийся с водой органический
растворитель.Применение
Эксракция
надхромовой к-ты при обнаружении ионов
хрома(синяя окраска), экстракция
роданидного комплекса кобальта при
обнаружении инов кобальта(синяя
окраска).Принцип
метода. Основана
на использовании различной способности
в-в распределятся между двумя
несмешивающимеся контактирующими
жидкими фазами., т.е. на их различной
растворимости в этих жидких фазах.Основные
понятие жидкостной экстракции.
Экстрагент-органический растворитель,
извлекающий данное в-во из водной фазы.
Экстрагируемое в-во-в-во, извлекаемое
экстрагентом из водного р-ра.Экстракционны
реагент-в-во, способствующее экстракции
извлекаемого в-ва.Экстракт-отдельная
жидкая органическая фаза, со-ая
экстрагированное из водного р-ра
в-во.Экстрактор- аппарат для проведения
экстракции.
объем
исходного р-ра и после
концентрирования.Классификация.
Физические методы –упаривание(неполное
испарение растворителя), выпаривание(испарения
растворителя досуха),перегонка(отделение
летучих компонентов).Химические
методы-осаждения,
соосождение.Осаждение-разделение(систематический
ход анализа),концентрирование(осаждение
определяемого иона из большого объема
анализируемого раствора и растворение
осадка в малом объеме).Физ-хим.
Методы-экстракция, хромотография.Соосаждение-это
одновременное осаждение из одного и
того же р-ра растворимого в данных
условиях микрокомпонента с выпадающим
в осадок макрокомпонентом. Соосаждение-
осаждение с коллектором. Причины
соосаждения-поверхностная
абсорбция(соосажденное в-во адсорбируется
на поверхности коллектора и осаждается
с ним), окклюзия(механический захват
части маточного р-ра с соосаждаемым
ионом внутрь осадка коллектора),
инклюзия(включение соосаждаемого в-ва
в кристаллическую решетку
коллектора).Экстракция – это когда из
водного р-ра в-во извлекается в
несмешивающийся с водой органический
растворитель.Применение
Эксракция
надхромовой к-ты при обнаружении ионов
хрома(синяя окраска), экстракция
роданидного комплекса кобальта при
обнаружении инов кобальта(синяя
окраска).Принцип
метода. Основана
на использовании различной способности
в-в распределятся между двумя
несмешивающимеся контактирующими
жидкими фазами., т.е. на их различной
растворимости в этих жидких фазах.Основные
понятие жидкостной экстракции.
Экстрагент-органический растворитель,
извлекающий данное в-во из водной фазы.
Экстрагируемое в-во-в-во, извлекаемое
экстрагентом из водного р-ра.Экстракционны
реагент-в-во, способствующее экстракции
извлекаемого в-ва.Экстракт-отдельная
жидкая органическая фаза, со-ая
экстрагированное из водного р-ра
в-во.Экстрактор- аппарат для проведения
экстракции.
