
- •4. Первый закон Ньютона
- •Современная формулировка[
- •Второй закон Ньютона
- •Третий закон Ньютона[
- •Центробежное ускорение
- •Гравитационное ускорение
- •Ускорение свободного падения на Земле
- •Измерение
- •Сила трения в природе
- •Роль силы трения в быту
- •Сила трения в технике
- •Роль силы трения в природе
- •9. Механическая работа и мощность
- •Кинетическая и потенциальная энергии
- •Закон сохранения механической энергии
- •История появления термина[править | править исходный текст]
- •Определение импульса в механике Ньютона[править | править исходный текст]
- •Обобщённый импульс в теоретической механике[править | править исходный текст]
- •Определение через волны де Бройля[править | править исходный текст]
- •Закон сохранения импульса в общей теории относительности[править | править исходный текст]
- •Абсолютно упругий удар
- •Момент силы и момент импульса относительно неподвижного начала
- •11. Условия равновесия тел
- •Виды равновесия
- •Общие сведения[править | править исходный текст]
- •Предыстория[править | править исходный текст]
- •Единицы[править | править исходный текст]
- •13. Агрегатные состояния вещества с точки зрения мкт
- •14. Идеальный газ
- •Скорость молекул газа
- •Основное уравнение мкт газа
- •Дополнительные расчетные формулы по теме
- •Шкала Кельвина
- •Шкала Цельсия
- •Шкала Фаренгейта
- •Шкала Реомюра
- •Графики изопроцессов
- •Сравнительная таблица графиков изопроцессов
- •Кипение жидкости
- •Зависимость температуры кипения от давления
- •19. Влажность воздуха
- •Точка росы
- •Измерение влажности
- •20. Свойства поверхности жидкостей. Поверхностное натяжение. Капиллярные явления.
- •21. Кристаллические и аморфные тела
- •Типы и виды кристаллов
- •Одномерные дефекты[править | править исходный текст]
- •Двумерные дефекты[править | править исходный текст]
- •Трёхмерные дефекты[править | править исходный текст]
- •Методы избавления от дефектов[править | править исходный текст]
- •Полезные дефекты[править | править исходный текст]
- •22. Внутренняя энергия тел и способы ее изменения.
- •Внутренняя энергия. Количество теплоты. Работа в термодинамике
- •Первый закон термодинамики
- •Частные случаи первого закона термодинамики для изопроцессов
- •Цикл Карно для тепловой машины
14. Идеальный газ
Идеальный газ - это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало. - вводится для математического описания поведения газов. Реальные разреженные газы ведут себя как идеальный газ! Свойства идеального газа: - взаимодействие между молекулами пренебрежительно мало - расстояние между молекулами много больше размеров молекул - молекулы - это упругие шары - отталкивание молекул возможно только при соударении - движение молекул - по законам Ньютона - давление газа на стенки сосуда - за счет ударов молекул газа
Скорость молекул газа
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул. Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная. Формула для расчета среднего значения квадрата скорости молекул газа:
![]()
где n - число молекул в газе v - модули скоростей отдельных молекул в газе В теории газов часто используется понятие кинетической энергии молекул. Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
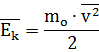
Основное уравнение мкт газа
Основное уравнение МКТ связывает микропараметры частиц ( массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р - давление, V - объем, Т - температура). Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Ниже приведены различные выражения для основного уравнения МКТ:
![]()
где
р
- давление газа на стенки сосуда(Па)
n
- концентрация молекул, т.е. число молекул
в единице объема ( 1/м3)
![]() -
масса молекулы (кг)
-
масса молекулы (кг)
![]() -
средний квадрат скорости молекул (
м2/с2)
ρ - плотность газа (кг/м3)
-
средний квадрат скорости молекул (
м2/с2)
ρ - плотность газа (кг/м3)
![]() -
средняя кинетическая энергия молекул
(Дж)
Давление идеального газа
на стенки сосуда зависит от концентрации
молекул и пропорционально средней
кинетической энергии молекул.
-
средняя кинетическая энергия молекул
(Дж)
Давление идеального газа
на стенки сосуда зависит от концентрации
молекул и пропорционально средней
кинетической энергии молекул.
Дополнительные расчетные формулы по теме
Формула для расчета концентрации молекул:
![]()
где N - число молекул газа V - объем газа (м3) Формула для расчета плотности газа:
![]()
где mo - масса молекулы (кг) n - концентрация молекул (1/м3)
Давле́ние ![]() — физическая
величина,
численно равная силе F,
действующей на
единицу площади поверхности S перпендикулярно этой
поверхности. В данной точке давление
определяется как отношение нормальной
составляющей силы
— физическая
величина,
численно равная силе F,
действующей на
единицу площади поверхности S перпендикулярно этой
поверхности. В данной точке давление
определяется как отношение нормальной
составляющей силы ![]() ,
действующей на малый элемент поверхности,
к его площади:
,
действующей на малый элемент поверхности,
к его площади:
![]()
Среднее давление по всей поверхности есть отношение силы к площади поверхности:
![]()
Давление характеризует состояние сплошной среды и является диагональной компонентой тензора напряжений. В простейшем случае изотропной равновесной неподвижной среды давление не зависит от ориентации.
Давление является интенсивной физической величиной. В Международной системе единиц (СИ) измеряется в паскалях (русское обозначение: Па; международное: Pa). Один паскаль равен одному ньютону на квадратный метр. В других системах единиц применяются также следующие единицы измерения давления:
Идеальный газ — математическая модель газа, в которой предполагается, что: 1) потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией; 2) суммарный объём молекул газа пренебрежимо мал; 3) между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги; 4) время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. В расширенной модели идеального газа частицы, из которого он состоит, имеют форму упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц[1].
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении икомнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
Закон Авога́дро — одно из важных основных положений химии, гласящее, что «в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул». Было сформулировано ещё в 1811 году Амедео Авогадро (1776—1856), профессором физики в Турине.
АВОГА́ДРО ЗАКО́Н, один из основных законов идеальных газов: в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число молекул. Число молекул в одном моле называют постоянной Авогадро или числом Авогадро. Закон был открыт А. Авогадро в 1811.
Согласно закону Авогадро, 1 моль любого идеального газа при нормальных условиях занимает одинаковый объем. При давлении р =101,325 кПа и температуре Т = 273,15 К этот объем равен 22,41383 м3. Следовательно, моль любого вещества содержит одно и то же число молекул, равное числу Авогадро 6,022045(31).1023 моль-1.
Из закона Авогадро следует, что при одних и тех же давлении и температуре плотности двух идеальных газов прямо пропорциональны, а удельные объемы обратно пропорциональны их молекулярным массам.
На основе закона Авогадро в дальнейшем стало развиваться атомно-молекулярное учение, которое является следствиемкинетической теории газов. Закон Авогадро широко применяется в химии только с 1860 г., но имел громадное значение для ее развития, так как давал возможность определять вес тел, способных переходить в газообразное или парообразное состояние. Я. Вант-Гофф, один из основоположников физической химии, распространил законы идеальных газов на разбавленные растворы, считая, что растворенные вещества распространяются по объему растворителя подобно газу в сосуде, и при помощи закона Авогадро разработал метод определения молекулярной массы растворенных веществ. Закон Авогадро позволил установить истинные атомные массы ряда элементов. Используется при расчетах по химическим формулам и уравнениям химических реакций, для определения относительных молекулярных масс газов, для определения числа молекул в моле любого вещества.
Закон Дальтона — Давление смеси газов, не взаимодействующих друг с другом химически, равно сумме парциальных давлений этих газов.
![]()
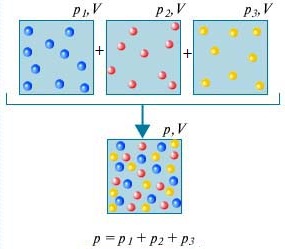
Для того чтоб понять, что представляет из себя закон Дальтона , рассмотрим для этого воздух в комнате. Он представляет собой смесь нескольких газов: азота (80%), кислорода (20%). Парциальное давление каждого из этих газов — это давление, которое имел бы газ, если бы он один занимал весь объем. К примеру, если бы все газы, кроме азота, удалили из комнаты, то давление того, что осталось, и было бы парциальным давлением азота. Закон Дальтона утверждает, что общее давление всех газов вместе взятых равно сумме парциальных давлений каждого газа в отдельнсти. (Строго говоря, закон применим только к идеальным газам, но с достаточно хорошим приближением он описывает также и реальные газы.)
Так же, закон Дальтона описывает связь растворимости компонентов газовой смеси, которая пропорциональна их парциальному давлению.
![]()
В Формуле мы использовали :
![]() —
Давление
смеси газов
—
Давление
смеси газов
![]() —
Масса
растворимого газа
—
Масса
растворимого газа
![]() —
Давление
окружающей среды
—
Давление
окружающей среды
15. Температура - физическая величина, характеризующая среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия. В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Постоянная Больцмана - физическая постоянная (k), равная отношению универсальной газовой постоянной к постоянной Авогадро.
ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ, процедура определения ТЕМПЕРАТУРЫ тела или системы. Установлены несколько ТЕМПЕРАТУРНЫХ ШКАЛ, каждая из которых использует какое-либо свойство (электрическое сопротивление или расширение объема) термометрического вещества, например, металлической проволоки или жидкости, для определения единицы измерения температуры. Стандартным видом термометра принято считать газовый термометр постоянного объема. С его помощью выражают температуру в градусах Кельвина, но он неудобен на практике. В 1968 г. была принята Международная Практическая Температурная Шкала (МПТШ), более удобная для применения в научных и технических целях. Впоследствии она регулярно пересматривалась. По МПТШ 0°С принят равным 273,15 К; определен также ряд эталонных температур, включающий температуру кипения кислорода, 90,20 К (-182,96 °С), плавления и кипения воды, плавления цинка, серебра и золота. Для измерения высоких температур, таких как температуры в промышленных печах, используются оптические пирометры, которые определяют температуру по изменению свечения раскаляемой металлической нити.
История
Слово «температура» возникло в те времена, когда люди считали, что в более нагретых телах содержится большее количество особого вещества — теплорода, чем в менее нагретых. Поэтому температура воспринималась как крепость смеси вещества тела и теплорода. По этой причине единицы измерения крепости спиртных напитков и температуры называются одинаково — градусами.
Из того, что температура - это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (т.е. в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах — градусах.
