
- •Предмет аналітичної хімії, структура, класифікація видів аналізу. Класифікації методів аналізу.
- •Характеристики методів аналізу: точність, границя визначення, діапазон вимірюваних концентрацій, чутливість та інші.
- •Мета якісного аналізу. Якісні реакції “мокрим” і “сухим” шляхом. Вимоги до аналітичних реакцій, які застосовуються в якісному аналізі.
- •Усунення впливу сторонніх йонів. Маскування. Маскуючі речовини.
- •Маскування
- •Розділення осадженням. Систематичний та дробний аналіз. Аналітичні класифікації катіонів і аніонів. Групові реагенти. Аналітичні групи.
- •Кислотно – лужна система якісного аналізу катіонів
- •Кислотно-лужна система якісного аналізу катіонів. Характерні реакції катіонів 1-6 аналітичних груп.
- •Кислотно – лужна система якісного аналізу катіонів
- •2 Група
- •3 Група
- •4 Група
- •Органічні реагенти, які застосовуються в хімічному аналізі.
- •Основні етапи аналізу. Відбір проб природних вод, атмосферного повітря, грунтів. Види проб: генеральна, середня, лабораторна.
- •Основні стадії підготовки проби до аналізу. Фактори, які впливають на вибір способу розкладу проби і переведення її в розчин. Підготовка проб природних вод, атмосферного повітря, грунту.
- •Сутність методу гравіметрії. Методи відгонки та осадження. Етапи гравіметричного визначення методом осадження. Форма осадження, гравіметрична форма, вимоги до них.
- •Утворення осадів. Процеси, які визначають розміри кристалів. Пересичення. Утворення кристалічних та аморфних осадів.
- •Умови отримання кристалічних та аморфних осадів. Оцінка методу гравіметрії та його застосування.
- •Застосування гравіметричного аналізу:
- •Причини забруднення осаду. Адсорбція, оклюзія, ізоморфне співосадження. Способи зменшення співосадження.
- •Пристрої та посуд для виконання гравіметричного аналізу
- •Сутність титриметричного аналізу. Титрування, титрант, вимоги до реакцій титрування. Класифікація титриметричних методів а) за способом виконання; б) за реакцією титрування.
- •Стандартні розчини в титриметрії. Способи приготування стандартних розчинів. Вимоги до стандартної речовини.
- •Способи визначення концентрації стандартних розчинів: молярна концентрація еквіваленту, титр, титр за речовиною, що визначається.
- •19. Кислотно-основне титрування. Титранти. Індикатори, вимоги до них. Показник індикатора. Вибір кислотно-основного індикатора. Оцінка методу, його застосування. Кислотно-основне титрування
- •2 Частина
- •1. Дати оцінку основним групам фізико-хімічних методів аналізу. Який виникає аналітичний сигнал в цих групах методів?
- •2. На конкретному прикладі охарактеризувати оптичні методи аналізу?
- •3. Пояснити природу електромагнітного випромінювання та сутність хвильових та квантових характеристик.
- •4. Пояснити природу монохроматичного та поліхроматичного світла.
- •5. Сформулювати, записати та пояснити основний закон поглинання світла.
- •6. Дати визначення оптичній густині та пояснити як вона залежить від концентрації розчину.
- •7. Рефрактрометричний метод аналізу
- •8. Поляриметричний метод
- •9. На прикладі пояснити сутність застосування методу калібрувального графіку для аналізу досліджуваної проби.
- •10. Проаналізувати вимоги до фотометричних реакцій? Навести приклади та пояснити з яких етапів складається визначення фотометричним методом?
- •11. Дати оцінку основним характеристикам і закономірностям люмінесценції та вказати основну вимогу до зовнішніх джерел випромінювання люмінесценції?
- •12. Вказати та проаналізувати особливості якісного та кількісного спектрального аналізу.
- •13. Обґрунтувати можливість застосування методу атомно-абсорбційної спектроскопії для якісного та кількісного аналізу.
- •14. Охарактеризувати електрохімічні методи аналізу та вказати який аналітичний сигнал фіксують в електрохімічних методах?
- •15. Проаналізувати особливості сфер застосування фізико-хімічних методів аналізу.
7. Рефрактрометричний метод аналізу
Метод аналізу розчинів, який ґрунтується на вимірюванні показника заломлення, як функції концентрації визначуваної речовини називається рефрактометрією.
Рефрактометрія як дуже швидкий і простий метод широко використовується для визначення концентрації речовин у розчинах в цукровій, харчовій, фармацевтичній та інших галузях промисловості. Часто даний метод використовують в комбінації з іншими, а також для створення детекторів для рідкісної хроматографії.
Для вимірювання показника заломлення рідин використовують прилади – рефрактометри, які основані на вимірюванні кута повного внутрішнього відображення. Відомі два типа рефрактометрів - Пульфриху і Аббе (рис. 4.2.2.).
Показник заломлення залежить від температури і довжини хвилі світла, що використовується. Тому в рефрактометрах передбачена підтримка сталої температури блока призми. Можна також вносити температурні поправки або враховувати температурну залежність при побудові калібрувальних графіків.
Ціна поділки шкали 0,001. Десятитисячні долі оцінюються приблизно.
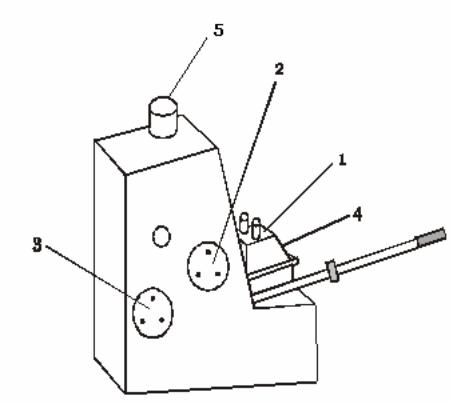
Рисунок 4.2.3 – Зовнішній вигляд рефрактометра ІРФ–454:
1 – призмений блок; 2, 3 – маховички; 4 –шторка; 5 –окуляр
8. Поляриметричний метод
Поляриметрія – метод кількісного аналізу, що ґрунтується на здатності
деяких речовин (оптично активних) обертати площину поляризації видимого
електромагнітного випромінювання. Ця властивість пов’язана з особливостями
будови молекул речовини, наприклад, присутністю в них асиметричних атомів
Карбону. Кут обернення площини поляризації (β) залежить від концентрації
оптично активної речовини в розчині.
β = ℓ α·с, (5.3.1)
де β – кут обернення площини поляризації, 0S; ℓ − довжина променю в розчині, см;
α – питоме обернення площини поляризації – коефіцієнт рівний куту обернення
Речовини можуть обертати площину поляризації вправо “+” або вліво “-“.
Питоме обернення площини поляризації залежить від природи речовини, довжини
хвилі поляризуючого світла, температури і природи розчинника.
Поляриметричні кювети – це скляні або металічні трубки, які калібровані за довжиною і закриваються з торців скляними віконцями. Перед заповненням кювети її слід ополоснути невеликою кількістюаналізованої речовини. Для заповнення кювети відвірчують прижимну гайку з одного боку трубки і заливають в неї розчин, так щоб він утворював випуклий меніск над торцем кювети.
Оптична схема поляриметра-сахариметра:
1 – джерело світла; 2 – лінза; 3 – поляризатор; 4 – кювета; 5 – аналізатор; 6 - окуляр
9. На прикладі пояснити сутність застосування методу калібрувального графіку для аналізу досліджуваної проби.
При використанні графічного способу визначення концентрації розчину речовини будують калібрувальний графік у координатах n-C, вимірюють показник заломлення розчину і за графіком знаходять відповідну концентрацію.
Прямі методи кількісних визначень за допомогою фізико-хімічних вимірювань поділяються на:
а) Метод градуювального графіку (МГГ). В цьому методі вимірюють інтенсивність аналітичного сигналу (І) для декількох стандартних розчинів та будують градуювальник графік зазвичай у координатах І=f(С), де С-концентрація речовини у стандартних розчинах. Потім в тих самих умовах вимірюють інтенсивність сигналу у пробі, яка аналізується, та за градуювальним графіком визначають концентрацію речовини у цій пробі (рис. 1).
б) Метод молярної властивості (ММВ) або метод порівняння зі стандартом. При виконанні цього метода вимірюють аналітичний сигнал для декількох стандартних розчинів та розраховують константу А, яка характеризує молярну властивість речовини: А=І/С. Потім в тих само умовах вимірюють інтенсивність сигналу для аналізованого розчину та за співвідношенням С=І/А розраховують концентрацію аналізованого компонента;
в) Метод добавок (МД). Спочатку вимірюють інтенсивність сигналу аналізованого розчину:
Іх=АСх
потім до цього ж розчину додають відомий об’єм стандартного розчину з концентрацією Сст. і знову вимірюють інтенсивність сигналу:
Іх+ст.=А(Сх+Сст)
тоді: А=Іх/Сх=Іх+ст./(Сх+Сст)=А, звідси:
Сх=СстІх/(Іх+ст - Іх) (2)
де, Іх – інтенсивність аналітичного сигналу аналізованого розчину;
Іх+ст – інтенсивність аналітичного сигналу після додавання стандартного розчину.
Рівняння (2) можна розв’язати графічно.
Метод молярної властивості та метод добавок вимагають чіткого виконання співвідношення
