
- •1. Температура
- •§1. Температура және термодинамикалық тепе-теңдік
- •§2 Термоскоп және температуралық нүктелер
- •§3 Температура шкалалары
- •2. Идеал газдың молекула-кинетикалық теориясы
- •§4.Идеал газ
- •§5. Газ қысымы. Молекула-кинетикалық теорияның негізгі теңдеуі
- •§6. Идеал газ күйінің теңдеуі
- •§7. Идеал газ заңдары
- •§8. Орташа квадраттық жылдамдық
- •Бақылау сұрақтары:
- •§9. Барометрлік формула
- •Бақылау сұрақтары:
- •§10. Больцман таралуы
- •§11. Ықтималдықтар теориясынан қысқаша түсінік
- •§12. Кездейсоқ шаманың орташа мәні. Ықтималдықтардың таралу функциясы
- •§13. Жүйенің макроскопиялық және микроскопиялық күйлері
- •§14. Макрокүйдің ықтималдығы
- •§15. Канондық ансамбль. Гиббс таралуы
- •§16. Газ молекулаларының жылдамдықтары бойыншатаралуының Максвелл заңы
- •§17. Молекулалардың жылдамдықтың абсолюттік мәні бойынша таралуы. Молекулалардың орташа жылдамдықтары
- •§18. Перрен тәжірибесі
- •3. Термодинамиканың бірінші бастамасы
- •§19. Квазистатикалық процестер
- •§20. Макроскопиялық жұмыс
- •§21. Термодинамиканың бірінші бастамасы
- •§22. Ішкі энергия
- •§23. Жылу мөлшері
- •§24. Жылусыйымдылық
- •§25. Идеал газдың ішкі энергиясы. Джоуль заңы
- •§26. Адиабаттық процесс. Пуассон теңдеуі
- •§27. Газ көлемінің адиабаталық өзгерісі кезіндегі жұмыс
- •§28. Политроптық процесс
- •§29. Клеман және Дезорм әдісімен қатынасын анықтау*
- •§30. Газдардағы дыбыс жылдамдығы*
- •§31. Бернулли теңдеуі*
- •§32. Жіңішке саңлаудан шыққан газдың жылдамдығы
- •4.Термодинамиканың екінші бастамасы
- •§33. Қайтымды және қайтымсыз процестер
- •§34. Термодинамиканың екінші бастамасының әр түрлі тұжырымдамалары
- •§35. Карно циклі
- •§36. Температураның термодинамикалық шкаласы
- •§37 Клаузиус теңсіздігі. Энтропия
- •§38. Энтропияның өсу заңы
- •§39. Газдардың диффузиясы кезінде энтропияның өсуі. Гиббс парадоксі
- •§40.Термодинамикалық потенциалдар
- •§41. Энтропияның физикалық мәні. Энтропия және ықтималдылық
- •§42. Нернст теоремасы
- •§43. Термодинамикалық тепе теңдік шарттары
- •Газдардағы тасымалдау құбылыстары
- •§44. Еркін жүрудің орташа жолы
- •Нақты газдар
- •§47 Беттік керілу
- •§48Шектік бұрыштар. Жұғу және жұқпау
- •§49. Сұйықтың майысқан бетінің екі жағындағы қысымдар айырымы. Лаплас формуласы
- •§50. Фазалар және фазалық түрленулер
§6. Идеал газ күйінің теңдеуі
Молекула-кинетикалық көзқарас негізінде алынған теңдеулер газ күйін сипаттауға болатын физикалық шамалардың өзара қатынасын анықтауға мүмкіндік береді. Мұндай шамалар: P – қысым, Т – температура және V – көлем. Оларды газ күйінің параметрлері деп атайды. Осы үш шама бір-біріне тәуелді. Олардың әрқайсысы қалған екеуінің функциясы болып табылады. Осы үш параметрлерді байланыстыратын (P,V,Т) (газдың тұрақты массасы үшін) теңдеуді газ күйінің теңдеуі деп атайды.
 (6.1)
(6.1)
Бұдан газ күйі екі параметрмен анықталатындығы көрінеді. Үшінші параметр алдыңғы екеуімен анықталады.
Идеал
газдар үшін күй теңдеуін МКТ-ның негізгі
теңдеуінен ( )шығаруға
болады.Егер Vкөлемде
Nбөлшек
болса, онда молекулалар концентрациясы
)шығаруға
болады.Егер Vкөлемде
Nбөлшек
болса, онда молекулалар концентрациясы болып
анықталады. Онда, МКТ-ның негізгі теңдеуі
мына түрде жазылады:
болып
анықталады. Онда, МКТ-ның негізгі теңдеуі
мына түрде жазылады:
 (6.2)
(6.2)
Соңғы теңдеуде газ күйінің үш параметрі бір-бірімен байланысқан, сондықтан оны күй теңдеуі ретінде қарастыруға болады. Мұндағы анықталуы қиынға соғатын молекулалар санын газ массасы мен мольдік масса (М) арқылы өрнектеген дұрыс:
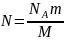 ,
,
мұндағы
 Авогадро тұрақтысы деп аталады. Кез
келген заттың бір моліндегі бөлшектер
саны Авогадро тұрақтысына тең. Осыны
ескеріп идеал газ күйінің теңдеуін мына
түрде жазамыз:
Авогадро тұрақтысы деп аталады. Кез
келген заттың бір моліндегі бөлшектер
саны Авогадро тұрақтысына тең. Осыны
ескеріп идеал газ күйінің теңдеуін мына
түрде жазамыз:
 .
.
Авогадро мен Больцман тұрақтыларының көбейтіндісі универсал газ тұрақтысы деп аталады:
 ,
(6.3)
,
(6.3)
мұндағы R – универсал газ тұрақтысы
 .
.
 - мольдер
саны. Егер
- мольдер
саны. Егер
 ,
демек газдың бір молі үшінидеал газ
күйінің теңдеуі мына түрде жазылады:
,
демек газдың бір молі үшінидеал газ
күйінің теңдеуі мына түрде жазылады:
 .
(6.4)
.
(6.4)
Ал, кез келген мольдер саны үшін идеал газ күйініңтеңдеуін мына түрде жаза аламыз:
 ,
(6.5)
,
(6.5)
немесе
 .
(6.6)
.
(6.6)
Осы түрде жазылған идеал газ күйінің теңдеуін Менделеев-Клапейронтеңдеуі деп атайды.
Бақылау сұрақтары:
Газ күйін сипаттайтын қандай макропараметрлерді білесіз?
Молекулалар концентрациясы қалай анықталады?
Газдың бір молінде қанша молекула болады?
Идеал газ күйінің теңдеуін тұжырымдаңыз.
§7. Идеал газ заңдары
1. Бойль-Мариотт заңы.Құрамы мен массасы тұрақты болып қалатын идеал газды тұрақты температура кезінде қарастырайық. Тұрақты температурада газ күйінің өзгеру процесі изотермиялықпроцесс деп аталады. Егер Менделеев-Клапейрон теңдеуінде T=constболса, онда

 (7.1)
(7.1)
Бұл
теңдеу изотермиялықпроцесстіңтеңдеуі
болып табылады. Бойль-Мариотт заңына
сәйкес газдың берілген массасы үшін
тұрақты температура кезінде оның қысымы
мен көлемінің көбейтіндісі тұрақты
болып қалады. Әр түрлі температуралар
үшін қысымның көлемге тәуелділігі
изотермалар
деп аталады. Изотермалар – гиперболалар
болып табылады. 4-суретте массасы тұрақты
идеал газдың әртүрлі температураларына
сәйкес келетін изотермалар көрсетілген.
Мұндағы температуралардың қатынасы
мынадай
 ,
демек PVдиаграммасында
температурасы жоғары изотерма жоғарырақ
жатады.
,
демек PVдиаграммасында
температурасы жоғары изотерма жоғарырақ
жатады.
2 .
Гей-Люссак заңы. Енді
массасы мен құрамы өзгермейтігн идеал
газдың P
қысымы тұрақты болып қалып, оның
температурасы мен көлемі өзгеретін
болсын. Мұндай шартты орындау үшін газды
жылжымалы поршенмен жабылған цилиндрде
ұстайық (5-сурет). Мұндай цилиндрдегі
газдың температурасын өзгерткен кезде
газдың қысымы өзгеріп, ол поршенді
жылжытады да, газдың көлемі де өзгереді.
Газ тепе-теңдік күйіне келген кезде газ
қысымы бастапқы мәнін қабылдайды.
.
Гей-Люссак заңы. Енді
массасы мен құрамы өзгермейтігн идеал
газдың P
қысымы тұрақты болып қалып, оның
температурасы мен көлемі өзгеретін
болсын. Мұндай шартты орындау үшін газды
жылжымалы поршенмен жабылған цилиндрде
ұстайық (5-сурет). Мұндай цилиндрдегі
газдың температурасын өзгерткен кезде
газдың қысымы өзгеріп, ол поршенді
жылжытады да, газдың көлемі де өзгереді.
Газ тепе-теңдік күйіне келген кезде газ
қысымы бастапқы мәнін қабылдайды.
Менделеев-Клапейрон
теңдеуінде қысым тұрақты болса
 ,
онда көлемнің температураға қатынасы
тұрақты болады
,
онда көлемнің температураға қатынасы
тұрақты болады
 .
Демек,
.
Демек,
 .
(7.2)
.
(7.2)
Бұл процесс изобаралық процессдеп аталады. Егер температура абсолюттік шкала бойынша алынса, онда изобаралық процестің графигі – изобараларкоординаттар басынан шығатын түзу болып табылады (6-сурет).
3 .
Шарль заңы. Егер
массасы мен құрамы өзгермейтін идеал
газ күйінің өзгерісі кезінде газдың
көлемі тұрақты болып қалса, ондай
процесті изохоралық
процесс деп атайды. Сонымен, изохоралық
процесс кезінде газдың көлемі тұрақты
болып, қысым мен температура бір-біріне
тәуелді болады. Егер Менделеев-Клапейрон
теңдеуінде көлем тұрақты болса
.
Шарль заңы. Егер
массасы мен құрамы өзгермейтін идеал
газ күйінің өзгерісі кезінде газдың
көлемі тұрақты болып қалса, ондай
процесті изохоралық
процесс деп атайды. Сонымен, изохоралық
процесс кезінде газдың көлемі тұрақты
болып, қысым мен температура бір-біріне
тәуелді болады. Егер Менделеев-Клапейрон
теңдеуінде көлем тұрақты болса
 ,онда
қысым мен температураның бір-біріне
тәуелділігі мынандай заңдылықпен
өзгереді:
,онда
қысым мен температураның бір-біріне
тәуелділігі мынандай заңдылықпен
өзгереді:
 .
(7.3)
.
(7.3)
Демек,
 .
.
Егер температура абсолюттік шкала бойынша алынса, онда изохоралық процестің графигі – изохоралар координаттар басынан шығатын түзу болып табылады (7-сурет).
4. Авогадро заңы. Бұл заң бойынша: бірдей қысым, бірдей температура кезінде газдың бірдей көлемінде молекулалардың бірдей саны болады. Осы заңнан керісінше, түрліше газдардың молекулаларының бірдей санының бірдей температура мен бірдей қысым кезінде бірдей көлем қабылдайтындығы шығады. Сондықтан, газдың 1 молі берілген қысым мен температура кезінде бірдей көлем қабылдайды. Мысалы, 00С температурада, 1,01•105Па қысымда газдың 1 молінің көлемі:
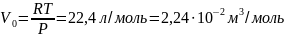 .
(7.4)
.
(7.4)
Осы қалыпты жағдайда 1м3 көлемдегі молекулалар саны Лошмидт саны деп аталады:
 .
(7.5)
.
(7.5)
Егер
Авогадро санымен мольдік көлем мәндерін
осы формулаға қойсақ, онда Лошмидт
санының мәні
 болады.
болады.
5.
Дальтон заңы.Көлемі
бірдей V болатын ыдыстардың ішінде
әртүрлі газдар болсын. Газдардың сол
ыдыста тұрғандағы қысымдары сәйкесінше
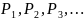 болсын.Егер
осы бірдей ыдыстардағы газдарды бір
ылыс ішінде араластырып жібергеннен
кейін жүйе тепе-теңдік күйге келетін
болса және олардың арасында ешқандай
реакциялар жүрмесе, онда қоспаның қысымы
былай анықталады:
болсын.Егер
осы бірдей ыдыстардағы газдарды бір
ылыс ішінде араластырып жібергеннен
кейін жүйе тепе-теңдік күйге келетін
болса және олардың арасында ешқандай
реакциялар жүрмесе, онда қоспаның қысымы
былай анықталады:
 (7.6)
(7.6)
мұндағы
 - парциалдық
қысымдар.
Парциалдық қысым деп, қоспадағы бір газ
сол ыдыстың көлемін тек қана жалғыз өзі
алып тұрғандағы қысымды айтамыз. Сонымен,
қоспа газдың қысымы парциал қысымдардың
қосындысына тең болады. Бұл заңды ең
алғаш эмпирикалық жолмен Дальтон
анықтаған.
- парциалдық
қысымдар.
Парциалдық қысым деп, қоспадағы бір газ
сол ыдыстың көлемін тек қана жалғыз өзі
алып тұрғандағы қысымды айтамыз. Сонымен,
қоспа газдың қысымы парциал қысымдардың
қосындысына тең болады. Бұл заңды ең
алғаш эмпирикалық жолмен Дальтон
анықтаған.
Дальтон заңын идеал газдың күй теңдеуінен де шығаруға болады. Ол үшін күй теңдеуін мына түрде жазайық:
 ,
,

Бұдан
 ,
,
 ,
, ,
….
,
….
.
Бақылау сұрақтары:
Изопроцесстер орындалуы үшін қандай алғы шарттар орындалуы керек?
Егер «тұрақты температурада» газ көлемін өте жылдам өзгертетін болсақ, изотермиялық процесс орындала ма?
Изотермалар қандай қисықпен сипатталады?
Қалыпты жағдайдағы газдың 1 молінің көлемі қандай?
Лошмидт саны қалай анықталады?
Қандай қысымды парциал қысым деп атайды?
