
- •1. Температура
- •§1. Температура және термодинамикалық тепе-теңдік
- •§2 Термоскоп және температуралық нүктелер
- •§3 Температура шкалалары
- •2. Идеал газдың молекула-кинетикалық теориясы
- •§4.Идеал газ
- •§5. Газ қысымы. Молекула-кинетикалық теорияның негізгі теңдеуі
- •§6. Идеал газ күйінің теңдеуі
- •§7. Идеал газ заңдары
- •§8. Орташа квадраттық жылдамдық
- •Бақылау сұрақтары:
- •§9. Барометрлік формула
- •Бақылау сұрақтары:
- •§10. Больцман таралуы
- •§11. Ықтималдықтар теориясынан қысқаша түсінік
- •§12. Кездейсоқ шаманың орташа мәні. Ықтималдықтардың таралу функциясы
- •§13. Жүйенің макроскопиялық және микроскопиялық күйлері
- •§14. Макрокүйдің ықтималдығы
- •§15. Канондық ансамбль. Гиббс таралуы
- •§16. Газ молекулаларының жылдамдықтары бойыншатаралуының Максвелл заңы
- •§17. Молекулалардың жылдамдықтың абсолюттік мәні бойынша таралуы. Молекулалардың орташа жылдамдықтары
- •§18. Перрен тәжірибесі
- •3. Термодинамиканың бірінші бастамасы
- •§19. Квазистатикалық процестер
- •§20. Макроскопиялық жұмыс
- •§21. Термодинамиканың бірінші бастамасы
- •§22. Ішкі энергия
- •§23. Жылу мөлшері
- •§24. Жылусыйымдылық
- •§25. Идеал газдың ішкі энергиясы. Джоуль заңы
- •§26. Адиабаттық процесс. Пуассон теңдеуі
- •§27. Газ көлемінің адиабаталық өзгерісі кезіндегі жұмыс
- •§28. Политроптық процесс
- •§29. Клеман және Дезорм әдісімен қатынасын анықтау*
- •§30. Газдардағы дыбыс жылдамдығы*
- •§31. Бернулли теңдеуі*
- •§32. Жіңішке саңлаудан шыққан газдың жылдамдығы
- •4.Термодинамиканың екінші бастамасы
- •§33. Қайтымды және қайтымсыз процестер
- •§34. Термодинамиканың екінші бастамасының әр түрлі тұжырымдамалары
- •§35. Карно циклі
- •§36. Температураның термодинамикалық шкаласы
- •§37 Клаузиус теңсіздігі. Энтропия
- •§38. Энтропияның өсу заңы
- •§39. Газдардың диффузиясы кезінде энтропияның өсуі. Гиббс парадоксі
- •§40.Термодинамикалық потенциалдар
- •§41. Энтропияның физикалық мәні. Энтропия және ықтималдылық
- •§42. Нернст теоремасы
- •§43. Термодинамикалық тепе теңдік шарттары
- •Газдардағы тасымалдау құбылыстары
- •§44. Еркін жүрудің орташа жолы
- •Нақты газдар
- •§47 Беттік керілу
- •§48Шектік бұрыштар. Жұғу және жұқпау
- •§49. Сұйықтың майысқан бетінің екі жағындағы қысымдар айырымы. Лаплас формуласы
- •§50. Фазалар және фазалық түрленулер
§23. Жылу мөлшері
1.Жылу мөлшері, жылу алмасу.Егер жүйе адиабаттық қоршауда болса, онда жүйенің ішкі энергиясын оның үстінен макроскопиялық жұмыс атқару арқылы ғана өзгертуге болады. Алайда, жүйе адиабаттық қоршауда болмаса, онда оның ішкі энергиясын әртүрлі жолдармен макроскопиялық жұмыс атқармай-ақ өзгертуге болады. Мысалы, ыстық дене мен суық денені бір-бірімен жанастырғанда макроскопиялық жұмыс атқарылмаса да ішкі энергия ыстық денеден суық денеге өтеді.
Бір-бірімен жанастырылған денелердің макроскопиялық жұмыс атқармай өтетін ішкі энергиямен алмасу процесі жылу алмасу деп аталады. Жылу алмасу процесі нәтижесінде сыртқы ортаның денеге берген энергиясы дененің алған жылу мөлшері немесе жылу деп аталады.
2.Жылу
мөлшері күй функциясы емес.Дененің
алған жылу мөлшері күй функциясы емес.
Мұны термодинамиканың бірінші
бастамасынан-ақ көруге болады. Шынында
да
 айырымы тек қана жүйенің бастапқы және
соңғы күйлеріне тәуелді, ал
айырымы тек қана жүйенің бастапқы және
соңғы күйлеріне тәуелді, ал
 жұмыс
бір күйден екінші күйге өту жолына да
тәуелді. Сондықтан
жұмыс
бір күйден екінші күйге өту жолына да
тәуелді. Сондықтан
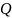 жылу мөлшері осы өту жолына, демек жүйе
қарастырылып отырған күйге қандай
әдіспен келгеніне тәуелді. Бұдан жылу
мөлшері де күй функциясы емес деген
қорытынды жасауға болады. Жүйені
қарастырылатын күйге көптеген әдістермен,
жолдармен өткізуге болады. Осы барлық
әдістерде жүйеге бірдей ішкі энергия
беріледі, бірақ осы берілген энергия
шамасын жұмыс пен денеге берілген жылу
мөлшеріне бөлу әр жағдайда әртүрлі
болады. Егер жүйенің орныққан күйі
белгілі болса, ал осы күйге жүйенің
қандай әдіспен (жолмен) келгені белгісіз
болса, онда жүйенің алған жылу мөлшері
туралы ештеңе айту мүмкін емес. Бірақ
барлық уақытта жүйенің ішкі энергиясы
туралы айтуға болады, себебі ол жүйенің
сол күйге қалай келгеніне тәуелді емес.
Ал, жүйенің алған жылу мөлшері туралы
тек процесс түрі көрсетілгенде ғана
айтуға болады.
жылу мөлшері осы өту жолына, демек жүйе
қарастырылып отырған күйге қандай
әдіспен келгеніне тәуелді. Бұдан жылу
мөлшері де күй функциясы емес деген
қорытынды жасауға болады. Жүйені
қарастырылатын күйге көптеген әдістермен,
жолдармен өткізуге болады. Осы барлық
әдістерде жүйеге бірдей ішкі энергия
беріледі, бірақ осы берілген энергия
шамасын жұмыс пен денеге берілген жылу
мөлшеріне бөлу әр жағдайда әртүрлі
болады. Егер жүйенің орныққан күйі
белгілі болса, ал осы күйге жүйенің
қандай әдіспен (жолмен) келгені белгісіз
болса, онда жүйенің алған жылу мөлшері
туралы ештеңе айту мүмкін емес. Бірақ
барлық уақытта жүйенің ішкі энергиясы
туралы айтуға болады, себебі ол жүйенің
сол күйге қалай келгеніне тәуелді емес.
Ал, жүйенің алған жылу мөлшері туралы
тек процесс түрі көрсетілгенде ғана
айтуға болады.
3.Жылу резервуары.Жылулық энергия термині өте көп таралған. Бірақ бұл ұғымды жылу мөлшері мағынасында қолдануға болмайды. Жылулық энергия түсінігін дененің ішкі энергиясы деп түсінген дұрыс. Жылулық (ішкі) энергиясының қоры бар денелер жылу резервуары деп аталады. Жылу резервуарында жылу қоры бар деп те айтылады. Мұнда да жылу қоры дегенді ішкі энергия қоры деп түсінген дұрыс.
4. Энтальпия – жылу функциясы. Енді тұрақты көлем немесе тұрақты қысым кезінде жүйеде өтетін құбылыстарды қарастырайық. Егер көлем тұрақты болса, онда жұмысы нөлге тең болады, онда термодинамиканың бірінші бастамасы мына түрге келеді:
 (23.1)
(23.1)
Егер
қысым тұрақты болса, онда
 .
Бұл жағдайда термодинамиканың бірінші
бастамасын мына түрде жаза аламыз:
.
Бұл жағдайда термодинамиканың бірінші
бастамасын мына түрде жаза аламыз:
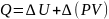
немесе дифференциалдық түрде былай жазамыз:

Енді жаңа шама енгіземіз:
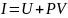 (23.2)
(23.2)
Бұл
шама күй функциясы болып табылады,
себебі оны анықтайтын
,
 шамалары да күй функциялары. Жаңа
функцияны ескерсек, изобаралық процесс
үшін жүйенің алған жылу мөлшерін былай
көрсетуге болады:
шамалары да күй функциялары. Жаңа
функцияны ескерсек, изобаралық процесс
үшін жүйенің алған жылу мөлшерін былай
көрсетуге болады:
 ,
(23.3)
,
(23.3)
 функциясының
термодинамикадағы орыны маңызды. Оны
энтальпия
немесе жылулық
функция
деп атайды. Энтальпия изобаралық процесте
өсімшесі жүйенің алған жылу мөлшеріне
тең күй функциясы болып табылады.
функциясының
термодинамикадағы орыны маңызды. Оны
энтальпия
немесе жылулық
функция
деп атайды. Энтальпия изобаралық процесте
өсімшесі жүйенің алған жылу мөлшеріне
тең күй функциясы болып табылады.
Сонымен, егер жүйенің көлемі тұрақты болса, онда жүйенің алған жылу мөлшері ішкі энергияның өсімшесіне, ал қысымы тұрақты болғанда – энтальпияның өсімшесіне тең болады екен.
5. Гесс
заңы.
Термохимияда реакцияның
жылулық тиімділігі
деп сол реакция кезінде бөлінген жылу
мөлшерін айтады. Егер реакция нәтижесінде
қандай да бір жаңа қосылыс түзілсе, онда
жылулық тиімділік түзілу жылуы деп те
атайды. Егер реакция кезінде жылу
бөлінетін болса мұндай реакция
экзотермиялық
деп аталады, ал жылу жұтылса – эндотермиялық
деп аталады. Бірінші жағдайда жылулық
тиімділік оң деп есептеледі, ал екіншіде
– теріс. Егер жылулық тиімділікті
 әрпімен
белгілесек, онда
әрпімен
белгілесек, онда
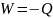 болады.
Егер реакция тұрақты көлемде өтсе:
болады.
Егер реакция тұрақты көлемде өтсе:
 (23.4)
(23.4)
Сәйкесінше, реакция тұрақты қысымда өтсе, онда
 (23.5)
(23.5)
(23.4) және (23.5) өрнектер реакцияның жылулық тиімділігі тек қана бастапқы заттардың табиғатына және физикалық күйіне тәуелді екені, ал реакцияның аралық сатыларына тәуелсіз екендігін көрсетеді. Бұл заңды 1840 жылы орыс академигі Гесс (1802-1850) термодинамиканың бірінші бастамасынан бұрын ашқан болатын.
Бақылау сұрақтары:
Қандай процесті жылу алмасу процесі деп атайды?
Жылу алмасу процесі кезінде бір денеден екінші денеге өтетін энергияны қалай атайды?
Жылу мөлшері күй функциясы ма?
Қандай денелер жылу резервуары деп аталады?
Энтальпия қалай анықталады?
Гесс заңын түсіндіріңіз.
