
- •3.Напишите линейную формулу д-галактозы и α- и β- формы д-галактопиранозы (формулами Хеуорса). Объясните, с какими видами изомерии связано их существование.
- •4. Напишите линейную формулу д-фруктозы и α- и β- формы d-фрукто-фуранозы. Объясните, с какими видами изомерии связано их существование.
- •4. Напишите строение дипептида Глу-Ала. Укажите пептидную связь. В какой области рН (кислой, щелочной или нейтральной) находится иэт данного дипептида
- •5. Напишите схему реакции трансаминирования аланина со щавелевоуксусной кислотой /щук/. Значение реакции трансаминирования.
- •9.Нуклеозидполифосфаты. Строение атф. Биороль атф.
- •1.Липиды. Определение и классификация. Структурные компоненты липидов
- •14.Что такое холестерин? Какова его химическая структура? к каким заболеваниям приводит чрезмерное накопление холестерина в организме?
1.Дайте определение углеводам и приведите основные принципы их классификации. Охарактеризуйте значение углеводов для жизнедеятельности живых организмов.Стереоизомерия моносахаридов. На примере глюкозы изобразите пару энантиомеров глюкозы. Какой атом будет определять принадлежность к L- или Д-ряду? Углеводы – класс природных органических веществ, являющихся гетерофункциональными соединениями, содержащими одновременно карбонильную и гидроксильные функциональные группы (т.е. это многоатомные альдегидо- или кето-спирты или продукты их конденсации).
Углеводы образуются в растениях в результате фотосинтеза из углекислого газа и воды. Животные организмы не способны синтезировать углеводы, и получают их с растительной пищей. Таким образом, углеводы входят в состав всех живых организмов и являются одними из самых распространённых органических веществ на Земле. Функции углеводов:
– структурная
и опорная функции (целлюлоза является
основным структурным компонентом
клеточных стенок растений, хитин
выполняет аналогичную функцию у грибов,
а также обеспечивает жёсткость
экзоскелета членистоногих);защитная
роль (у некоторых растений есть защитные
образования: шипы, колючки и др., состоящие
из клеточных стенок мёртвых
клеток;энергетическая функция (при
окислении 1 г углеводов выделяются 4,1
ккал энергии);пластическая функция
(входят в состав сложных молекул,
например, рибоза и дезоксирибоза
участвуют в построении АТФ, ДНК и
РНК);запасающая функция (углеводы
выступают в качестве запасных питательных
веществ: гликоген у животных, крахмал
и инулин – у растений);осмотическая
функция (участвуют в регуляции
осмотического давления в организме, в
т.ч. в крови),рецепторная функция (входят
в состав воспринимающей части многих
клеточных рецепторов).
Многие углеводы
и их производные находят применение в
фармации и медицине. Углеводы служат
исходными веществами для промышленного
производства бумаги, искусственных
волокон, взрывчатых веществ, этилового
спирта и т.д.
структурная
и опорная функции (целлюлоза является
основным структурным компонентом
клеточных стенок растений, хитин
выполняет аналогичную функцию у грибов,
а также обеспечивает жёсткость
экзоскелета членистоногих);защитная
роль (у некоторых растений есть защитные
образования: шипы, колючки и др., состоящие
из клеточных стенок мёртвых
клеток;энергетическая функция (при
окислении 1 г углеводов выделяются 4,1
ккал энергии);пластическая функция
(входят в состав сложных молекул,
например, рибоза и дезоксирибоза
участвуют в построении АТФ, ДНК и
РНК);запасающая функция (углеводы
выступают в качестве запасных питательных
веществ: гликоген у животных, крахмал
и инулин – у растений);осмотическая
функция (участвуют в регуляции
осмотического давления в организме, в
т.ч. в крови),рецепторная функция (входят
в состав воспринимающей части многих
клеточных рецепторов).
Многие углеводы
и их производные находят применение в
фармации и медицине. Углеводы служат
исходными веществами для промышленного
производства бумаги, искусственных
волокон, взрывчатых веществ, этилового
спирта и т.д.
Характерной особенностью структуры моносахаридов является наличие в молекулах асимметрических (т.е. имеющих четыре различных заместителя) атомов углерода. Асимметрические атомы углерода представляют собой центры хиральности молекулы. Следствие хиральности молекулы – явление оптической изомерии, или энантиомерии, которое выражается в способности соединения вращать плоскость поляризованного света в противоположные стороны. Соединение с асимметрическими атомами углерода может существовать в виде 2 изомеров.
Оптические изомеры, относящиеся друг к другу как несимметричный предмет к своему зеркальному отображению, называют энантиомерами, или оптическими антиподами. Энантиомеры отличаются друг от друга конфигурацией всех центров хиральности и образуют D-форму (лат.Dexter — правый) и L-форму (лат. laevus — левый) — стереохимические ряды моносахаридов. Изомеры, отличающиеся конфигурацией только части центров хиральности и не являющиеся оптическими антиподами, называют диастереомерами. Пару диастереомеров, отличающихся конфигурацией только одного асимметрического атома углерода, называют эпимерами. Обычно к названию добавляют номер эпимерного атома углерода, 2-эпимеры называют просто эпимерами. Например, D-аллоза и D-альтроза – эпимеры, D-аллоза и D-глюкоза – 3-эпимеры, D-аллоза и D-гулоза – 4-эпимеры.
В качестве стандарта для определения принадлежности соединения к стереохимическому D- или L-ряду принята конфигурация асимметрического атома в простейшей триозе — D-глицериновом альдегиде. Принадлежность соединения стереохимическому ряду определяет конфигурация асимметрического атома углерода с наибольшим номером (в случае глюкозы — атома С5). Если она совпадает с конфигурацией асимметрического атома углерода D-глицеринового альдегида, то соединение относят к D-ряду, если не совпадает — к L-ряду. Установлено, что все природные монозы относятся к D-ряду.

 Углеводы
подразделяются на два класса: простые
и сложные. Простые углеводы (моносахариды,
монозы) не гидролизуются с образованием
более простых углеводов. Примерами
простых углеводов могут служить: глюкоза
(С6Н12О6),
рибоза (С5Н10О5),
фруктоза (С6Н12О6).
Углеводы
подразделяются на два класса: простые
и сложные. Простые углеводы (моносахариды,
монозы) не гидролизуются с образованием
более простых углеводов. Примерами
простых углеводов могут служить: глюкоза
(С6Н12О6),
рибоза (С5Н10О5),
фруктоза (С6Н12О6).
Простые углеводы, содержащие кетогруппу, называются кетозами, альдегидную группу – альдозами. В зависимости от числа атомов углерода монозы делят на триозы (три атома углерода), тетрозы (четыре атома), пентозы (пять атомов), гексозы (шесть атомов) и гептозы (семь атомов).
Сложные углеводы способны гидролизоваться с образованием молекул простых углеводов. Если при гидролизе сложного углевода образуется от 2 до 10 молекул простых углеводов, то такой сложный углевод называется олигосахаридом. Если при гидролизе олигосахарида образуется две молекулы простых углеводов, то его называют дисахаридом, три – трисахаридом и т.д. Самыми распространёнными дисахаридами являются сахароза (при гидролизе образуются фруктоза и глюкоза), мальтоза и целлобиоза (при их гидролизе образуются две молекулы глюкозы), лактоза (при гидролизе образуются галактоза и глюкоза).
Углеводы, гидролизующиеся с образованием большого количества (до нескольких тысяч) молекул простых углеводов, называются полисахаридами. Полисахариды являются высокомолекулярными соединениями. К ним относятся, например, крахмал и целлюлоза (клетчатка). Сложные углеводы можно рассматривать, как продукты поликонденсации моносахаридов.
Если полисахариды построены из остатков одного моносахарида, то их называют гомополисахаридами; если из остатков разных моносахаридов, то – гетерополисахаридами.
Среди гомополисахаридов наиболее биологически важными являются крахмал, гликоген, целлюлоза, среди гетерополисахаридов – альгиновые кислоты, агар (содержащиеся в водорослях); полисахариды соединительной ткани (хондроитинсульфаты, гиалуроновая кислота, гепарин).
Молекулы углеводов входят в состав смешанных биополимеров, например углевод-белковых биополимеров (гликопротеины, протеогликаны) или углевод-липидных (гликолипиды).
2. Как образуются циклические формы моносахаридов? Чем отличаются формулы Фишера и формулы Хеуорса? Ответ подтвердите, используя формулы глюкозы (- и - формы Д-глюкопиранозы) её 6-фосфата. Объясните явление мутаротации.
Циклические формы моносахаридов образуются в результате внутримолекулярного взаимодействия между карбоксильной и гидроксильной группами. Эти формы термодинамически более устойчивы, чем открытые формы молекул углеводов. Обычно возникают пятичленные (фуранозные) и шестичленные (пиранозные) циклы. В пространстве оказываются сближенными альдегидные (или кетонные) группы и гидроксильная группа при четвёртом или пятом (для альдоз) и пятом и шестом (для кетоз) атоме углерода. За счёт их взаимодействия и происходит замыкание циклов в молекулах моносахаридов.Шестичленныйпиранозный цикл образуется при взаимодействии альдегидной группы с пятым атомом альдопентоз или альдогексоз; а также при взаимодействии кетогруппы с шестым атомом кетогексоз.
так образуется, ее можно не писать, но чтоб вы поняли как проходит этот процесс я оставила….
 а
вот гюкопираноза
а
вот гюкопираноза
Пятичленный фуранозный цикл образуется при взаимодействии альдегидной группы с четвёртым атомом альдотетроз, альдопентоз и альдогексоз; а также при взаимодействии кетогруппы с пятым атомом кетопентоз и кетогексоз.
|
|
|
|


 В
системе Хеуорса циклы изображают в
виде плоских пяти- или шестиугльников,
расположенных перпендикулярно плоскости
рисунка, поэтому линии, соответствующие
передней части кольца выделяют более
жирным шрифтом. Атом кислорода
располагается в пиранозном цикле в
дальнем правом углу, в фуранозном –
также в дальнем правом углу или в
середине задней части кольца. Гидроксильные
группы и атомы водорода располагают
перпендикулярно плоскости цикла.
Символы атомов углерода в циклах обычно
не пишутся.
В
системе Хеуорса циклы изображают в
виде плоских пяти- или шестиугльников,
расположенных перпендикулярно плоскости
рисунка, поэтому линии, соответствующие
передней части кольца выделяют более
жирным шрифтом. Атом кислорода
располагается в пиранозном цикле в
дальнем правом углу, в фуранозном –
также в дальнем правом углу или в
середине задней части кольца. Гидроксильные
группы и атомы водорода располагают
перпендикулярно плоскости цикла.
Символы атомов углерода в циклах обычно
не пишутся.
Чтобы написать формулу Хеуорса вначале изображают формулу Фишера и поворачивают её на 90о вправо (по часовой стрелке) В формулах Фишера углеродная цепь записывается вертикально и нумеруется с того конца, к которому ближе альдегидная или кетогруппа, т.е. с верхнего углеродного атома. Асимметричные углеродные атомы символом «С» не обозначаются, подразумевается, что они находятся на пересечении вертикальных и горизонтальных линий.
 Молекула
кетопентозы содержит 2 асимметрических
атома углерода (третий и четвёртый) и
образует 2 пары энантиомеров:
Молекула
кетопентозы содержит 2 асимметрических
атома углерода (третий и четвёртый) и
образует 2 пары энантиомеров:
3.Напишите линейную формулу д-галактозы и α- и β- формы д-галактопиранозы (формулами Хеуорса). Объясните, с какими видами изомерии связано их существование.
4. Напишите линейную формулу д-фруктозы и α- и β- формы d-фрукто-фуранозы. Объясните, с какими видами изомерии связано их существование.
5.
Напишите формулы Dи
L-рибозы
(проекциям Фишера). Укажите, какой атом
будет определять их относительную
конфигурацию. Какой из этих энантиомеров
характерен для живых организмов?
Составьте формулы α- и β-
аномеровD-рибофуранозы
(формулами Хеуорса). по
ОН в живых д-рибоза
по
ОН в живых д-рибоза

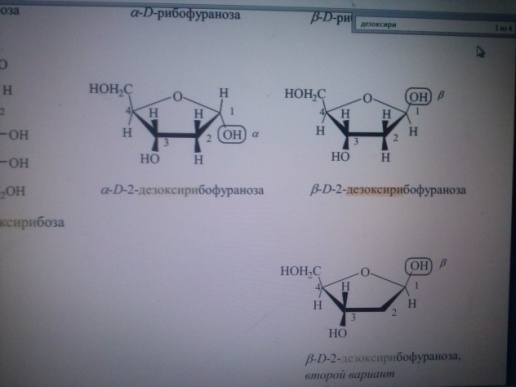
Напишите
линейную формулу Д –дезоксирибозы, а
также составьте формулы
α-D-дезоксирибофуранозы
и β-D-дезоксирибофуранозы(используя
формулы Хеуорса).

4. Химические свойства моносахаридов. Напишите схему реакции окисления глюкозы гидроксидом меди (реакция Троммера). С какой целью она используется в биохимических исследованиях? Назовите полученные продукты и признаки реакции. Укажите возможные недостатки реакции Напишите реакцию восстановления глюкозы, укажите продукт реакции. С какой целью применяют его в медицине?
В соответствии с химическим строением моносахариды могут проявлять свойства карбонильных соединений (альдегидов и кетонов), спиртов и полуацеталей.
Реакции карбонильных форм моносахаридов
а) Окисление. Монозы легко окисляются, причем в зависимости от условий окисления образуются различные продукты.
Подобно обычным альдегидам, альдозы легко дают реакцию “серебряного зеркала” с аммиачным раствором оксида серебра (реактив Толленса):
б) Восстановление. При восстановлении моноз образуются многоатомные спирты, называемые альдитами (глицитами). Эти кристаллические, легко растворимые в воде вещества обладают сладким вкусом и часто используются как заменители сахара (ксилит, сорбит).
Реакции с участием гидроксильных групп
Гидроксильные группы имеются в открытых и циклических формах моноз, но содержание циклических форм значительно выше, поэтому реакции идут в циклических (полуацетальных ) формах:
Реакции с участием гликозидного гидроксила
При взаимодействии моносахаридов с гидроксилсодержащими соединениями (спиртами, фенолами и др.) в условиях кислотного катализа образуются производные только по гликозиднойОН-группе - циклические ацетали, называемые гликозидами. Cпиртовые гидроксилы моноз в этих условиях не реагируют
Действие кислот
Действие кислот на пентозы и гексозы может быть использовано для их распознования, а именно: при нагревании пентоз с разбавленными кислотами легко происходит их дегидратация (отщепление трех молекул воды ) и образуется летучий гетероциклический альдегид - фурфурол:
Брожение сахаров
Брожение - это сложный процесс расщепления моносахаридов с выделением СО2 под действием ферментов. Брожению подвергаются сахара, у которых число атомов углерода кратно трем (гексозы).
Образование дисахаридов, полисахаридов
Гликозидная связь имеет очень важное биологическое значение. С помощью этой связи осуществляется ковалентное связывание моносахаридов в составе олиго- и полисахаридов:
Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому она относится к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение Нагреем раствор. В этих условиях реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
2HOСН2-(СНOH)4)-СН=O + Cu(OH)2 2HOСН2-(СНOH)4)-СOOH + Cu2O↓ + 2H2O (( так вроде Для определения глюкозы в биологических жидкостях.
5.Восстанавливающие дисахариды: мальтоза, лактоза: строение и гидролиз. Объясните способность к цикло-оксо-таутомерии. Укажите биологическую роль, медико -биологическое.Мальтоза– резервный олигосахарид –обнаружена во многих растениях в небольших количествах, в больших количествах накапливается в солоде – обычно в семенах ячменя, проросших в определенных условиях. Поэтому мальтозу часто называют солодовым сахаром. Мальтоза образуется в растительных и животных организмах в результате гидролиза крахмала под действием амилаз.
Мальтоза содержит два остатка Д-глюкопиранозы, соединенных между собой a(1®4)гликозидной связью.
 Мальтоза
– это восстанавливающий
дисахарид. Она способна к таутомерии
и имеет - и -аномеры Она легко
растворима в воде. Раствор обнаруживает
мутаротацию.Под действием фермента
a-глюкозидазы (мальтазы) солодовый сахар
гидролизуется с образованием двух
молекул глюкозы:
Мальтоза
– это восстанавливающий
дисахарид. Она способна к таутомерии
и имеет - и -аномеры Она легко
растворима в воде. Раствор обнаруживает
мутаротацию.Под действием фермента
a-глюкозидазы (мальтазы) солодовый сахар
гидролизуется с образованием двух
молекул глюкозы:
 Лактоза.
построена из остатковb-Д-галактопиранозы
и a-Д-глюкопиранозы, соединенных между
собой b-(1→4)-гликозидной связью. Лактоза
является восстанавливающим дисахаридом,
причем свободный полуацетальный
гидроксил принадлежит остатку глюкозы,
а кислородный мостик связывает первый
углеродный атом остатка галактозы с
четвертым атомом углерода остатка
глюкозы.
Лактоза.
построена из остатковb-Д-галактопиранозы
и a-Д-глюкопиранозы, соединенных между
собой b-(1→4)-гликозидной связью. Лактоза
является восстанавливающим дисахаридом,
причем свободный полуацетальный
гидроксил принадлежит остатку глюкозы,
а кислородный мостик связывает первый
углеродный атом остатка галактозы с
четвертым атомом углерода остатка
глюкозы.
 Лактоза
гидролизуется под действием фермента
b-галактозидазы(лактазы):
Лактоза
гидролизуется под действием фермента
b-галактозидазы(лактазы):
 Лактоза
отличается от других сахаров отсутствием
гигроскопичности – она не отсыревает.Молочный
сахар применяется как фармацевтический
препарат и как питательное средство
для грудных детей. Водные растворы
лактозы мутаротируют, лактоза имеет в
4-5 раз менее сладкий вкус, чем
сахароза.Биологическая
рольДисахариды
(сахароза,мальтоза)служат
источниками глюкозы
для организма человека, сахароза к тому
же важнейший источник углеводов (она
составляет 99,4%, от всех получаемых
организмом углеводов), лактоза
используются для диетического детского
питания. Дисахарид целлобиоза
имеет важное значение для жизни растений,
так как она входит в состав целлюлозы.
Лактоза
отличается от других сахаров отсутствием
гигроскопичности – она не отсыревает.Молочный
сахар применяется как фармацевтический
препарат и как питательное средство
для грудных детей. Водные растворы
лактозы мутаротируют, лактоза имеет в
4-5 раз менее сладкий вкус, чем
сахароза.Биологическая
рольДисахариды
(сахароза,мальтоза)служат
источниками глюкозы
для организма человека, сахароза к тому
же важнейший источник углеводов (она
составляет 99,4%, от всех получаемых
организмом углеводов), лактоза
используются для диетического детского
питания. Дисахарид целлобиоза
имеет важное значение для жизни растений,
так как она входит в состав целлюлозы.
6Невосстанавливающие дисахариды: сахароза. Строение сахарозы и её гидролиз. Назовите продукты гидролиза. Роль сахарозы в жизнедеятельности. Сахароза состоит из остатков глюкозы и фруктозы, соединенных 1,2-гликозидной связью. У сахарозы полуацетальные гидроксильные группы обеих молекул моносахаридов участвуют в образовании гликозидной связи, вследствие чего сахароза является невосстанавливающим сахаром.
 сахароза
гидролизуется с образованием смеси
равных количеств глюкозы и фруктозы,
которая называется инвертным сахаром.
сахароза
гидролизуется с образованием смеси
равных количеств глюкозы и фруктозы,
которая называется инвертным сахаром.
 В
больших количествах встречается только
в ограниченном количестве растительных
видов - в сахарном тростнике и в сахарной
свекле, из которых С. и добывается
техническим путем. Богаты им еще стебли
некоторых злаков, особенно в период,
предшествующий наливанию зерна, как
напр. маиса, сахарного сорго и др
В
больших количествах встречается только
в ограниченном количестве растительных
видов - в сахарном тростнике и в сахарной
свекле, из которых С. и добывается
техническим путем. Богаты им еще стебли
некоторых злаков, особенно в период,
предшествующий наливанию зерна, как
напр. маиса, сахарного сорго и др
7Назовите фракции крахмала, изобразите схематично их пространственное строение. Укажите типы….Полисахариды, составляющие крахмал, подразделяются на две фракции - амилозу и амилопектин.В амилозную фракцию входят молекулы с линейной структурой; различаются молекулы по длине.Амилопектиновая фракция включает полисахариды с молекулярной массой порядка 5-108, структура которых мало изучена.
Схема строения крахмального зерна (по Мюлеталеру):а — амилоза; б — амилопектин; в —расположение молекул амилозы и амилопектина в слое крахмального зерна
 Основной
повторяющейся единицей, из которой
синтезируется крахмал, являются остатки
D-глюкозы,
последовательно соединенные между
собой ά-1,4-
и ά-1,6- глюкозидными связями.Гидролиз
КРАХМАЛА ступенчатый. Протекает при
нагревании в кислой среде. В пищеварительном
тракте гидролизуется под действием
ферментов.
Крахмал → растворимый
крахмал (амилоза) → олигосахариды
(декстрины) → дисахарид (мальтоза =
солод) → α-глюкоза.
(С6Н10О5)n + nН2О →
nС6Н12О6 В процессе гидролиза исчезает
цветная окраска с йодом, но постепенно
появляется положительная качественная
реакция с реактивом Фелинга на
редуцирующие сахара ( мальтоза и глюкоза)
Основной
повторяющейся единицей, из которой
синтезируется крахмал, являются остатки
D-глюкозы,
последовательно соединенные между
собой ά-1,4-
и ά-1,6- глюкозидными связями.Гидролиз
КРАХМАЛА ступенчатый. Протекает при
нагревании в кислой среде. В пищеварительном
тракте гидролизуется под действием
ферментов.
Крахмал → растворимый
крахмал (амилоза) → олигосахариды
(декстрины) → дисахарид (мальтоза =
солод) → α-глюкоза.
(С6Н10О5)n + nН2О →
nС6Н12О6 В процессе гидролиза исчезает
цветная окраска с йодом, но постепенно
появляется положительная качественная
реакция с реактивом Фелинга на
редуцирующие сахара ( мальтоза и глюкоза)
8.Укажите отличительные признаки гликогена и крахмала? Напишите строение биозного фрагмента основной цепи гликогена и покажите образование бокового ответвления. Охарактеризуйте биороль гликогена.Гликоген - разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. За счет этого образ.ответвления от основной цепи.
Гликоген широко распространён в организмах животных и представляет собой резервное вещество, важное для энергетики организма и легко расщепляющееся с образованием глюкозы, а также при гликолизе с образованием молочной кислоты.
Наиболее богаты гликогеном печень (до 20% сырого веса) и мышцы (до 4%), очень богаты некоторые моллюски (в устрицах до 14% сухого веса), дрожжи и высшие грибы. К гликогену близки крахмалы некоторых видов кукурузы.
1.Дайте определение аминокислотам. С использованием примеров классифицируйте аминокислоты по расположению…..Аминокислоты – гетерофункциональные соединения, которые о содержат две функциональные группы: аминогруппу – NH2 и карбоксильную группу –COOH, связанные с углеводородным радикалом. В зависимости от расположения аминогруппы относительно карбоксила различают α, β, γ и т. д. Аминокислоты протеиногенные (входящие в состав белков) Среди них выделяют главные (их всего 20) и редкие. Редкие белковые аминокислоты (например,гидроксипролин,,гидроксилизин, аминолимонная кислота и др.) на самом деле являются производными тех же 20 аминокислот. Остальные аминокислоты не участвуют в построении белков; они находятся в клетке либо в свободном виде), либо входят в состав других небелковых соединений. Например, аминокислоты орнитин и цитруллин являются промежуточными продуктами в образовании протеиногенной аминокислоты аргинина и участвуют в цикле синтеза мочевины; γ-амино-масляная кислота тоже находится в свободном виде и играет роль медиатора в передаче нервных импульсов; β-аланин входит в состав витамина — пантотеновой кислоты. К незаменимым отн.валин лейцин изолейцин триптофан треонин лизин метилонин фенилаланинНезаменимые аминокислотыДолжны поступать в организм вместе с пищей, так как самостоятельно человек их вырабатывать не способен.
2.Используя примеры,приведите классиф.аминокислот по количеству амино- и карб.групп классиф.на моноаминомонокарбоновые моноаминодикарбоновые диаминомонокарбоновые.Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой.Значение рI в общем случае вычисляется по формуле pI = ½(pKa(n) + pKa(n+1)) где n — максимальное число положительных зарядов в полностью протонированной аминокислоте. В изоэлектрической точке суммарный заряд молекулы аминокислоты равен 0.
3.Стереоизомерия α-аминокислот. Напишите пары энантиомеров аланина и валина, фенилаланина и серина. Какой из атомов определяет принадлежность к L- или Д-ряду? Какие из них входят в состав природных белков
Все природные a-аминокислоты (кроме глицина) являются хиральными соединениями. По конфигурации хирального центра в положении 2 аминокислоты относят D- или L-ряду.
аланин,

валин(только
переверните также как и аланин)
фенилаланин ,
,
 серин.
серин.
В состав природных белков входят: валин, фенилаланин(незаменимые), аланин и серин(заменимые)

