
- •Первый закон термодинамики. Работа, внутренняя энергия. Энтальпия, располагаемая работа.
- •Уравнения состояния идеального газа. Определение его параметров.
- •3.Теплоемкость. Ее виды. Связь между теплоемкостями. Закон Майера. Средние и истинные теплоемкости. Теплоемкость смеси газов.
- •Термодинамические процессы и их уравнения. Уравнения для вычисления работы процесса. Обратимые и необратимые процессы.
- •Термический кпд циклов Отто, смешанного сгорания Тринклера (Сабатэ), Дизеля. Их сравнение.
- •Цикл Брайтона, его термический кпд. Циклы газотурбинных установок и реактивных двигателей.
- •Второй закон термодинамики. Цикл Карно. Энтропия.
- •Основные параметры водяного пара. Влажный, сухой перегретый пар. Критические давление и температура.
- •Схемы паротурбинных установок. Цикл Ренкина.
- •Промежуточный перегрев пара. Схемы циклов с регенеративным отбором пара.
- •Циклы парогазовых установок. Пгу с высоконапорным парогенератором.
- •Циклы пгу с котлом-утилизатором, с подводом пара в газовую турбину.
- •6.Термодинамические циклы и термический кпд.
- •19.Холодильные установки.
- •20.Теплонасосные установки. Рабочие тела для холодильных машин и тепловых насосов.
- •21.Теорема Бернулли для газов.
- •23.Основное уравнение Эйлера для турбомашин.
- •24.Теорема Жуковского о подъемной силе крыла. Механизм образования подъемной силы.
- •27. Сопло Лаваля.
- •28.Понятие пограничного слоя. Основное допущение пограничного слоя.
- •29.Критерии газодинамического подобия течений.
- •Топливно-энергетические ресурсы. Первичные энергоресурсы. Вторичные энергоресурсы. Возобновляемые и невозобновляемые источники энергии.
- •Физическая природа профильных потерь в лопаточном аппарате и методы снижения профильных потерь.
- •44.Причина возникновения неустойчивого режима работы (помпажа) компрессора.
- •48.Для чего и в каких ступенях паровой турбины осуществляют парциальный подвод рабочего тела.
- •61.Силы, действующие на рабочие лопатки турбин.
- •65.Напряжения в дисках турбин. Влияние отверстия в диске на его прочность.
- •Что такое критическая частота вращения вала?
- •Принципиальная схема пту, ее основные элементы.
- •Конденсационная установка пту, назначение, эксплуатационные характеристики.
- •71. Основные показатели экономичности установок с паровыми и газовыми турбинами.
- •Способы повышения экономичности гту.
- •Парогазовые установки, основные их типы.
- •Аэс. Основные схемы.
- •Тепловой баланс пту.
- •Влияние климатических условий на мощность гту.
- •Парогазовые установки с котлом-утилизатором.
- •Парогазовые установки с впрыском пара (stig).
Первый закон термодинамики. Работа, внутренняя энергия. Энтальпия, располагаемая работа.
Первый закон термодинамики (частный случай изменения энергии).
Энергия не может самопроизвольно возникать и исчезать, а может переходить из одного вида в другой в результате энергетического взаимодействия.
Q = ΔU + A. где ΔU — изменение внутренней энергии, Q — количество теплоты, переданное системе, А — работа внешних сил.
Работа – передача энергии в результате упорядоченного макроскопического движения, а энергия, передаваемая в данном процессе – работа процесса. 1 ккал=4,1868 Дж.
Когда работа совершается термодинамической системой (чаще всего это газ, который совершает работу), то работа совершенная газом при постоянном давлении определяется как: W = p×dV, где W - работа, p - давление, а dV -изменение объема. В случаях, когда давление не является постоянным, работа может быть представлена интегральным образом, как площадь поверхности под кривой в координатах давление, объем, которые представляют происходящий процесс.
Внутренняя энергия системы – часть энергии системы взаимодействующих тел., определяемую внутренними параметрами этой системы тел. ВЭ тела складывается из кинетической энергии хаотического теплового движения атомов и молекул и потенциальной энергии их взаимодействия.
Энтальпия - это "термодинамический потенциал" используемый в химической термодинамике реакций, это функция состояния термодинамической системы, равная внутренней энергии системы и произведению давления системы на объем системы. Это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту.
Энтальпия определяется как:
H = U + PV (Дж), где H = энтальпия, U = внутренняя энергия, P = давление, V = объем системы.
При постоянном давлении изменение энтальпии равно количеству теплоты, подведенной к системе, поэтому энтальпию часто называют тепловой функцией или теплосодержанием. В состоянии термодинамического равновесия энтальпия системы минимальна.
Энтальпия является точно измеряемым параметром, когда определены способы выражения трех других поддающихся точному определению параметров формулы выше.
Располагаемая работа = адиабатическая работа, которую может выполнить машина без учета потерь.
Уравнения состояния идеального газа. Определение его параметров.
Идеальный газ — газ, молекулы которого представляют из себя материальные точки не связанные между собой силами взаимодействия, т. е. находятся в хаотическом движении.
Уравнение состояния идеального газа, полученное Клапейроном в 1834 году для 1 кг газа, имеет вид:PV=RT, где R — газовая постоянная. Уравнение (1) является обобщенной формой известных законов Бойля-Мариотта (1662 г.), Гей-Люссака (1802 г.) и Шарля. Все эти законы являются законами идеального газа:
при T=const - уравнение Бойля-Мариотта:PV=const
при Р = const - закон Гей-Люссака:
V/T=const
при V = const - закон Шарля:
P/T=const.
3.Теплоемкость. Ее виды. Связь между теплоемкостями. Закон Майера. Средние и истинные теплоемкости. Теплоемкость смеси газов.
Теплоемкость
– теплофизическая характеристика,
которая определяет способность тел
отдавать или воспринимать теплоту,
чтобы изменять температуру тела.
Отношение количества теплоты, подведенной
(или отведенной) в данном процессе, к
изменению температуры называется
теплоемкостью тела (системы тел):C=dQ/dT,
где
![]() — элементарное количество теплоты;
— элементарное количество теплоты;
![]() —
элементарное изменение температуры.
—
элементарное изменение температуры.
Теплоемкость численно равна количеству теплоты, которое необходимо подвести к системе, чтобы при заданных условиях повысить ее температуру на 1 градус. Единицей теплоемкости будет Дж/К.
В зависимости от количественной единицы тела, к которому подводится теплота в термодинамике, различают массовую, объемную и мольную теплоемкости.
Массовая теплоемкость — это теплоемкость, отнесенная к единице массы рабочего тела,c=C/m
Единицей измерения массовой теплоемкости является Дж/(кг×К). Массовую теплоемкость называют также удельной теплоемкостью.
Объемная теплоемкость — теплоемкость, отнесенная к единице объема рабочего тела, где и — объем и плотность тела при нормальных физических условиях. C’=c/V=cp. Объемная теплоемкость измеряется в Дж/(м3×К).
Мольная теплоемкость — теплоемкость, отнесенная к количеству рабочего тела (газа) в молях,Cm=C/n, где n — количество газа в молях.
Мольную теплоемкость измеряют в Дж/(моль×К).
Массовая
и мольная теплоемкости связаны следующим
соотношением:![]()
Объемная
теплоемкость газов выражается через
мольную как![]()
Где
![]() м3/моль
— мольный объем газа при нормальных
условиях.
м3/моль
— мольный объем газа при нормальных
условиях.
Уравнение Майера: Ср – Сv = R.
Учитывая, что теплоемкость непостоянна, а зависит от температуры и других термических параметров, различают истинную и среднюю теплоемкости. В частности, если хотят подчеркнуть зависимость теплоёмкости рабочего тела от температуры, то записывают её как C(t), а удельную – как c(t). Обычно под истинной теплоёмкостью понимают отношение элементарного количества теплоты, которое сообщается термодинамической системе в каком-либо процессе к бесконечно малому приращению температуры этой системы, вызванному сообщенной теплотой. Будем считать C(t) истинной теплоёмкостью термодинамической системы при температуре системы равной t1, а c(t) - истинной удельной теплоёмкостью рабочего тела при его температуре равной t2 . Тогда среднюю удельную теплоёмкость рабочего тела при изменении его температуры от t1 до t2 можно определить как
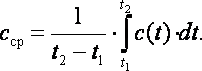
Обычно в таблицах приводятся средние значения теплоемкости cср для различных интервалов температур, начинающихся с t1=00C. Поэтому во всех случаях, когда термодинамический процесс проходит в интервале температур от t1 до t2, в котором t1≠0, количество удельной теплоты q процесса определяется с использованием табличных значений средних теплоемкостей cср следующим образом:
![]()
Значения средних
теплоемкостей
![]() и
и
![]() ,
находят по таблицам.
,
находят по таблицам.
Теплоёмкость смеси рабочих тел (газовой смеси)
Теплоемкость газовой смеси вычисляется по составу газовой смеси и теплоемкостям отдельных газов, входящих в данную газовую смесь. Газовая смесь может быть задана массовым, объемным и молярным составом.
