
Контрольные вопросы по теме «Потенциометрический анализ»
На чем основаны потенциометрические методы анализа?
Какая зависимость выражается уравнением Нернста? Поясните смысл входящих в него величин.
Что представляют собой электроды I и II рода? Приведите примеры этих электродов.
Какие функции выполняют индикаторные электроды и какие – электроды сравнения? Укажите требования, которые к ним предъявляются.
Приведите схему установки для потенциометрических измерений.
В чем сущность потенциометрического определения рН раствора? Какие индикаторные электроды могут быть использованы для определения рН?
Как устроен стеклянный электрод? Как можно определить стандартный потенциал этого электрода? Укажите достоинства и недостатки стеклянного электрода.
Каковы основные типы ионоселективных электродов? Как они устроены? Какие имеют характеристики?
Укажите достоинства, недостатки и области применения метода прямой потенциометрии.
Какие виды потенциометрии используются в анализе и на чем они основаны?
Хронометраж 3-часового занятия:
1.Организационный момент – 5 мин
2. Устный опрос – 30 мин
2. Объяснение нового материала- 40 мин.
3. Выполнение лабораторной работы-50 мин.
4. Письменный тестовый опрос- 15 мин.
5. Задание на дом- 5 мин.
Рекомендуемая литература
1. Дж. Плэмбек Электрохимические методы анализа. Основы теории и применение. М.: Мир, 1985.
2. А. М. Бонд. Полярографические методы в аналитической химии. М.: Химия, 1983.
3. П. К Агасян, Е. Р Николаева Основы электрохимических методов (потенциометрический метод). М.: МГУ, 1986.
4. П. К Агасян, Т. К Хамракулов Кулонометрический анализ. М.: Химия, 1984.
5. К. Камман Работа с ионселективными электродами. М.: Мир, 1980.
6. О. А Сонгина, В. А. Захаров Амперометрическое титрование. М.: Химия, 1979.
7. Г. К Будников, В. Н Майстренко, Вяселев М. Р. Основы современного электроанализа. М.: Химия, 2001.
Тест по теме «Потенциометрический анализ»
1. Воснове потенциометрического метода анализа лежит: |
а) измерение потенциала электродов погружённых в раствор; б) зависимость между составом вещества и его свойствами; в) измерение длины волны. |
2. Для измерения потенциала электродов необходима система: |
а) из 3 электродов; б) из 2 электродов; в) из 4 электродов. |
3. Система для измерения электродного потенциала состоит из: |
а) индикаторный электрод; б) температурный электрод; в) электрод сравнения; г) ртутный электрод. |
4. Индикаторный электрод должен быть: |
а) не чувствителен к ионам, находящимся в растворе; б) чувствителен к ионам, находящимся в растворе. |
5. В качестве электрода сравнения используют: |
а) стеклянный; б) ртутный; б) водородный; в) каломельный. |
6. В электрод сравнения для контакта с ионами, добавляют: |
а) NaOH; б) HgCl; в) KCl |
6. Потенциометрический метод относится: |
а) оптическим методам; б) хроматографическим методам; в) электрохимическим методам. |
7.Значение электродного потенциала при погружении металлической пластинки в раствор соли этого металла зависит от: |
а) величины заряда катиона металла б) величины заряда аниона соли в) активности катиона металла в растворе г) температуры |
8.Уравнение для вычисления ОВ потенциала имеет вид: |
а) |
|
а) (Рt) 2H+H2 б) HРt2, H+ в) H22H+ г) (Рt)H22H+ |
|
а) электродом I рода б) электродом II рода в) электродом сравнения г) электродом определения |
|
а) –0,2005В б) –0,171В в) –0,289В г) –0,2595В |
|
а) Cd- 2ē Cd2+ б) Cd2+ + 2ēCd в) Zn- 2ē Zn2+ г) Zn2++ 2ē Zn |
|
а) ZnZn2+║ Fe2+Fe б) ZnZn2+║ Cu2+ Cu в) CuCu2+║ Ag+Ag г) ZnZn2+║ Ag+Ag |
|
а) – 0,059В б) 0,0295В в) 0,059В г) – 0,0295В
|
|
а) 0,46В б) – 0,46В в) 1,14В г) – 1,14В |

 в)
в) б)
б) 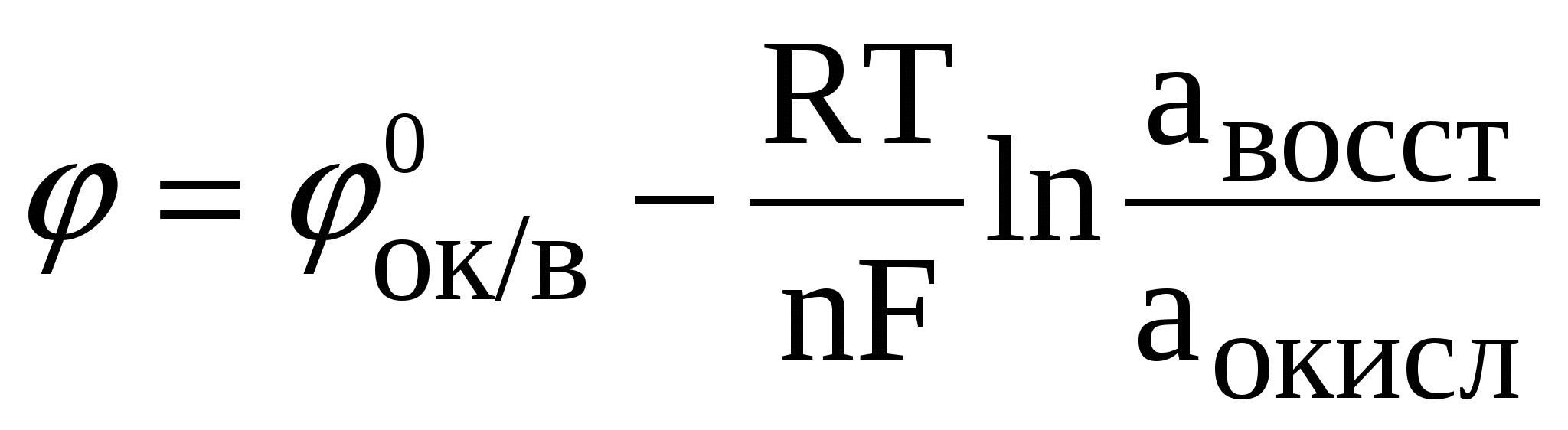 г)
г) 