
- •Глава 1 особенности структуры химического состава зерновых культур, перерабатываемых в пивоварении
- •Тема 2 химический состав ячменя
- •Тема 3 азотистые вещества, витамины и минеральные вещества ячменя и солода
- •Тема 4 полифенольные вещества ячменя и солода
- •Тема 5 Химический состав хмеля
- •Глава4 основные процессы при производстве солода
- •Глава 5 основные процессы при приготовлении пива
- •Глава 6 биологическая стойкость пива
- •Глава 7 коллоидная стойкость пива
- •Глава 8 состав и свойства пива
Глава 5 основные процессы при приготовлении пива
Главная стадия приготовления пивного сусла – затирание зернопродуктов. Целью затирания является перевод из солода и несоложеных материалов в водный раствор растворимых и нерастворимых частей зернопродуктов, составляющих экстракт сусла и пива.
Экстрактивные вещества зернопродуктов переходят в сусло путем преимущественно биохимических процессов, поскольку в ячмене и солоде они находятся в виде высокомолекулярных соединений – биополимеров. При солодоращении в зернах накапливаются гидролитические ферменты, для которых экстрактивные вещества являются субстратами. Биохимические превращения основных биополимеров солода (крахмала и белка) в процессе проращивания ячменя носят поверхностный характер и лишь подготавливают их структуру для ферментативного гидролиза в более благоприятных условиях – при затирании. Растворимые вещества ячменя и солода, в том числе продукты гидролиза при проращивании, при затирании с водой переходят в раствор путем экстрагирования.
ПРИГОТОВЛЕНИЕ ПИВНОГО СУСЛА
Основные биохимические процессы, происходящие при приготовлении пивного сусла – гидролиз крахмала и белков.
ГИДРОЛИЗ КРАХМАЛА
Важнейшим ферментативным процессом при затирании является расщепление крахмала. Весовое соотношение крахмала, расщепленного при солодоращении и при затирании, равно 1:10 и 1:17, тогда как для белков это соотношение – 1:1.
Расщепление крахмала в заторе катализируют амилолитические ферменты солода, а также вносимые ферментные препараты. Под действием α- и β-амилаз солодовый крахмал при затирании гидролизуется до мальтозы и декстринов.
При затирании расщепление крахмала протекает в три стадии: клейстеризация, разжижение, собственно осахаривание.
Естественный крахмал зерна трудно поддается расщеплению амилазами поэтому его нагревают в водной среде и переводят в состояние, максимально доступное для ферментативного гидролиза, т.е. клейстеризуют. Зерна крахмала в процессе медленного нагревания между отдельными этапами затирания набухают и при температуре 55 – 70 °С из амилопектина образуется вязкий гель – крахмальный клейстер. Температура клейстеризации солода, ячменя и других несоложеных материалов неодинакова. Она колеблется в зависимости от структуры зерна, образуемого сферокристаллами, и ряда других факторов. На поглощение воды крахмалом влияют также плотность зернового слоя и степень конденсации крахмального вещества, а также размер зерна – мелкие зерна клейстеризуются хуже, чем крупные.
Присутствие электролитов (ионов) в заторе влияет на температуру клейстеризации положительно или отрицательно в зависимости от вида и заряда иона. Чем медленнее нагревается суспензия крахмала, тем лучше набухают зерна и клейстеризация происходит при более низкой температуре. Солодовый крахмал, на который амилазы уже действовали при солодоращении, клейстеризуется легче, чем ячменный. Остаток крахмала, который при основном затирании не осахаривается, клейстеризуется путем отварок густой части затора.
Таким образом, клейстеризация является физико-химическим процессом и обязательным условием эффективности ферментативного гидролиза крахмала.
Разжижение крахмального клейстера происходит в результате ферментативной реакции. Оно сопровождается быстрым понижением его вязкости и связано с распадом амилопектина под действием α-амилазы. Оптимальная температура разжижения крахмального клейстера в заторах 65 – 70 °С при оптимальном рН 4,6.
Третья стадия – собственно осахаривание крахмала – катализируется обеими амилазами только после проведения первых двух стадий.
Осахаривание крахмала β-амилазой начинается с конца цепочек, в то время как α-амилаза атакует молекулы субстрата внутри цепочек. Под действием β-амилазы на амилозу и амилопектин наряду с мальтозой образуются высшие и низшие декстрины. Высшие декстрины образуются также под действием α-амилазы на амилопектин. Декстрины являются разновидностью эритрогранулозы, и α-амилаза разрывает их до α-1,6-глюкозидных связей, так что возникают новые центры для действия β-амилазы. Тем самым α-амилаза повышает продуктивность действия β-амилазы. Кроме того, α-амилаза атакует декстрины типа гексоз, образующиеся в результате действия β-амилазы на амилозу.
Декстрины с прямыми цепочками осахариваются обеими амилазами. При этом β-амилаза дает мальтозу и немного мальтотриозы, а α-амилаз – мальтозу, глюкозу и мальтотриозу, которая, в свою очередь, расщепляется до мальтозы и глюкозы. Декстрины с разветвленными цепочками гидролизуются амилазами до мест разветвлений. При этом образуются низшие декстрины, иногда олигосахариды, главным образом трисахариды и изомальтоза. Таких разветвленных остаточных продуктов, которые ферменты дальше не гидролизуют, насчитывается около 25 – 30 %, и они называются конечными, предельными декстринами.
Параллельно с декстринами образуются всевозрастающие количества мальтозы, являющейся основным сахаром при ферментативном гидролизе крахмала. Таким образом, содержание сбраживаемых углеводов в общем количестве экстрактивных веществ в расчете на 12 %-ное сусло составляет 80 – 85 %.
Главные углеводы сусла – гексозы (глюкоза и фруктоза), дисахариды (мальтоза и сахароза), трисахарид (мальтотриоза) и группы линейных, а также разветвленных полимеров, содержащих четыре и более глюкозные единицы. Пивные дрожжи усваивают моно-, ди- и трисахариды, но не сбраживают тетрасахариды или полимеры большей молекулярной массы, которые суммарно обозначают как фракцию несбраживаемых декстринов. Но вместе с тем декстрины обусловливают полноту вкуса и вязкость пива. Для сусла, содержащего 12 % экстрактивных веществ, соотношение углеводов составляет: глюкозы 17 – 20 %, мальтозы 65 – 68, мальтотриозы 15 – 18 %.
Хроматографические методы разделения сахаров выявили, что помимо главных компонентов глюкозы и мальтозы в сусле имеются в небольших концентрациях и другие сахара: свободные пентозы, включающие ксилозу – 1,5 мг/100 см3, арабинозу – 1,4 мг/100 см3, рибрзу – 0,2 мг/100 см3; дисахариды: нигерозу, мальтулезу и изомальтозу; трисахарид – глюкодифруктозу; смесь 1-й 6-кетоз в концентрациях менее 0,2 г/100 см3. 20 % декстринов имели длину цепочки более 20 единиц (молекулярная масса более 3000) и помимо пентозанов содержали глюкозан. Остальные 80 % фракции декстринов состояли в основном из глюкозосодержащих полимеров длиной от 4 до 20 единиц.
Отношение декстринов к мальтозе в охмеленном сусле важно как с технологической, так и с экономической точек зрения по следующим причинам. В процессе затирания из сухого вещества мальтозы образуется по массе на 5,5 % больше, чем декстринов. Эта величина соответствует количеству воды, связанной при гидролизе. В то же время при образовании из крахмала декстринов их выход равен исходной массе крахмала. Высокое содержание в сусле декстринов снижает выход экстракта, а также затрудняет фильтрование затора и выщелачивание дробины, в которой задерживается значительное количество экстракта. Это происходит в результате того, что декстрины являются гидрофильными коллоидами и обладают высокой вязкостью. Под действием трансглюкозидаз солода только небольшая часть декстринов гидролизуется до сбраживаемых Сахаров, поэтому конечная степень сбраживания сусла, богатого декстринами, низкая. Образованию декстринов способствуют высокие температуры осахаривания (свыше 70 °С), которые ограничивают действие осахаривающей β-амилазы в пользу декстринирующей α-амилазы. Технологически важными температурами осахаривания являются следующие:
60 – 65 0С – низшие температуры осахаривания, которые поддерживают действие осахаривающей β-амилазы (образуется больше мальтозы, но затор полностью не осахаривается);
70 – 78 °С – высшие температуры осахаривания, которые поддерживают действие декстринирующей α-амилазы (образуется больше декстринов);
78 °С – максимальная температура осахаривания, при которой активной является только декстринирующая α-амилаза.
Разницу температурного оптимума α- и β-амилаз на практике используют для регулировки взаимодействия обоих ферментов. Таким образом, подбором оптимальной температуры на отдельных стадиях затирания поддерживают действие одного фермента в ущерб другому.
При осахаривании изменяется, с одной стороны, соотношение концентраций обеих амилаз в зависимости от исходного сырья, а с другой – их активность, на которую влияют температурный интервал и рН. Важным фактором является различная стойкость обоих ферментов к высоким температурам: β-амилаза более чувствительна и инактивируется быстрее, чем α-амилаза.
Результат осахаривания контролируют реакцией по йоду. Крахмал окрашивается йодом в темно-синий цвет. При осахаривании молекула крахмала постепенно уменьшается и ее окраска изменяется. Сначала образуются продукты гидролиза - амилодекстрины. Они окрашиваются йодом в синий и фиолетовый цвета. Потом образуются эритродекстрины, окрашиваемые йодом в фиолетово-бурый и красно-бурый цвета. Как только затор перестанет давать цветную реакцию, это значит, что появились ахродекстрины и затор считается осахаренным.
Практически весь крахмал, содержащийся в сырье, должен осахариться. Кроме того, осахаренный затор не должен содержать декстрины, дающие цветную реакцию с йодом. Это требование обусловлено, с одной стороны, тем, что неполное осахаривание может снизить выход экстракта и отрицательно повлиять на вкус пива, а с другой – чувствительностью плохо осахаренного пива к так называемым сарциновым инфекциям, что снижает его биологическую стойкость.
Следует отметить, что существующая в заторе концентрация водородных иоион (рН 5,6 – 5,9) не является оптимальной для действия амилолитических ферментов.
В результате разжижающего и осахаривающего действия амилолитических ферментов солода в заторе дополнительно накапливаются экстрактивные вещества. Максимальное количество экстракта получается при температуре 65 – 70 °С.
РАСЩЕПЛЕНИЕ БЕЛКОВ И ДРУГИЕ ПРОЦЕССЫ ПРИ ЗАТИРАНИИ
Расщепление белков, катализируемое солодовыми протеазами, при затирании происходит в среднем на Г/3 – 2/5 общего их содержания в солоде. Более важным, чем количество белков, перешедших в сусло, является соотношение их отдельных фракций, которое должно удовлетворять условиям, наиболее благоприятным для сбраживания пивного сусла и качества готового пива.
Из общего количества белка, содержащегося в солоде, более половины находится в «растворенном» состоянии, остальная часть белков переходит в сусло при каталитическом действии протеолитических ферментов солода или внесенных ферментных препаратов.
При затирании белки расщепляются в широком интервале температур 40 – 70 °С, не ограниченном температурой пептонизации от 45 др 55 °С, хотя при этой температуре процесс протеолиза белков происходит наиболее интенсивно. При этих температурах и рН затора из комплекса протеолитических ферментов солода действует тайным образом кислая протеиназа (эндопептидаза). Она сравнительно стабильна при высоких температурах, и ее рН-оптимум близок к рН затора. В результате гидролиза протеиназой белков зернопродуктов образуются преимущественно высокомолекулярные продукты расщепления, которые при благоприятных условиях протеиназа снова частично расщепляет на среднемолекулярные. Как уже отмечено, денатурированные белки легче атакуются ферментами, чем неденатурированные. Денатурация белков солода частично происходит при проращивании, а при затирании осуществляется в значительной степени при нагревании, а также путем кипячения, которому часть затора подвергается при отварках. Протеиназы солода гидролизуют все белковые фракции зернового сырья – гордеин, глютелин, эдестин и продукты их распада. Дальнейшее расщепление продуктов гидролиза белков до пептидов, аминокислот может быть осуществлено пептидазами. Но заторы имеют рН, неблагоприятный для всех экзопептидаз, поскольку их рН-оптимум действия лежит вблизи нейтральной точки в щелочной области. Кроме того, вследствие большой чувствительности к высокой температуре пептидазы быстро инактивируются при затирании. Поэтому недостаточное растворение белков при солодоращении нельзя компенсировать более сильным их расщеплением при затирании.
Та часть белковых веществ, которая не подвергалась превращениям при солодоращении и затирании, переходит в дробину. Содержание белков в солодовой дробине составляет 23 – 27 %. Общая доля растворимых белков, образующихся при солодоращении и затирании, находится приблизительно в соотношении 1:1.
Наряду с белками, перешедшими в сусло под действием протеолитических ферментов, другая их часть растворяется при высоких температурах затирания под влиянием присутствующих в сусле солей. Одновременно растворенные в сусле белки в процессе затирания частично осаждаются в результате кипячения затора, а также реакции белков с полифенольными веществами из оболочек солода.
Растворы белков обладают типичными свойствами гидрофильных коллоидов. Они очень чувствительны ко всем физико-химическим воздействиям, при которых нарушается их коллоидное равновесие и существенно изменяются свойства. Белки, растворимые в воде, при кипячении превращаются в нерастворимые и затем осаждаются (коагулируют). Этот процесс протекает в две стадии. Сначала денатурируют белки, т. е. происходит химическое изменение, вызванное внутренней перегруппировкой в молекуле, при которой молекулы переходят из состояния гидратированного (лиофильного) в дегидратированное (лиофобное). На следующей стадии начинаются коллоидно-химические изменения денатурированного белка, результатом которых является осаждение (коагуляция) дегидратированных белковых мицелл. Первичные частицы соединяются со вторичными, образуется грубая суспензия, которая выпадает из раствора в осадок.
Белки при затирании коагулируют уже при температуре 50 – 60 °С, и в первую очередь фракции альбуминов, а затем и глобулинов. Процесс расщепления белков при затирании невозможно контролировать непосредственно. С помощью аналитических методов анализа можно определить стойко растворимые азотистые соединения в готовом охмеленном сусле, сумма которых выражается в процентах к содержанию общего азота в солоде (число Кольбаха). Содержание стойко растворимого азота в сусле зависит не только от условий затирания, но также и от содержания его в сырье.
На состав азотистых веществ в готовом сусле основное влияние оказывает не температура при затирании, а степень растворения белков в перерабатываемом солоде, состав помола, метод затирания, а также условия кипячения с хмелем. При нормальном растворении солода содержание общего азота максимально при одноотварочном способе, меньше – при двухотварочном, минимально – при высокотемпературном способе затирания с короткими паузами.
Таким образом, на качество пива влияют только белковые вещества, остающиеся в растворе даже после кипячения сусла с хмелем. Для оценки белкового состава сусла имеет значение не количество общего белка, а его качественный состав. С технологической точки зрения важны стойко растворимые белки, высшие продукты распада белков, аминокислоты и полипептиды.
При затирании достаточно важное значение имеют минеральные вещества, попадающие в сусло вместе с производственной водой солодом, несоложеными материалами. Они существенно влияют на рН заторов и готового сусла. При затирании фосфорорганические соединения, в частности фитин, расщепляются фитазой солода. Образующиеся неорганические фосфаты (соли калия) играют роль буферных компонентов сусла, особенно необходимых для нормального действия гидролитических ферментов как солода, так и внесенных в затор. Неорганические и органические фосфаты при затирании большей частью осаждаются ионами Са2+ и Mg2+, содержащимися в воде и солоде. Оставшиеся в сусле фосфаты участвуют в процессах фосфорилирования.
Пентозаны зернопродуктов изменяются в процессах затирания довольно незначительно. Большая их часть переходит в сусло путем экстрагирования. Пектиновые вещества и гемицеллюлоза из ячменя и солода переходят в растворимое состояние только при кипячении густой части затора. Применение при затирании плохо растворенного солода, в котором не завершился процесс цитолиза при проращивании, вызывает повышение вязкости заторов и, следовательно, плохое фильтрование сусла, а также тормозит осахаривание крахмала. Вязкость сусла и качество его фильтрования зависят как от содержания и степени разрушения гумми-веществ зернопродуктов, так и от продуктов гидролиза крахмала и белков при проращивании и затирании.
В процессе затирания гумми-вещества зернопродуктов структурно не изменяются. Переход их в сусло зависит от способа и температуры затирания, концентрации затора. При более высокой температуре затирания в сусло из ячменя и солода переходит больше гумми-веществ, вследствие чего повышается его вязкость. В сусле, полученном из менее концентрированных заторов, содержится больше гумми-веществ, чем в сусле из более концентрированных заторов.
Ценность сусла повышается при кипячении густой части заторов благодаря окислению, меланоидинообразованию и карамелизации, с ферментативными процессами изменение цветности не связано.
Карамелизация заключается в дегидратации сахаров сусла с образованием различных темноокрашенных продуктов – карамелей, гуминовых кислот.
Полифенольные вещества из оболочек зернопродуктов способствуют увеличению цветности сусла тем, что при высоких температурах окисляются в красно-бурый флобафен. Они отрицательно влияют на вкус пива, так же как и малорастворимые горькие вещества из оболочек.
Лекция 4
КИПЯЧЕНИЕ СУСЛА С ХМЕЛЕМ
Вовремя кипячения сусла с хмелем протекают следующие процессы: инактивация ферментов, стерилизация, сусла, доведение массовой доли сухих веществ до определенной величины, коагуляция белковых веществ, растворение и превращение горьких веществ хмеля, образование редуцирующих веществ, превращение хмелевого масла.
Характер этих процессов и достижение необходимого результата зависят от продолжительности и интенсивности кипячения, степени упаривания, рН и содержания в хмеле ценных компонентов. По механизму первые три процесса являются физико-химическими, остальные – химическими.
Чтобы прекратить гидролитические процессы в сусле, инактивируются ферменты, поскольку на следующем этапе брожения для пивоваренных дрожжей необходима среда определенного химического состава, от которого зависят соответствующие сорту пива физико-химические и органолептические показатели.
Ферменты, оставшиеся в охлажденном сусле, при брожении неизбежно продолжали бы расщеплять декстрины до мальтозы, и в сусле накапливались бы излишние количества сбраживаемых сахаров, которые могли бы непрогнозируемо изменить характер получаемого пива.
Можно предположить взаимодействие углеводов сусла с дрожжевой α-1,6-амилоглюкозидазой, которая, расщепляя α-1,6-глюкозидные связи в предельных декстринах сусла, освобождала бы в них для действия амилаз сусла дополнительные α-1,4-глюкозидные связи. Такими же свойствами обладает предельная декстриназа, расщепляющая декстрины при сбраживании лучше, чем при затирании, где она ингибируется присутствующей мальтозой. Таким же образом под действием активной протеиназы сусла образовывались бы излишние количества ассимилируемого азота. Ферменты сусла инактивируются в течение 15 мин кипячения с хмелем. Одновременно погибают все находящиеся в сусле микроорганизмы, включая стойкие споры бактерий.
Стерильность готового охмеленного сусла является необходимым условием биологической чистоты главного брожения и дображивания, биологической стойкости готового пива. При слабокислой реакции и в присутствии антисептических компонентов хмеля сусло стерилизуется кипячением очень быстро.
Хорошие результаты первых двух процессов при кипячении достегаются благодаря высокой температуре, а также антимикробным и инактивирующим свойствам горьких веществ хмеля. Доведение массовой доли сухих веществ сусла до нужной концентрации происходит при продолжительном и интенсивном кипячении за счет испарения воды.
Простые белки сусла (альбумины и глобулины), растворенные в нем, при кипячении с хмелем осаждаются и образуют так называемый белковый отстой. Это очень важная технологическая операция, поскольку от остаточного содержания белка в пивном сусле зависят процесс брожения и появление помутнения в готовом пиве. Неполное осаждение белков при кипячении сусла с хмелем отрицательно сказывается на ходе главного брожения, поскольку частицы коллоидной мути, постепенно коагулирующие из сусла при низких температурах сбраживания, осаждаются на дрожжевых клетках и затрудняют их жизнедеятельность, ухудшают фильтрование готового Пива, а затем образуют в готовом пиве при хранении холодное помутнение.
При кипячении сусла с хмелем белки коагулируют в две стадии.
СООН
На второй стадии происходит собственно коагуляция, которая СН2 состоит в том, что дегидратированные молекулы денатурированного белка под действием электролитов, присутствующих в сусле, соединяются в более крупные, большие по объему хлопья (образование отстоя) – белковые мицеллы агломерируются. Несмотря на полное завершение при кипячении первой стадии коагуляции, вторая может происходить не полностью.
ДОФАхром
н
СН2
СООН О
\ /
сн
NH2
-2[H]Q^
взаимодействуют с полифенольными веществами, например антоцианогенами. Полифенольные вещества образуют комплексные соединения не только с высокомолекулярными белками, но и с продуктами ферментативного протеолиза, альбумозами и пептонами. Полифенольные вещества хмеля участвуют не только на второй стадии коагуляции, но и оказывают также дегидратирующее действие на белки, чем способствуют их осаждению.
Флавоноиды хмеля являются химически нестойкими соединениями и в результате окисления при кипячении сусла конденсируются во флобафены, которые также образуют с белками сусла комплексы, но они нерастворимы как в горячем, так и охлажденном состоянии. Флобафены – это конденсированные флавоноиды на основе катехинов, лейкоантоцианов, флавононов, флавонолов, флавонов, антоцианов и т. п.
Соединения неокисленных полифенольных веществ с белками растворяются в воде, сусле, при нагревании и без него, но при охлаждении сусла такие комплексы частично выпадают в осадок. Наиболее стойко выпадающими соединениями являются комплексы альбуминов с полифенолами, особенно с флобафеном. Труднее поддаются выделению глобулины.
рН 5,2 с технологической точки зрения считается оптимальным для образования белковых отстоев. Соединения полифенолов с белками, в образовании которых принимала участие β-глобулиновая фракция белка, растворимы как в горячем, так и холодном состоянии, поэтому являются в готовом пиве источником холодного помутнения,. При брожении они частично выделяются, однако даже при продолжительном дображивании и при очень низких температурах холодная муть такого происхождения полностью не осаждается и определенная ее часть всегда попадает в готовое пиво, в котором она постепенно переходит в устойчивую коллоидную муть. Ее интенсивность возрастает одновременно со степенью окисления хмелевых полифенолов.
При кипячении сусла кроме, полифетльных соединений хмеля проявляют свое действие также полифенольные вещества из солодовой оболочки. Но хмелевые полифенольные вещества имеют с белками большее сродство, чем солодовые, поэтому последние осаждают меньше белков сусла и, кроме того, неблагоприятно действуют на вкус готового пива.
Коагуляции белков при кипячении сусла способствуют ионы Мg2+ Cа2+. При использовании для приготовления сусла очень мягких иод, бедных электролитами, требуется более продолжительное кипячение. На выделение белков из сусла в значительной степени влияет интенсивность кипячения. Она способствует полноте коагуляции, но денатурация белков от этого фактора не зависит. Влияние интенсивности кипячения на осаждение белков проявляется в том, что поверхностно-активные белки адсорбируются на поверхности пузырьков водяного пара и при достижении определенной степени коагуляции образуют хлопья. Если при этом коллоидные частицы денатурированных белков удерживаются в суспензии электростатическими силами и действие поверхностного натяжения предотвращает их электростатическое отталкивание, то происходят укрупнение частиц белков и затем их коагуляция.
Концентрированное сусло требует более продолжительного кипячения с хмелем для обеспечения необходимой коагуляции белков, поскольку последних в нем больше и процесс коагуляции замедляется из-за высокой вязкости сусла и большего содержания защитных для белков коллоидов, например декстринов.
Защитное действие коллоидов заключается в образовании на поверхности частиц денатурированных, дегидратированных белков адсорбционногидратных слоев декстринов. Такие образования устойчивы, обратимы и имеют свойства декстринов, которые стабилизированы как дисперсная система. Адсорбционногидратные слои препятствуют контакту частиц белков и, следовательно, коагуляции. Их взаимодействие обусловлено наличием зарядов на поверхности макромолекул белка и гидратной ионизированной оболочки на нейтральных молекулах декстринов.
Изменения горьких кислот при кипячении сусла с хмелем очень сложны. По сравнению с α-горькой кислотой β-горькая кислота в сусле плохо растворима и трансформируется в ограниченной степени.
Гумулон изомеризуется при кипячении сусла с хмелем на 35 – 41 %, когумулон – на 38 – 59, адгумулон – на 41 – 67 %. Согласно этому гумулон придает суслу и пиву относительно меньше горечи, чем оба других гомолога. Степень изомеризации зависит также от дозы хмеля. Потери горьких кислот на этой стадии получения сусла составляют около 20 %.
Наибольшие потери происходят в начале кипячения сусла, кроме того, 8 – 10 % горьких кислот адсорбируется хмелевой дробине и в белковых осадках Из основной части α-кислот оставшихся в сусле, 40 – 60 % присутствуют в виде горьких изосоединений. Поскольку при сбраживании, выдержке, фильтровании пива возникают новые потери горьких кислот, то содержание α-горькой кислоты в готовом пиве составляет около 30 % от содержания ее в хмеле.
β-Кислота (лупулон) растворяется в сусле с трудом, а в пиве вообще не растворяется. Сам лупулон при кипячении сусла с хмелем не подвергается изомеризации и поэтому в незначительном количестве переходит в пиво и не влияет на его горечь.
β-Кислота только при окислении дает продукт, обладающий некоторой горечью. Из общего количества горьких веществ, подвергающихся превращениям при кипячении сусла с хмелем, на долю изомеров α-кислоты приходится 85 %, a 15 % - на продукты окисления β-кислоты. Мягкие смолы хмеля участвуют в образовании горечи сусла только на 5 – 10 %. И хотя β-кислота обладает более высокой бактериостатической силой, чем α-кислота, антисептические свойства сусла и пива обусловлены главным образом веществами, которые подвергались изомеризации, т. е. изомерами α-горькой кислоты.
Таким образом, технологический процесс получения сусла и пива с точки зрения использования горьких кислот очень не экономичен. На практике степень использования хмелевых смол можно повысить главным образом за счет переработки предварительно подготовленного хмеля или применения хмелевых концентратов.
Значение редуцирующих веществ, или редуктонов, для сусла и пива состоит в том, что они активно связывают кислород воздуха и тем самым защищают их от окисления. В результате увеличивается не только биологическая, но и коллоидная стойкость пива. Редуктоны – это продукты превращения сахаров, для них характерно наличие карбонильных групп. Они могут образовываться из триозофосфатов. К низкомолекулярным редуктонам относятся α-альдоны и анкетоны, стойкие в эндиольной форме и обладающие сильными окислительно-восстановительными свойствами. В процессах пивоварения участвуют ациредуктоны, способные редуцировать в кислой среде.
Енольная форма редуктонов может в дальнейшем дегидрироваться с образованием вещества, обладающего сильным восстановительным действием.
Сусло и пиво содержат кроме такого типа редуктонов ряд других более сложных по строению веществ, способных вызвать изменения окислительно-восстановительного потенциала. К ним относятся:
меланоидины и промежуточные продукты, образованные при реакции сахаров с аминокислотами главным образом при сушке солода и кипячении сусла с хмелем;
белки, содержащие сульфгидрильные группы и иногда продукты их расщепления;
полифенольные вещества группы катехинов, а именно лейкоантоцианы (антоцианогены), например лейкоцианидин и лейкодель-финидин.
Общим свойством редуктонов является низкий потенциал, возникающий при равной концентрации окисленной и восстановленной форм.
Многие окислительно-восстановительные процессы, происходящие при кипячении сусла с хмелем, приводят к усилению цветности сусла. Это происходит в результате карамелизации Сахаров, меланоидинообразования и окисления полифенолов сусла. Основные красящие компоненты сусла, а также и пива – это меланоидины, флавоны, каротиноиды, ксантофиллины, флобафен. Окрашенные компоненты сусла придают ему определенные вкусовые оттенки, что особенно заметно для светлых и темных сортов пива. Усиление. окраски сусла зависит от интенсивности и продолжительнохти кипячения сусла с хмелем, экстрактивности рН сусла.
Охмеленное сусло немного характерных эфирных масел хмеля, поскольку основная их часть улетучивается при кипячении с водяными парами. В процессе кипячения сусла с хмелем отдельные компоненты хмелевого масла окисляются, причем продукты окисления имеют неприятный запах и их попадание в пиво нежелательно. Происходит также фракционирование состава эфирного масла, причем в сусле в небольшом количестве остаются как высококипящие, так и низкокипящие фракции. Для придания суслу запаха хмеля его кипятят с последней дозой хмеля в конце процесса, желательно с хмелем лучшего качества.
Таким образом, охмеленное пивное сусло по сравнению с исходным концентрированнее, стерильно, не содержит активных ферментов, обеднено коагулированными белками и содержит продукты превращения горьких, эфирных, полифенольных соединений хмеля.
5.1.4. ОХЛАЖДЕНИЕ И ОСВЕТЛЕНИЕ СУСЛА
Целью охлаждения и осветления сусла являются понижение температуры до температуры главного брожения, насыщение сусла кислородом воздуха и осаждение взвешенных частиц сусла.
В процессе охлаждения сусла кислород из воздуха адсорбируется веществами сусла, образуются грубые и тонкие взвешенные частицы, постепенно выпадающие в осадок, в результате чего сусло осветляется. Таким образом, охлаждение и осветление сусла характеризуются физико-химическими и химическими процессами.
Связывание кислорода компонентами сусла пропорционально температуре. При температурах 40 – 85 °С кислород воздуха химически взаимодействует с сахарами, азотистыми и горьким и не веществами, хмелевыми смолами, полифенолами сусла и вкисляет их. Например, при окислении глюкозы образуется глюконовая кислота, фруктозы – муравьиная, щавелевая и винная кислоты окислительные процессы отрицательно влияют на качество сусла и пива, но вместе с тем они необходимы для образования стойких коллоидных комплексов, постепенно укрупняющихся до взвешенных частиц. Поэтому контакт сусла обязателен на этой стадии. Процесс окисления отдельных компонентов сусла выражается в увеличении окислительно-восстановительного потенциала и зависит от рН. При обычном рН сусла скорость окисления отдельных веществ возрастает в ряду: сахароза, мальтоза, глюкоза, фруктоза, хмелевые смолы, дубильные вещества. Сдвиг рН сусла в сторону щелочной области в большей степени влияет на окисление полифенолов, чем других веществ.
При температуре ниже 40 °С окисления компонентов сусла не происходит, но сусло продолжает насыщаться кислородом путем его физического растворения. Этот кислород содержится в сусле в свободном виде и затем расходуется при сбраживании на размножение пивных дрожжей. Растворимость кислорода в сусле зависит от температуры, толщины слоя сусла, его перемещения и плотности. Содержание кислорода в сусле должно составлять не менее 6 мг на 1 дм3. Муть в сусле находится в виде дисперсных систем, частицы ее разделяются на три группы.
Выпадение частиц мути при охлаждении сусла подчиняется общим законам осаждения. Медленное и непрерывное осаждение частицы, взвешенной в неподвижной жидкости, происходит под действием силы тяжести. Сопротивление жидкости, препятствующее падению частицы, зависит от радиуса частицы, плотности и вязкости сусла. На коллоидные частицы сила тяжести практически не воздействует из-за небольшой величины и близости их плотности к плотности сусла и пива. Осаждению коллоидных частиц препятствуют также сила диффузии (непрерывное перемешивание в результате броуновского движения) и электрические силы отталкивания. Поэтому осветление сусла является длительным процессом. Оно происходит отдельными, последовательными этапами, соответствующими каждому типу коллоидных частиц и каждой серии размеров частиц. С уменьшением диаметра частиц осветление сусла происходит труднее. Это объясняется тем, что сила тяжести, направленная вниз, ослабевает быстрее, чем сопротивление жидкости частицам мути. Но они могут увлекаться более крупными или более плотными частицами сусла, которые притягивают к себе мелкие.
Горячее сусло содержит грубые взвеси, образовавшиеся на стадии кипячения с хмелем. Осаждаясь на дрожжах, они могут отрицательно повлиять на жизнедеятельность дрожжей и тем самым на ход сбраживания сусла, а также на коллоидную стойкость готового пива. Размер грубых взвесей в среднем составляет 30 – 80 мкм. Понижение температуры сусла способствует укрупнению частиц и их достаточно быстрому осаждению. Эти взвеси содержат 50 – 60 % азотистых веществ, 20 – 30 полифенолов, 15 – 20 горьких хмелевых смол, 2 – 3 % минеральных веществ (алюминий, железо, медь).
Тонкая взвесь начинает образовываться и выделяться из сусла при температуре ниже 60 °С. Размеры частиц тонкой взвеси составляют"0,5 – 1,0 мкм. Кроме размера частиц тонкую взвесь отличает от грубой обратимый характер. Хотя масса тонкого осадка составляет всего 0,04 – 0,05 % массы экстракта сусла (грубой взвеси образуется в 10 раз больше), его наличие влияет на сбраживание сусла и качество пива в гораздо большей степени. Тонкие взвеси пленкой покрывают поверхность дрожжевых клеток и ограничивают их физиологические функции,_нпрушая проницаемость клеток, затрудняя диффузию сахаров в клетку и их сбраживание. Они придают пиву терпко-горький вкус и_снижают его стойкость к коллоидному помутнению, что определяется его составом – тонкий осадок состоит на 35 % из полифенолов и на 65 % из остатков β-глобулина, глютелина, гордеина. Эти комплексы теряют свою растворимость в сусле с понижением температуры.
Мельчайшие частицы тонкой взвеси осаждаются очень медленно поэтому лучше всего процесс осаждения вести в отстойном чане при полном охлаждении. Вместе с тем возникает опасность модифицирование сусла при температуре 20 – 40 °С вредными микроорганизмами – сарцонной уксуснокисльмй, молочнокислыми, бактериями группы кишечной палочки: Coli aerogenes, Escherichia coli, Aerobacter aerogenes и др. При Главном брожении их развитие подавляется в результате снижения рН,и при значении 4,4 они не окатывают влияния на дрожжи.
Количество взвесей в сусле зависит от содержания азота в зерне,концентрации сухих веществ сусла, нормы внесения хмеля, способа затирания, продолжительности и интенсивности кипячения сусла с хмелем.
При охлаждении и осветлении сусла в среднем на 0,5 % увеличивается концентрация сусла за счет испарения воды.
Лекция 5
5.2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РЕГУЛЯЦИИ ОБМЕННЫХ ПРОЦЕССОВ ДРОЖЖЕЙ
Наиболее длительные стадии приготовления пива – сбраживание сусла и созревание пива. При сбраживании пивного сусла происходят преимущественно биохимические процессы и в меньшей степени физико-химические и химические. От интенсивности этих процессов зависят не только продолжительность приготовления пива в целом, но и органолептические показатели продукта и стойкость его при хранении.
Основополагающую роль в биохимических превращениях при брожении пивного сусла и дображивании молодого пива играют дрожжи. Метаболическая активность пивоваренных дрожжей тесно связана с их физиологическим состоянием. Знание закономерностей роста и развития дрожжей, их взаимосвязи с внешней средой позволяет управлять жизнедеятельностью микроорганизмов, создавать основу для повышения эффективности производства пива и улучшения его качества.
5.2.1. ХАРАКТЕРИСТИКА ПИВОВАРЕННЫХ ДРОЖЖЕЙ
Пивоваренные дрожжи, как и все дрожжи – это одноклеточные организмы без хлорофилла, по морфологическим признакам их относят к классу Ascomycetes, семейству Saccharomycetaceae, роду Saccharomyces.
Пивоваренные дрожжи, сбраживающие моносахара и мальтозу, дедят на две группы:
Верховые дрожжи сбраживают раффинозу на одну треть и образуют на поверхности сбраживающейся жидкости неосаждающуюся суспензию, имеющую вид плотной пены. Поэтому дрожжи этой группы получили название верховых, а пиво, для производства которого их применяют, называют пивом верхового брожения. Процесс брожения верховыми дрожжами ведут при температуре 10 – 25 °С, при температуре ниже 10 °С он прекращается, после чего дрожжи оседают на дно.
Низовые дрожжи сбраживают раффинозу полностью. После сбраживания дрожжи агрегатируются в виде хлопьев и оседают надно бродильного аппарата. Поэтому их называют низовыми дрожжами, а получаемое пиво – пивом низового брожения. Сбраживание низовыми дрожжами протекает при температуре 6 – 8 °С и прекращается при 0 °С.
Отличия физиологии поведения дрожжей обеих групп заключаются в следующем. Предполагают, что клетки верховых дрожжей и пузырьки углекислого газа несут противоположные электрические заряды, поэтому взаимно притягиваются. У низовых дрожжей с пузырьками углекислого газа предполагается одинаковый заряд, так что они взаимно отталкиваются.
По другому объяснению, верховые дрожжи имеют более высокую поверхностную активность, чем низовые дрожжи, поэтому клетки активно прилипают к пузырькам углекислого газа. В результате верховые дрожжи устремляются наверх, уносимые пузырьками диоксида углерода, а низовые под действием сил тяжести оседают на дно. Но основной отличительной особенностью разных групп дрожжей является их способность сбраживать раффинозу. Из ферментов, гидролизующих раффинозу, в ферментной системе низовых дрожжей находятся инвертаза и мелибиаза, а у верховых – только инвертаза. В связи с этим верховые дрожжи сбраживают раффинозу только на треть. Инвертаза гидролизует трисахарид раффинозы до моносахарида фруктозы и дисахарида мелибиозы, который далее может быть расщеплен только мелибиазой, содержащейся в низовых дрожжах, до глюкозы и галактозы. Кроме того, у низовых дрожжей в отличие от верховых нет фермента сукцинатдегидрогеназы (янтарной дегидрогеназы), который функционально связан с цитохромом с и дыхательным ферментом Варбурга. Этим объясняется меньшая способность к размножению у низовых дрожжей, чем у верховых.
Клетки пивоваренных дрожжей размерами 5...10 х 5...13 мкм имеют круглую или овальную форму. Разница в форме отдельных клеток зависит от изменения состава среды, питания, наличия вредных примесей, в частности тяжелых металлов, изменения температуры и т. п. Значительные изменения формы дрожжевых клеток являются признаком дегенерации дрожжей. Здоровые дрожжи всегда наряду с крупными клетками имеют часть мелких, которые в период интенсивного роста не смогли еще достичь размеров взрослых клеток.
Дрожжевая клетка состоит из клеточной оболочки, цитоплазматической мембраны, цитоплазмы, включений – эндоплазматического ретикулума, митохондрий, рибосом, ядра, системы аппарата Гольджи, лизосом, вакуолей и запасных веществ – волютина или метахроматина, гликогена и др.
Ядро дрожжей круглое диаметром от 1,7 до 1,8 мкм. Оно жидкое и при определенных условиях приобретает особую структуру (reticulum). Ядро можно увидеть только под микроскопом после окрашивания клетки с помощью особой техники. В качестве основного составляющего оно содержит нуклеопротеины, в которые входит преимущественно дезоксирибонуклеиновая кислота. Окрашивающимся компонентом ядра является хроматин (кариотин). Пространство между хроматином заполнено ядерной плазмой (кариоплазмой). Клеточное ядро окружено ядерной мембраной. С помощью электронного микроскопа видно, что внутренняя часть ядра темнее, а внешняя светлее. Две мембраны окружают так называемое перинуклеарное пространство, которое может контактировать с внутриклеточным веществом. Связь ядра с цитоплазмой осуществляется через: отверстия в ядерной мембране – поры. Деление ядра обеспечивает размножение дрожжей. Оно содержит хромосомы, которые определяют основные наследственные свойства клетки.
Цитоплазма – это коллоидный раствор преимущественно белкового характера со значительным содержанием воды, заполняющей все пространство клетки. При 50 – 60 °С цитоплазма коагулирует и клетка умирает.
Цитоплазма негомогенна, ее структуру (крупнозернистую, мелкозернистую, неопределенную) определяет присутствие других веществ, содержащихся в плазменном веществе в виде зерен, тел, волокон, полостей и т. д. Эти структурные части цитоплазмы немного видны при обычном микроскопировании в проходящем свете (вакуоли, жировые капли), другие – после окрашивания (зерна гликогена, волютина и т. п.) или при наблюдении с помощью фазового контраста (митохондрии, сферозаны).
Вакуоли – это полости, образующиеся в плазме при старении клеток, они заполнены жидкостью и ограничены тонопластом, т. е. слоем из белков и липоидов. В жидком содержимом вакуолей имеются электролиты, белки, жиры, сахариды, волютин и некоторые окислительно-восстановительные ферменты.
Гликоген является резервным веществом, которое накапливается в молодых клетках при хороших условиях питания. При наиболее интенсивном развитии дрожжевые клетки могут содержать 24 – 40 % гликогена. В стареющих клетках его мало. Для определения физиологического состояния дрожжевых клеток микроскопически определяют содержание гликогена путем окрашивания раствором Люголя.
Волютин (метахроматин) – это соединение нуклеиновой кислоты с основанием, оно содержит также азот и фосфор. Это вакуолярный коллоид полифосфатного характера, образующий легкоокрашиваемые зернышки, например, метиленовым синим в темно-синий цвет, иногда в фиолетовый, почти красный. Волютин накапливается в дрожжах при брожении, и его содержание зависит главным образом от содержания фосфора в сусле. В среде без фосфорных соединений дрожжевые клетки утрачивают волютин. Клетки с высоким содержанием волютина имеют более высокую сбраживающую способность.
Жир присутствует в дрожжевой плазме в виде мелких капелек, резко преломляющих свет. В дрожжах жир содержится, с одной стороны, как запасное вещество, образующееся из белков или сахаридов, с другой – как дегенеративный жир, который появляется в старых клетках.
Митохондрии (хондриозомы) образуют в плазме системы измененной формы, слабо преломляющие свет, заметные только при применении фазового контраста. Они играют большую роль в образовании клеточных ферментов.
Другие структурные образования плазмы, которые отличаются от митохондрий лишь при окрашивании янусовой зеленью, названы сферозанами.
Клеточная оболочка дрожжей прозрачна, эластична, состоит из нескольких слоев. При старении клетки и потере ею запасных веществ клеточная оболочка сморщивается. Стенка клетки содержит главным образом разные полисахариды, а также каучукообразные вещества и немного хитина. Слизистая поверхность оболочки влияет на флокуляцию дрожжевых клеток. Важным свойством внутреннего слоя клеточной оболочки является ее проницаемость, т. е. способность пропускать в обоих направлениях только определенные вещества – продукты питания клетки, метаболизма. Функции клеточной оболочки зависят от физиологического состояния клетки. Изменением проницаемости клеточной оболочки регулируют метаболические процессы в клетке. На это влияют также внешние условия среды.
Оболочки мертвых дрожжевых клеток в отличие от живых легко пропускают некоторые красители, которыми окрашивается цитоплазма. Метиленовый синий используют для микроскопического определения числа мертвых клеток в технических культурах пивных дрожжей.
Основные функции всех клеточных мембран заключаются в отделении клеток от межклеточной жидкости, создании внутренней архитектуры клетки, в поддержании градиента концентраций и электрохимического градиента, в переносе питательных веществ и продуктов жизнедеятельности. Проницаемость мембран для раличных веществ зависит как от свойств молекул этих веществ, так и от характеристики мембран. В зависимости от того, требует ли перенос вещества через мембрану затрат дополнительной энергии, эти процессы могут быть разделены на пассивные (протекающие спонтанно в результате наличия градиента концентраций или электрохимического градиента) и активные (требующие затрат энергии метаболизма).
Пассивный перенос осуществляется главным образом диффузией веществ через поры (вода или другие низкомолекулярные, гидрофильные молекулы) или липидные части мембран (большинство гидрофобных молекул).
Активный перенос протекает в сопряжении с экзэргоническими реакциями метаболизма, обычно против градиента химического или электрохимического потенциала, причем источником энергии часто бывают АТФ или другие макроэнергетические соединения. Благодаря этому виду транспорта веществ осуществляются важные жизненные функции клетки. Активный перенос позволяет клетке
концентрировать питательные вещества, находящиеся во внешней среде в весьма низких концентрациях. Он поддерживает и контролирует оптимальный состав внутриклеточной среды. Активный перенос выполняется системой носителей из белков, специфично связывающих субстраты подобно ферментам и передающих их (сами или при взаимодействии с другими белками мембран) через мембрану. Подобно ферментам эти белки, или носители, могут ингибироваться как конкурентно, так и неконкурентно. Активный перенос отличается от облегченной диффузии тем, что последняя не требует затрат энергии и протекает только до момента установления равновесия концентраций по обе стороны мембраны. Некоторые системы активного переноса, если их лишить притока энергии, начинают функционировать как системы с облегченной диффузией.
Форма и величина дрожжевой клетки тесно связаны с ее физиолргическим состоянием, возрастом и составом питательной среды. При постоянном составе среды величина клеток и их форма становятся типичным признаком отдельных рас.
Сухие вещества дрожжей состоят на 90 % из органических веществ. В значительном количестве представлены белки и их производные. Дрожжевые белковые вещества состоят на 64 % из настоящих белков, на 10 % из аминокислот и полипептидов, на 26 % из фосфорсодержащих белков.
Два основных белка дрожжей – церевизин и зимоказеин. Первый относится к альбуминам, второй – кфосфопротеидам. Из низкомолекулярных азотистых соединений в клетке содержатся аминокислоты – лейцин, тирозин, гуанин, ксантин, а также амины – холин, гистамин и никотиновая кислота.
До 40 % массы сухих веществ в дрожжах может содержаться гликогена. Гликоген – это полисахарид, структурно подобный амилопектину, т. е. остатки глюкозы в нем соединены α-1,4-глюкозидными связями с разветвлениями у α – 1,6-связи. Его отличают от амилопектина большое число разветвлений и более высокая молекулярная масса. При кислотном гидролизе гликогена образуется глюкоза, а при ферментативном – декстрины и мальтоза.
В дрожжах содержатся также гуммивещества, при гидролизе дающие маннозу и глюкозу. Их содержание колеблется в зависимости oт физиологического состояния клеток.
Глютатион в дрожжевой клетке содержится в довольно количестве – 0,86 – 0,89 % и играет важную роль в окислительно-восстановительных процессах.
Липиды в дрожжах представлены лецитином и стеринами. Из стеринов самое важное значение имеет эргостерин, на основе которого образуется витамин D (кальциферол). Его содержание в дрожжах достигает 1,2 – 1,4 %. В дрожжах есть также витамины (мкг/r сухих дрожжей): В1 (тиамин) – 1250 – 1500, В2 (рибофлавин) – 45 – 50, РР (никотиновая кислота) – 400 – 500, холин – 3500 – 4000, инозит – 4500, пантотеновая кислота – 100 – 125.
Дрожжевые клетки содержат различные биологически важные вещества, катализирующие процессы обмена; ферменты, окислительно-восстановительные системы, вещества роста, порфирины.
Ферментативный комплекс дрожжевой клетки, катализирующий спиртовое брожение, состоит из 12 ферментов, двух кофермен-тов (2.3-дифосфоглицериновая кислота и тиаминпирофосфат), двух органических (АТФ/АДФ, NAD/NAD Н2) и двух неорганических (Mg2", К+) комплексов. Часть из этих ферментов катализирует дыхание клетки.
Дрожжевые клетки являются источником ферментов, не участвующих в брожении и дыхании. В основном это гидролазы, имеющие большое значение для подготовки компонентов среды к спиртовому брожению. Среди них различают внутриклеточные ферменты – эндоферменты и внеклеточные – экзоферменты. Эндоферменты (мальтаза, оксидаза, изомераза, дегидрогеназа и др.) проявляют свое действие только внутри клетки, так как поверхностный слой цитоплазматической мембраны для них непроницаем. К экзоферментам относят амилазу, эстеразу и др.
Важная группа гидролаз дрожжевой клетки – протеолитические ферменты. Как протеиназы, так и пептидазы локализуются внутри клеток, но могут также выделяться в окружающую среду. Протеолитические ферменты, выделенные из автолизированных пивоваренных дрожжей, являются гликопротеинами, локализованными снаружи цитоплазматической мембраной. Протеолитические ферменты, выделенные из протопластов дрожжей, не связаны с углеводами.
Протеазы дрожжей делят на А, В, С, D. Наиболее стабильны все протеазы при рН 6,0 – 6,5. Фермент А имеет оптимум температуры при 30 – 35 °С, ферменты В и С – около 50 °С, а фермент D – при 60 °С.
Фермент А образует при гидролизе аминокислоты и пептиды, а В, С, D – полипептиды с молекулярной массой больше 5000, следовательно, фермент А относится к экзопептидазам.
Окислительно-восстановительный комплекс ферментов дрожжей представлен цитохромами. Цитохромы по строению относятся кпорфиринам.
Порфирины состоят из четырех пиррольных колец, соединенных метиленовыми группами. Производные порфиринов присутствуют в различных гемопротеидах, гемсодержащих ферментах (цитохромы, пероксидаза, каталаза) и в хлорофилле зеленых растений. Порфирины подразделяют и обозначают в соответствии с заместителями в боковых цепях, связанных с пиррольными кольцами; наибольшее распространение имеют протопорфирины. Молекула порфирина включает систему сопряженных двойных связей, определяющую характерные свойства этого соединения.
Цитохромы переносят электроны от дегидрогеназ к кислороду. Их подразделяют на группы a, b и с в соответствии со спектрами поглощения восстановленной формы в видимой области спектра.
Большинство цитохромов (за исключением цитохрома с) прочно связаны с митохондриальной мембраной и не могут быть получены в растворимом и гомогенном состоянии. Только цитохром с можно проэкстрагировать из митохондрий растворами солей.
Цитохром с имеет известную в настоящее время последовательность аминокислот. Протопорфириновая группа, содержащая железо, ковалентно связана с белком через сульфидные мостики от двух молекул цистеина. Связь образуется присоединением – SH-группы к винильной группе протопорфирина. Это единственный случай гемопротеида, в котором гем ковалентно связан с белком. Пятая и шестая координационные связи железа в протопорфириновой группе связаны с гистидином и метионином, защищая таким образом железо от взаимодействия с О2, СО и даже HCN.
В состав комплекса цитохромов а + а3 (цитохромоксидаза) входит протопорфирин А (цитогемин), содержащий формольную группу вместо – СН3 и углеродную цепь изопреноида вместо винильной группы. Пятая координационная связь железа занята аминогруппой аминосахара. Комплекс цитохромоксидазы состоит из шести идентичных субъединиц, каждая из которых имеет одну молекулу цитогемина и один атом меди.
Из неорганических сухих веществ дрожжей около половины приходится на фосфор и около трети – на калий; 30—50 % фосфорной кислоты находится в дрожжах в связанном с органическими веществами состоянии, входя в состав таких соединений, как нуклеопротеиды и нуклеотиды. Фосфорные соединения имеют первостепенное значение в обмене веществ дрожжевых клеток как при распаде веществ, так и при синтезе. Это особенно очевидно проявляется при сбраживании – сахар только в том случае подвергается брожению, если он предварительно связан эфирной связью с фосфорной кислотой.
Зола пивоваренных дрожжей состоит в основном из следующих химических соединений: Р2О5, К2О, CaO, MgO, SiO2, SiO3, в небольших количествах входят оксиды Sn, Zn, Mn, Cu, Fe.
Содержание в дрожжевых клетках железа и других неорганических веществ определяется их присутствием в активных центрах ряда окислительных ферментов (оксидазы, каталазы, пероксидазы). Сера входит преимущественно в состав белков дрожжей. Восстановление дисульфидных групп белка, катализируемое специальными ферментными системами, играет большую роль в механизме клеточного деления – почковании.
Проявление жизненных функций пивоваренных дрожжей выражается в их росте и размножении, которые являются результатом непрерывно происходящих и взаимосвязанных процессов (метаболизма) внутри дрожжевой клетки.
Дрожжи размножаются вегетативно путем почкования, деления или спорообразования. Размножение делением за счет образования в клетке поперечной перегородки – септы характерно для дрожжей рода Saccharomyces.
Если дрожжевые клетки размножаются делением, то при образовании нитевидных структур они формируют истинный мицелий. При распаде такого мицелия образуются отдельные клетки – артроспоры. В старых клетках появляются эндоспоры – внутриклеточные бесполые споры, при этом клетки заметно увеличиваются в размерах.
При размножении путем почкования на поверхности дрожжевой клетки образуется маленькое выпячивание – почка, которая постепенно увеличивается почти до размеров материнской клетки и затем отделяется от нее, оставляя на месте бывшего прикрепления почковой шрам, или рубец, в виде кольцеобразного выступа. Если при почковании клетки не разъединяются, а на поверхности продолжают образовываться все новые и новые почки, то в конце концов формируются структуры, называемые ложными гифами, из которых складывается псевдомицелий.
Спорообразованием осуществляется половое размножение дрожжей. Перед спорообразованием происходит слияние (конъюгация) двух клеток. Затем оболочка дрожжевой клетки утолщается, внутри ее появляется одна или две перегородки, а затем по этим перегородкам клетка распадается на две или три части (споры). Попадая в нормальные условия, споры прорастают и принимают форму дрожжевых клеток.
В своем развитии дрожжи проходят несколько стадий (рис. 18). Первая фаза называется лаг-фазой. Она характеризуется приспособлением дрожжей к новой среде. Клетки подготавливаются к размножению, накапливают энергию, увеличиваются в своих размерах. Одновременно с этим усиливается процесс клеточного дыхания и в дрожжах накапливаются ферменты. Число клеток микроорганизмов в течение этого времени находится на постоянном уровне.
Вторая фаза называется экспоненциальной или фазой логарифмического роста. В ней максимально в геометрической прогрессии увеличивается число клеток.
Третья фаза – стационарная. Она характеризуется зрелостью культуры. В среде устанавливается динамическое равновесие, когда количество клеток, г. е. биомасса, практически не изменяется.
Четвертая фаза – фаза затухания роста, когда интенсивность деятельности дрожжевых клеток постепенно снижается из – за обеднения среды питательными веществами и накопления в ней продуктов метаболизма В результате клетки отмирают, происходит их автолиз. Чем больше среда обедняется продуктами питания, тем быстрее развивается автолиз.
Размножение дрожжей, как особое проявление жизнедеятельности микроорганизмов, во многом определяется факторами внешней среды. Взаимосвязь дрожжевой клетки со средой, приспособление к ней осуществляются путем внутриклеточных биохимических превращений, без которых невозможны рост и размножение клеток. На изменение условий питания организм отвечает приспособительной перестройкой своего обмена веществ, т. е. его регуляцией.
Обмен веществ в дрожжевой клетке, или метаболизм, включает в себя две группы процессов:
ассимиляцию (анаболизм) – потребление из среды питательных веществ, сопровождающееся затратой энергии, и образование новых соединений, расходуемых на рост и размножение клетки;
диссимиляцию (катаболизм) – выделение энергии, расходуемой в процессах ассимиляции, распада высокомолекулярных соединений.
Для питания дрожжам необходимы углеводы, азотсодержащие вещества, фосфор, калий, магний и другие компоненты в усвояемой клетками форме. Все виды обмена в дрожжевой клетке – углеводный, липидный, нуклеиновый, минеральный и т. п. – подготавливают обмен белков (специфический биосинтез белка). Одни группы процессов, как, например, углеводный обмен, являются в основном источником углеродных цепей в биосинтезе аминокислот. Другие, например обмен жиров, главным образом доставляют вещества, при окислении которых в макроэргических Связях АТФ накапливается энергия, необходимая для образования пептидных связей. Обмен нуклеиновых кислот обеспечивает хранение и передачу информации о расположении аминокислотных осгатков во вновь синтезируемых белковых молекулах. Минеральный обмен способствует становлению или распаду ферментных систем, при посредстве которых идет синтез белка и т. д.
МЕТАБОЛИЗМ УГЛЕВОДОВ
Расщепление дрожжами углеводов – один из основных процессов обмена веществ, поскольку является источником энергии для физиологических, биологических, биохимических процессов. Потребление углеводов дрожжами может протекать в аэробных (дыхание) и анаэробных (брожение) условиях (рис. 19).
Спиртовое брожение Сахаров сусла под действием ферментов дрожжей – основной технологический процесс в производстве пива. При брожении изменяется химический состав сусла и оно превращается в пиво.
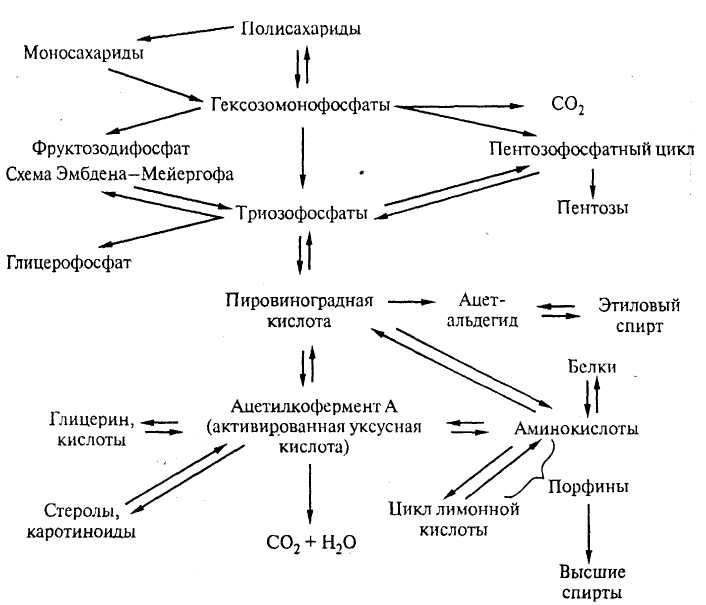
Рисунок 19 – Метаболизм сахаридов
Суммарно процесс спиртового брожения определяется уравнением Гей-Люссака, согласно которому в результате образуются этиловый спирт и диоксид углерода. Наряду с этими продуктами всегда, но в значительно меньших количествах образуются глицерин, янтарная кислота, высшие спирты, альдегиды и пр.
Брожение до образования пировиноградной кислоты происходит так же, как и при дыхании. На процесс дыхания расходуется всего 2 % сбраживаемых Сахаров сусла.
Спиртовое брожение в пивоварении протекает согласно схеме Эмбдена — Меиергофа по следующим последовательным реакциям:
Глюкоза взаимодействует с аденозинтрифосфатом (АТФ), в результате образуется D-глюкозо-6-фосфат и аденозиндифосфат (АДФ). Реакцию катализирует гексокиназа. Аналогично фосфорилируется также D-фруктоза и D - манноза с образованием соответствующих D-гексозо-6-фосфатов.
D-Глюкозо-6-фосфатйзомеризуется до D-фруктозо-6-фосфата (эфира Нейберга) под воздействием глюкозофосфатизомеразы.
Эфир Нейберга под действием фосфофруктокиназы фосфорилируется с участием АТФ, и образуется О-фруктозо-1,6-дифосфа (эфир Гардена – Юнга). На этом стадии фосфорилирования заканчиваются.
4. Эфир Гардена – Юнга расщепляется на две молекулы триозо фосфатов, а именно 3-фосфоглицеральдегид (сложный эфир Фишер – Бауэра) и фосфодиоксиацетон. Реакцию катализирует аль долаза. Первый подвергается дальнейшим превращениям. По мере его использования он снова образуется из диоксиацетона под действием изомеразы триозофосфатов.
5. 3-Фосфоглицеральдегид окисляется коферментом HAD+ при одновременном фосфорилировании до 1,3-дифосфоглицериновой кислоты. Эту реакцию катализирует триозофосфатдегидрогеназа. От полученной кислоты отщепляется фосфорная кислота ферментом З-фосфо-Б-глицёрат-1 -фосфотрансферазой.
6. З-Фосфоглицериновая кислота под действием фосфоглицеро мутазы изомеризуется с образованием 2-фосфоглицериновой кислоты.
При дегидратации ферментом енолазой 2-фосфоглицериновая кислота превращается в 2-фосфоенолпировиноградную кислоту.
Из последней под действием пируваткиназы образуется пировиноградная кислота.
9. Пировиноградная кислота расщепляется на ацетальдегид, этиловый спирт и диоксид углерода ферментами пируватдекарбоксилазой и алкогольдегидрогеназой.
Кофермент А занимает центральное место в обмене веществ дрржжевой клетки. Он способен образовывать с карбоновыми кислотами эфиры, являющиеся макроэргическими соединениями (свободная энергия гидролиза равна 33,0 кДж/моль или 8 ккал/моль), активируя тем самым обычно малореакционноспособные кислоты. Среди различных производных кофермента А, участвующих в обмене, наибольшее значение имеет ацетил- СоА, поскольку на стадии ацетил-СоА перекрещиваются пути обмена жиров, углеводов и некоторых аминокислот.
Связанный с коферментом А остаток уксусной кислоты в конце концов превращается в цикле трикарбоновых кислот в конечные продукты окисления СО2 и Н2О с оптимальным энергетическим выходом (синтез аденозинтрифосфата). С другой стороны, ацетил СоА является исходным субстратом при синтезе большого числа разнообразных соединений. Синтез может осуществляться при достаточном снабжении дрожжей пантотеновой кислотой. Ацетил-СоА является исходным субстратом при синтезе длинноцепочечных жирных кислот, стероидов, каротиноидов и гиббереллинов. Кофермент А участвует в построении корриновой системы витамина В12, а янтарная кислота в форме сукцинил-СоА – в синтезе 5-аминолевулиновой кислоты.
Таким образом ацетил-СоА является ключевым промежуточным соединением в превращении всех основных питательных веществ среды для дрожжей.
Центральная роль ацетил-СоА в метаболизме определяется тем, что как продукт катаболизма Сахаров, липидов и определенных аминокислот он может быть полностью окислен в цикле лимонной кислоты и дыхательной цепи до СО2 и Н2О либо использован в качестве активного промежуточного соединения для синтеза.
Чтобы не погибнуть, живой клетке нужно добывать энергию из окружающей среды и превращать ее в форму, приемлемую для ферментов клетки, которые синтезируют белки, углеводы, липиды и другие вещества. Эти синтетические процессы зависят главным образом от энергии, содержащейся в аденозинтрифосфате (АТФ). Образование АТФ сопряжено с окислением питательных веществ среды по механизму окислительного фосфорилирования, в этом процессе используются любые метаболиты, у которых с помощью ферментов могут отделяться атомы водорода. Это целый ряд веществ, способных в разной степени восстанавливаться и окисляться. Биохимические акцепторы электронов в цепи расположены в порядке возрастания их восстановительных потенциалов и, следовательно, убывания окислительных потенциалов. Электроны, отщепленные от атомов водорода, переносятся от донора к акцептору, а высвобождающаяся при этом энергия окисления идет на образование АТФ. Это происходит в митохондриях.
Из АТФ энергия выделяется путем расщепления макроэргических связей.
Макроэргическими связями называются такие ковалентные связи, которые гидролизуются с выделением значительной энергии 30 кДж/моль и более (свободная энергия гидролиза). Термин «макроэргические связи» используют исключительно для связей, участвующих в метаболизме, он не указывает на истинную величину энергии связей. Как известно, эта величина всегда положительна, другими словами, разрыв любой связи (в том числе и макроэргической) требует всегда затрат энергии.
МЕТАБОЛИЗМ АЗОТИСТЫХ ВЕЩЕСТВ
Для синтеза клеточного вещества и размножения дрожжи нуждаются в источнике ассимилируемого азота.
Из неорганических форм азота дрожжи могут усваивать только аммиачный азот в виде фосфатов и сульфатов аммония, а также аммиачные соли уксусной, молочной, яблочной, янтарной и других кислот. Используя неорганический азот, дрожжи способны синтезировать все аминокислоты.
Из органических форм азота дрожжи потребляют только низкомолекулярные формы – аминокислоты, пептиды, пуриновые и пиримидиновые основания. Превращения азотистых веществ дрожжевой клеткой показаны на рис. 20.
Наиболее ценный и важный источник азота для дрожжей – аминокислоты, поскольку 70 % всего ассимилируемого ими азота прихо дится на аминокислоты. Остальной азот ассимилируется дрожжами в виде аммония, амидного азота, пептидов. На первых этапах брожения дрожжи могут использовать аминокислоты среды для биосинтеза белка. По мере обеднения среды аминокислоты синтезируются в клетке вновь либо одни аминокислоты превращаются в другие.
Пути превращения аминокислот в дрожжевой клетке:
В результате декарбоксилирования из аминокислот образуются первичные амины. В реакцию вступают все аминокислоты. Дальнейшие превращения аминов происходят под действием моноаминооксидазы или диаминооксидазы.
Переаминированию подвергаются главным образом глутаминовая, аспарагиновая кислоты, в некоторых случаях – аланин и аспарагин и др. Переаминирование – это основная реакция заменимых аминокислот, протекающая в присутствии кофермента пиридоксальфосфата.
Модификация боковой цепи происходит главным образом при взаимных превращениях глицина и серина, протекающих в присутствии пиридоксальфосфата и тетрагидрофолиевой кислоты.
При полимеризации аминокислот возникают пептидные цепи (три-, тетра-, пента-, олиго- и полипептиды).
Окислительное дезаминирование – межмолекулярный перенос аминогрупп с аминокислоты на кетокислоту, в результате образуются соответствующие аминокетокислоты. NAD, FAD выполняют при этом роль акцептора водорода. В этой реакции принимают участие оксидазы и дегидрогеназы.
Окислительное дезаминирование аминокислот имеет большое значение для пивоварения, поскольку в результате образуется ряд побочных продуктов спиртового брожения, отрицательно влияющих на качество пива – высшие спирты, альдегиды.
Де карбоксил аза пировиноградной кислоты, содержащаяся в дрожжевых клетках, способна в анаэробных условиях превращать пировиноградную кислоту в уксусный альдегид и углекислый газ. Уксусный альдегид затем восстанавливается под действием алкогольдегидрогеназы дрожжей до этилового спирта. Но вместе с тем пировиноградная кислота может вступать в реакцию переаминирования с аминокислотами, затем декарбоксилирования с образованием соответствующего альдегида, который восстанавливается в спирт. Таким образом, кетокислота, вступая на место пировиноградной в цикле спиртового брожения, превращается в высший спирт.
Наиболее благоприятным путем потребления азота дрожжами является прямая ассимиляция аминокислот, обеспечивающая быстрый их рост и низкий уровень образования высших спиртов. Важное значение в азотистом обмене дрожжей имеет резерв азотистых веществ в дрожжевой клетке – пул. Его компоненты – низкомолекулярные вещества (аминокислоты, нуклеотиды и др.). Из этого резерва аминокислоты используются дрожжами для синтеза, поэтому главной задачей азотистого питания дрожжей можно считать поддержание этого резерва. Аминокислоты попадают из сусла во внутриклеточный резерв клетки и уже оттуда идут на построение протеинов.
Существует две точки зрения на состояние аминокислотного пула клетки. Первая – аминокислотный пул находится в клетках в свободном состоянии. Основываясь на этом, Коэн и Моно предложили модельную систему активного переноса аминокислот в дрожжевую клетку с помощью пермеаз. В этом случае величина пула зависит от концентрации экзогенных аминокислот. Вторая – пул аминокислот в дрожжах поддерживается путем ассоциации с внутренними макромолекулами клетки, причем природа этой ассоциации является неспецифической. По этой гипотезе в дрожжах имеется два пула, отличающихся химически и функционально:
первый способен к расширению и обеспечивает накопление аминокислот в количествах, превышающих их концентрации вне пула. Аминокислоты этого пула обмениваются с находящимися снаружи клетки аминокислотами;
второй (внутренний) пул имеется в клетках, в которых аминокислоты синтезируются из углеводов и неорганических соединений азота. На его размер не влияют экзогенные аминокислоты.
В дрожжевых клетках большая часть аминокислот образуется в митохондриях, определенная роль принадлежит лизосомам. Для синтеза белков наиболее важны глутаминовая и аспарагиновая кислоты, аланин и амиды первых двух, т. е. глутамин и аспарагин.
Лекция 6
МЕТАБОЛИЗМ ЛИПИДОВ
Липиды в дрожжевых клетках участвуют в регулировании окислительно-восстановительных процессов при дыхании, входят в состав как митохондрий, так и микросом, с белками образуют липопротеидный комплекс, входящий в состав протоплазмы. Комплексы участвуют в ферментативных процессах сбраживания пивного сусла. Из липидов в состав протоплазмы входят стерины. Основные функции стеринов в дрожжевой клетке – структурная, ростовая и защитная.
По своему строению стерины – производные пергидроциклопентанфенантренового ядра. Это нейтральные, довольно устойчивые вещества, встречающиеся как в свободном состоянии, так и в виде сложных эфиров алифатических жирных кислот. Основным стерином большинства дрожжей является эргостерин. Он составляет до 90 % общей фракции стеринов. Кроме эргостерина в дрожжах в незначительных количествах встречаются зимостерин, фекостерин, эпистерин, ланостерин и др.
С помощью меченого ацетата доказано, что исходной строительной единицей в синтезе стеринов в аэробных условиях является ацетил-СоА, образующийся в результате конденсации двух молекул уксусной кислоты по принципу «голова к хвосту» с участием фермента ацетоацетил-СоА-синтетазы. Взаимодействие ацетоуксусной кислоты и новой молекулы ацетил-СоА приводит к образованию З-окси-3-метилглутарил-СоА (ГМГ-СоА), которую ГМГ-редуктаза восстанавливает далее до мевалоновой кислоты. Образование последнего соединения – важнейший этап в биосинтезе стеринов, так как мевалоновая кислота лимитирует их дальнейший синтез. Между количеством этой кислоты в клетке и скоростью синтеза стеринов существует прямо пропорциональная зависимость.
Из мевалоновой кислоты через ряд промежуточных соединений образуются изопреновые соединения: изопентенилпирофосфат, диметилаллилпирофосфат, геранилпирофосфат и фарнезилпирофосфат. В дрожжах обнаружены ферменты, ответственные за образование структуры изопренов: киназы мевалоновой и фосфомевалоновой кислот, декарбоксилаза пирофосфомевалоновой кислоты и изопентилфосфатизомераза. Под действием фермента скваленсинтетазы две молекулы фарнезилпирофосфата конденсируются и образуют сквален. На этом этапе реакции конденсации заканчиваются.
Сквален постоянно находится в дрожжах, культивируемых в анаэробных условиях. В этом случае он накапливается в клетке и его содержание в 10 раз превосходит содержание эргостерина. При аэрировании, особенно в присутствии глюкозы, количество сквалена в клетках быстро уменьшается. В настоящее время окончательно установлено, что сквален перед циклизацией претерпевает еще о днк) превращение – в сквален-2,3-эпоксид (рис. 21). В этой реакции, требующей аэробных условий, кроме эпоксидазы участвует целый комплекс ферментов: цитохром Р-450 и NADH-цитохром Р-450-редуктаза. Считается, что кислород идет на образование гидроксильной группы стеринов.
Циклизация сквален-2,3-эпоксида в ланостерин под действием фермента эпоксидскваленциклазы идет в несколько стадий. Начиная с ланостерина, в клетках дрожжей происходят превращения циклических предшественников эргостерина, включающие элиминирование метальных групп, метилирование, перемещение и восстановление двойных связей.
Биосинтез боковой цепи включает стадии метилирования С24, дегидрирования С22 и редукцию двойной связи С24(28). Боковая цепь образуется независимо от модификации циклической части стерина. В результате перечисленных выше превращений из ланостерина получается эргостерин.
Ферментные системы, осуществляющие биосинтез стеринов, связаны с митохондриями и микросомами. Считается, что образование мевалоновой кислоты происходит в митохондриях, синтез идет в цитоплазме до фарнезилпирофосфата.
Стерины входят в состав клеточных мембран, в которых их содержание колеблется от 2 до 25 % общего количества. В клеточные мембраны включаются стерины, находящиеся в свободном состоянии, а этерифицированные стерины депонируются в липосомах цитоплазмы. Состав стеринов влияет на такие свойства клеточной мембраны, как вязкость, стабильность, проницаемость, устойчивость к лизису.
Стерины принимают участие в образовании митохондриальных структур и наоборот. Имеется определенная взаимосвязь между нарушениями в митохондриях и содержанием стеринов в дрожжевых клетках. В дрожжах, растущих в аэробных условиях, при добавлении метразола, затрагивающего окислительный метаболизм клетки, либо при переносе их в анаэробные условия уменьшается количество стеринов с 2,5 до 0,5 %, снижается уровень цитохрома с. При удалении метразола все нарушенные структуры восстанавливаются, а содержание стеринов достигает первоначального уровня.
Дрожжи способны к определенному росту в анаэробных условиях трлько в присутствии эргостерина и олеиновой кислоты. Выявлена зависимость между концентрацией экзогенного эргостерина и ростом клетки, а также состоянием клеточной мембраны. При минимальной концентраций (100 мкг/см3), необходимой для роста, эргостерин, вероятно, только заполняет определенные области в клеточной мембране. При этом ее свойства существенно изменены и клетка способна пройти 2 – 3 генерации. Более высокая концентрация эргостерина (0,5 – 1,0 мг/см3) приводит к нормальному росту и размножению, свойства мембран восстанавливаются. При повышении концентрации экзогенного эргостерина до 15 мг/см3 его содержание в клетке возрастает только до определенного уровня, который остается постоянным и при дальнейшем увеличении количества экзогенного стерина.
Способность стеринов к образованию комплексов с солями, спиртами, полиеновыми антибиотиками и другими мембранотропными токсинами определяет их защитную функцию в клетке. Взаимодействуя с этими веществами, стерины лишают их негативного влияния на живой организм.
Основным фактором, резко изменяющим уровень образования стеринов в клетках, является аэрация. Накоплению эргостерина благоприятствует также нейтральная или щелочная среда, его синтез максимален при 30 °С и почти прекращается при 40 °С. Значительный прирост стеринов (до 10 – 12 %) наблюдается при воздействии на дрожжи ионизирующих излучений. Более слабый эффект дают ингибиторы окислительного фосфорилирования и некоторые полиеновые антибиотики. Интенсивность синтеза стеринов зависит от состава питательной среды: содержание фосфорных соединений в культуральной среде не имеет решающего значения для накопления стеринов; среды с большим количеством азота уменьшают выход стеринов; Са2+ и Mg2+ стимулируют образование эргостерина; Na+ не влияет на него; К+ резко ослабляет биосинтез эргостерина.
Наиболее эффективными источниками углерода для биосинтеза стеринов являются углеводы, а также некоторые промежуточные продукты их распада. Максимальный прирост стеринов в клетке наблюдается при использовании глюкозы и раффинозы (100 – 200 %); мальтоза и фруктоза оказывают менее заметный эффект (30 – 35 %). Содержание продуктов распада углеводов пропорцио нально уровню кофермента А в клетке, а значит, эффективности стеринообразования согласно ряду: ацетат, этиловый спирт, глюкоза, мальтоза, глицерин, ксилоза и сукцинат.
Этиловый спирт – хороший экзогенный источник углерода для накопления стеринов дрожжевыми клетками. Этанол включается в синтез стеринов после превращения его в ацетат. Наилучшей концентрацией его считается 2 – 4 %, так как при более высоких концентрациях проявляются токсичные свойства спирта.
Органические кислоты с небольшим числом углеродных атомов способствуют накоплению стеринов в дрожжевых клетках. Среди таких кислот, как уксусная, молочная, пировиноградная, янтарная, яблочная, по усвоению и по своему действию на синтез стеринов первое место занимает пировиноградная кислота – прирост стеринов 295 %, янтарная кислота дает прирост около 195 %, молочная 160 – 175, уксусная – 105 и яблочная – 100 %.
Варьируя состав культуральной среды, можно значительно увеличить содержание стеринов в дрожжах. Например, дрожжи Saccharomyces cerevisiae после 6 ч культивирования при интенсивной аэрации и перемешивании на пивном сусле или на среде, содержащей 6 % глюкозы, содержали 1,44 % стеринов. В то же время, добавляя в эти среды 1 % спирта или другие несбраживаемые субстраты, увеличивали выход стеринов в 3 раза.
Метаболизм жирных кислот в дрожжевой клетке заключается в их окислении при участии кофермента А. В результате разрывается углеродная цепочка жирной кислоты с образованием ацетильного радикала и новой высокомолекулярной жирной кислоты, которая вновь окисляется, и т. п. Конечный продукт (З-окисления жирных кислот – ацетил-СоА. Он либо полностью окисляется до СО2 и Н2О, вступая в цикл трикарбоновых кислот, либо используется на смену углеводов в глиоксалатном цикле.
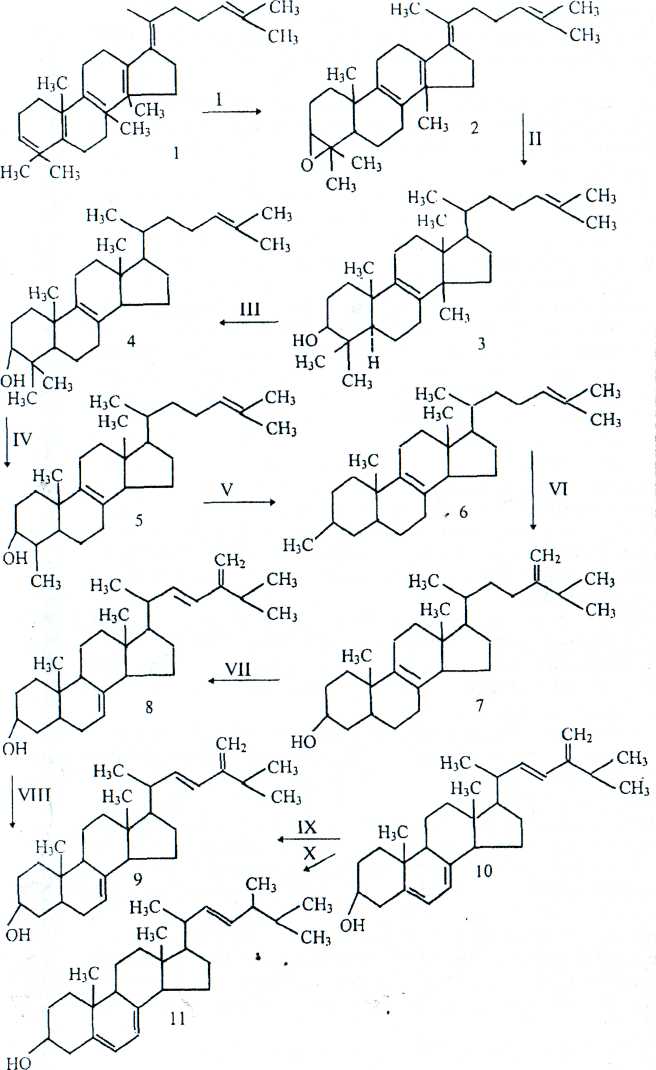
Рисунок 21 – Превращение сквалена в эргостерян у дрожжей Saccharomyces cerevisiae:
1 — сквален; 2 — сквален-2.3-эпоксид; 3 — ланостерин; 4 — 4,4-диметилхолеста-8,24-диен-3-р-ол; 5—4-метилхолеста-8,24-диен-3-Р-ол; 6 — зимостерин; 7—фекостерин; 8— эпистерин; 9 — эргоста-7,22,24(28)-триен-3, Р'-ол; 10 — эргоста-5,7,22,24(28)-тетраен-3, β-ол; 11 — эргостерин; / —эпоксидаза, цитохром Р-450-редуктаза, цитохром Р-450; II— эпоксидскваленциклаза; ///— 14-деметилаза; IV— оксидаза со смешанной функцией; V— оксидаза; VI— С24-метилтрансфераза; VII— изомераза; VIII — С22-дегидрогеназа; IX— изомераза; X— С24(28)-метилредуктаза
ОБРАЗОВАНИЕ ПОБОЧНЫХ ПРОДУКТОВ
Как известно, этиловый спирт в качестве основного продукта спиртового брожения сусла не является ведущим при формировании вкуса и аромата пива. Вкус пива определяется побочными продуктами обмена веществ дрожжей, такими, как алифатические и ароматические спирты, эфиры, органические кислоты, альдегиды, кетоны и сернистые соединения.
Образование высших спиртов при сбраживании протекает несколькими путями (рис. 22). По Эрлйху, дрожжи потребляют некоторые аминокислоты путем дезаминирования с образованием высших спиртов (рис. 23). Так, из лейцина образуется 2-пентанол, из изолейцина пентанол, из валина – 2-бутанол, из тирозина – тиразол. Коферментом в реакции трансаминирования выступает пи ридоксальфосфат.
Этот механизм объясняет образование высших спиртов из экзогенных аминокислот, содержащихся в пивном сусле.
В процессе брожения аммиак, как показал позднее И. Я. Веселов, связывается пировиноградной кислотой по реакции переаминирования. Аммиак фактически не отщепляется в ходе реакции, а сразу осуществляется перенос аминогруппы аминокислоты на новые углеродные цепи, образуемые из продуктов превращения углеводов при спиртовом брожении.
Высшие спирты при брожении могут быть образованы и без участия аминокислот, например через уксусную кислоту (Женевье, Лафон) по схеме: уксусная кислота → ацетоацетат → ацетоин → изопропанол или ацетон + ацетальдегид → β, β1 – диметилакролин → пентанол.
Таким же путем изовалериановая кислота превращается в изоамиловый спирт. Аминокислоты превращаются в соответствующие спирты только в присутствии сбраживаемого сахара.
Высшие спирты пива представляют собой летучие вещества с определенными запахом и вкусом, проявляющимися но после образования из них эфиров (табл. 17). Содержание высщих спиртов в пиве сравнительно небольшое и зависит от состава сусла, в основном от вида сбраживаемого сахара вида количества присутствующих аминокислот, расы дрожжей температуры и режима брожения. Высшие спирты появляются в пиве в самом началеs брожения, затем их количество возрастает в зависимости от перечисленных факторов.
Пивоваренные дрожжи в процессе сбраживания сусла синтезируют ряд органических, кислот: уксусную, пировиноградную, молочную, яблочную, лимонную и др., которые содержатся во всех сортах пива. В начале брожения накапливается большое количество уксусной кислоты, а затем при накоплении максимального количества пировиноградной кислоты содержание уксусной кислоты значительно снижается.
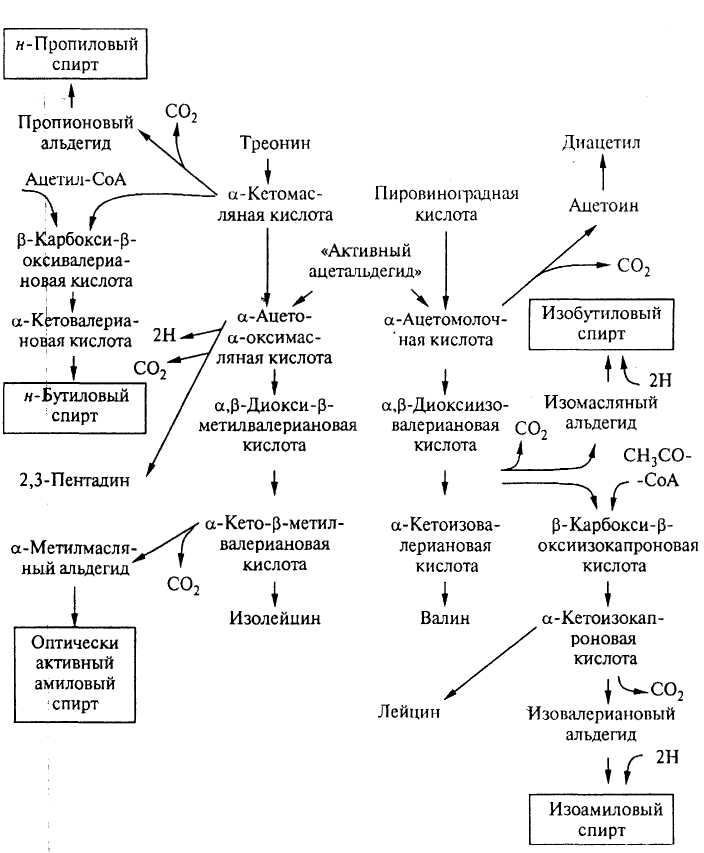
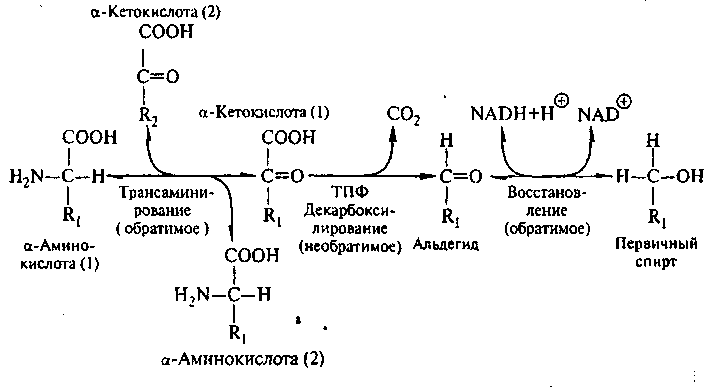
Рисунок 23 – Образование высших спиртов по Эрлиху
Синтез органических кислот зависит от условий брожения и расы дрожжей. Так, при повышенной аэрации среды он усиливается.
Из летучих органических кислот при сбраживании сусла в наибольшем количестве образуются уксусная и муравьиная кислоты – соответственно 50 – 150 мг/дм3 и 20 – 40 мг/дм3. Значительная часть уксусной кислоты образуется при брожении, а остальная часть – при дображивании.
На вкус пива влияют также нелетучие органические кислоты, например образующиеся при анаэробном расщеплении глюкозы – пировиноградная, янтарная, молочная, малеиновая, лимонная, виноградная, щавелевая.
Пировиноградная кислота является важнейшим промежуточным продуктом спиртового брожения.
Янтарная кислота накапливается в процессе окисления спирта некоторыми микроскопическими грибами, при спиртовом брожений, а также в цикле Кребса.
Яблочная кислота является побочным продуктом спиртового брожения, но содержится и в ячмене.
Лимонная кислота – побочный продукт брожения сусла, но может также образовываться микроскопическими грибами родов Aspergillus и Penicillium при солодоращении.
И. Я. Веселов предлагает следующий путь образования янтарной кислоты как один из возможных вариантов реакции образования высших спиртов по Эрлиху. В некоторых случаях последняя стадия дезаминирования аминокислот при брожении может закончиться не реакцией восстановления, а реакцией окисления, при этом вместо спирта образуется кислота, например из глутаминовой кислоты янтарная:
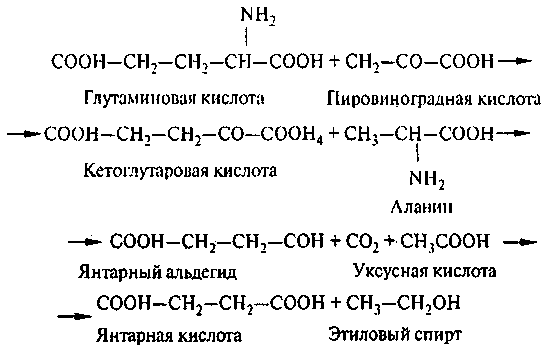
Сложные эфиры образуются при сбраживании сусла из летучих и нелетучих органических кислот и высших спиртов как продуктов жизнедеятельности дрожжей в результате реакций, катализируемых эстеразами дрожжей, т. е. реакций этерификации:
![]()
Сложные эфиры накапливаются также при биосинтезе в дрожжевых клетках. И. Я. Веселов указывает, что правильнее считать образование сложных эфиров по реакции между альдегидами как исходными продуктами для образования кислот и высших спиртов, так как анализы показывают, что при реакции этерификации уменьшается концентрация альдегидов, а не кислот:
![]()
В первом случае имеет место биологическая этерификация (с участием ферментов), во втором – химическая (по закону действия масс, согласно которому скорость химической реакции пропорциональна активным массам реагентов).
По мере уменьшения в среде концентраций спирта и кислоты скорость образования сложных эфиров уменьшается и в определенный момент в системе устанавливается подвижное равновесие, после которого их количество не увеличивается. При брожении сложные эфиры образуются также из пировиноградной кислоты при взаимодействии ацетил-СоА и спиртов.Схематично образование сложных эфиров при участии ацетил-СоА показано на рис. 24.
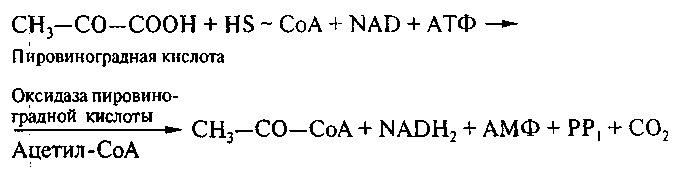
Сложные эфиры являются ароматическими веществами и главной составной частью запаха (букета) пива. Из карбонильных соединений при брожении образуются альдегиды, кетоны, дикетоны и оксикетоны (диацетил и ацетоин).
Альдегиды и кетоны – это продукты превращения углеводов и аминокислот. Альдегиды образуются при декарбоксилировании кетокислот. Биосинтез альдегидов протекает и на пути синтеза высших спиртов из аминокислот. Например, изомасляный альдегид синтезируется через а-кетоизовалериановую кислоту. Пировиноградная кислота путем конденсации с «активным альдегидом» превращается в α-ацетомолочную кислоту. В результате внутримолекулярной перегруппировки ацетомолочная кислота превращается в а-кетоизовалериановую кислоту. При конденсации ацетил-СоА с последней образуется α-кетоизокапроновая кислота, которая также декарбоксилируется в изовалериановый альдегид. Так происходит наращивание углеродной цепи с образованием более высокомолекулярных альдегидов.
Альдегиды при брожении образуются также при окисле нии спиртов как ферментативным, так и химическим путем. В первом случае ферментом является алкогольдегидрогеназа, требующая кофермента NAD.
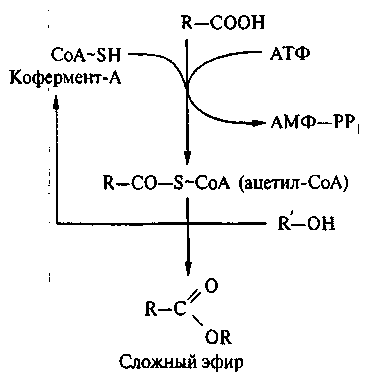 -
Рисунок
24 – Схема образования сложных эфиров
при брожении
-
Рисунок
24 – Схема образования сложных эфиров
при брожении
Из альдегидов в пиве пребладает ацетаяьдегид, вляющийся продуктом брожения (рис. 25) и придающий пиву незрелый вкус. Диацетил образуется при брожении сусла при инфицировании его педиококками некоторых рас пивоваренных дрожжей. Исходным продуктом для его синтеза являются пировиноградная кислота и тиаминпиро фосфат, а также Мп2+ или Mg2+. Процесс в этом случае катализируют последовательно ферменты пируватдекарбоксилаза, α-ацетолактатсинтетаза, ацетолактатдекарбоксилаза. По другому варианту дрожжи в присутствии NAD превращают пировиноградную кислоту в ацетил-СоА, который, конденсируясь с другой молекулой пировиноградной кислоты, образует ос-ацетомолочную кислоту с последующим декарбоксилированием ее в ацетоин. Превращение ацетоина в диацетил катализируют ацетоиндегидрогеназа и N4DH2. Схема реакций синтеза дрожжами ацетоина и диацетила следующая:
1
Ацетоин в основном и влияет на вкус пива. Он образуется на первой стадии брожения, когда дрожжи сильно размножаются и происходит энергичный азотистый обмен веществ. Слишком позднее аэрирование, вызывающее новый синтез дрожжевой массы, также приводит к образованию ацетоина и одновременно стимулирует его окисление до диацетила. Наличие сбраживаемого сахара повышает способность дрожжей восстанавливать диацетил. Восстановление ацетоина в 2,3-бутандиол катализируется бутиленгликольдегидро-геназой и NADH2. Три соединения – ацетоин, диацетил и 2,3-бутандиол образуют в пиве окислительно-восстановительную систему. В зависимости от активности действующих в этой системе ферментов превалируют те или иные продукты превращения. Если в пиве преобладают восстановительные процессы, то накапливается 2,3-бутандиол. В аэробных условиях увеличивается количество ацетоина и диацетила, ухудшающих качество пива.
Лекция 5
5.3. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ЖИЗНЕДЕЯТЕЛЬНОСТЬ
ДРОЖЖЕЙ
Факторы среды, влияющие на жизнедеятельность дрожжей, многочисленны и разнообразны. Их разделяют на биологические, физические и химические. Биологические факторы – это взаимоотношения между микроорганизмами, обусловленные одновременным присутствием в среде разнообразных видов. При этом характер взаимодействия может быть различным в зависимости от особенностей отдельных организмов в микробных сообществах (симбиоз, метабиоз, комменсализм, антагонизм). Биохимические и биологические особенности клетки определяют способность дрожжей к флокуляции – обратимой агрегации, или агглютинации, дрожжевых клеток. Существует несколько гипотез, объясняющих механизм флокуляции дрожжей. Предполагается, что при флокуля ции дрожжи агрегатируют в результате образования солевых (ионных) связей между ионами Са2+ и карбоксильными или фосфатны ми группами, расположенными на поверхности двух соседних клеток. Образовавшаяся структура стабилизируется дополнительными водородными связями. С помощью электронной микроскопии Стюарту удалось установить некоторые различия между структурой флокулирующих и нефлокулирующих клеток. Поверхность нефлокулирующих клеток гладкая, клетки флокулирующих дрожжей имеют на поверхности фибриллы, или волоски. Искусственное удаление этих волосков приводит к потере флокулирующей способности культуры.
На способность дрожжей к флокуляции влияют внутренние и внешние факторы. К внутренним факторам относят генетическую природу микроорганизма и строение клеточной оболочки дрожжей, к внешним – состав сусла, норму введения семенных дрожжей, температуру процесса, аэрацию среды и др. Таким образом, флокуляционная способность дрожжей зависит от химических и физических факторов, влияющих на жизнедеятельность дрожжей. К биологическим факторам относятся также и особенности используемых рас дрожжей.
К химическим факторам относят состав среды, концентрацию веществ, рН, редокс-потенциал, наличие (или отсутствие) ингибиторов, физиологически активных веществ. К физическим относятся температура, свет, лучистая энергия, давление, влажность и др.
5.3.1. ОСОБЕННОСТИ РАС НИЗОВЫХ ДРОЖЖЕЙ
Дрожжи, используемые для сбраживания пивного сусла, должны обладать следующими свойствами: хорошей способностью к размножению; способностью к значительному снижению рН; короткой лаг-фазой;
высокой степенью сбраживания (чаще всего);
хорошей способностью к флокуляции (отсутствием флокуляции);
свойством придавать пиву желаемый аромат;
незначительной чувствительностью к холоду;
незначительной подверженностью инфицированию.
В отечественном пивоварении для сбраживания пивного сусла используют дрожжи низового брожения, приспособленные к сравнительно низким температурам, неблагоприятным для жизнедеятельности посторонних микроорганизмов, что существенно влияет на качество, в том числе и стойкость, готового пива.
Пивоваренные дрожжи верхового брожения применяют значительно реже и главным образом для темных сортов пива. Особую группу дрожжей представляют глубинные расы, используемые для производства специальных сладких темных сортов пива, из них раса 191 К служит для сбраживания бархатного пива. Эти дрожжи хорошо сбраживают моносахариды, мальтозу, инвертный сахар, но не сбраживают сахарозу, лактозу и раффинозу.
Основными расами пивоваренных дрожжей, применяемых в на шей стране, являются следующие: 776, 44,41, S-Львовская, 11, Р, F, А, 8а(М),70, 191 К и др.
Раса 776 – среднесбраживающие дрожжи, за период главного брожения этой расой на сусле концентрацией 11 % образуется при мерно 2,7 % СО2. Клетки дрожжей имеют яйцевидную форму, длину 8 – 10 мкм и ширину 5 – 6мкм. Прирост дрожжевой массы составляет 1:5,4. Способность дрожжей к осветлению удовлетвори тельная. Эти дрожжи считаются особенно пригодными для сбраживания сусла, приготовленного с добавлением несоложеных материалов, а также из солода, полученного проращиванием ячменей с невысокой степенью прорастаемости.
Раса 44 выделена из образца производственных дрожжей в ЦНИЛППе в 1939 г. Это среднесбраживающие дрожжи, за период главного брожения на сусле, содержащем 11 % сухих веществ, об разуют 2,4 % СО2. У этой расы клетки овальной формы длиной 8 – 10 мкм, шириной 6 – 8 мкм. Прирост дрожжевой массы составляет 1:6,1. Способность дрожжей к оседанию хорошая. Они сообщают пиву полный вкус, дают хорошие результаты при применении в производстве пива воды с повышенной жесткостью.
Раса 41 выделена из образца производственных дрожжей в ЦНИЛППе в 1939 г. Дрожжи этой расы являются среднесбраживающими, за период главного брожения на сусле, содержащем 11 % сухих веществ, образуют 2,7 % СО2, имеют клетки овальной формы длиной 8 – 10 мкм, шириной 5 – 7 мкм. Прирост дрожжевой массы 1 : 4,7. Способность к оседанию хорошая. Дрожжи дают чистый и мягкий вкус пива.
Раса S-Львовская получена в 1941 г. Это дрожжи среднесбражи вающие, за период главного брожения на сусле, содержащем 11 % сухих веществ, образуют 2,88 % СО,, имеют клетки овальной формы длиной 7 – 9 мкм, шириной 4 – 6 мкм. Прирост дрожжевой массы 1 : 4,4. Способность к оседанию хорошая. Вкус пива дают чистый, мягкий.
Раса 11 относится к быстро и глубокосбраживающим расам, обладает хорошей способностью к осветлению. На 11 %-ном сусле образует 2,96 % СО2. В сравнении с расой 776 уменьшает продолжительность брожения на 20 %. Она нетребовательна к качеству сырья, дает полный вкус пива.
Раса Р — чешская раса, среднесбраживающая, на 11 %-ном сусле образует 2,08 % СО2. Дрожжи после сбраживания хорошо оседают, дают чистый вкус пива.
Раса F— чешская раса, относится к быстросбраживающим. Дрожжевые клетки крупных размеров, хорошо оседают, устойчивы к инфекции. Получаемое пиво отличается приятным ароматом.
Раса А выделена на Рижском пивоваренном заводе «Алдарис», относится к среднесбраживающим. Дрожжи имеют клетки овальной формы, средней величины, с хорошей способностью к осветлению, устойчивостью к инфекции.
Раса 8а (М) выделена из дрожжей, являющихся разновидностью пивоваренных дрожжей расы S-Львовская, и отличается от нее некоторыми признаками (табл. 18). Она характеризуется хорошим осветлением и дает пиво с приятным вкусом.
Раса 8а (М) по сравнению с расой S-Львовская обладает повышенной скоростью размножения и высокой бродильной активностью. Эти качества дрожжей позволяют сократить главное брожение на 20 %, а в отдельных случаях – до 40 %. Расу 8а (М) рекомендуется применять на заводах, где мощность бродильного отделения меньше производительности варочного цеха и отделения доораживания.
Наиболее важной характеристикой рас дрожжей является их способность к брожению, кодорая определяет скорость и глубину процессов при сбраживании пивного сусла. Сравнительные данные по бродильной и дыхательной активности дрожжей приведены в табл.19.
Активность дыхания и брожения для всех рас дрожжей значительно различается: удельная активность брожения в 4,7 – 13 раз больше, чем активность дыхания. Быстросбраживающие расы 8а (М), 11, 70 имеют удельную активность дыхания заметно большую, чем среднесбраживающие расы 776, 41, 44 и F.
Удельная активность дыхания изменяется в большом диапазоне значений: от 0,27 (для расы 41) до 0,67 [для расы 8а (М)]. Удельная активность дыхания быстросбраживающих рас 8а (М), 11 и 70 заметно выше, чем значения этого показателя для среднесбраживающих рас 41, 44, 776 и F. Наибольший дыхательный коэффициент имеют расы 41, S-Львовская, F и 8а(М). Для указанных рас активность брожения выражена в заметно большей степени по отношению к активности дыхания, чем у дрожжей рас 70, 776 , 44.
В процессе главного брожения наибольшей бродильной активностью характеризуются дрожжи рас 11, 776, F, 8а(М). Они имеют более высокую активность глюкозидазы и алкогольдегидрогеназы, играющих важную роль в подготовительной стадии брожения.
По потребности дрожжей в кислороде расы подразделяют следующем образом: высокую имеют расы 8а (М), S-Львовская, 44; умеренную – 70, 776; низкую – 11, 41.
Технологические свойства различных рас пивоваренных дрожжей представлены в табл. 20.
Среднесбраживающие расы (776, S-Лызовская, 44, 41) характеризуются большим по сравнению с быстросбраживающими расами (11, 8а (М), 70, F) временем генерации, сравнительно небольшим выходом клеток и гораздо более поздним началом флокуляции.
При использовании классической технологии пива по технологическим показателям наиболее эффективными являются расы 11, 8а (М). Они быстро размножаются, дают умеренный прирост биомассы, обеспечивают интенсивное забраживание и глубокое сбраживание сусла, характеризуются хорошей флокулирующей способностью. Применение этих рас позволяет получить пиво с хорошими органолептическими показателями, что подтверждается содержанием в нем летучих метаболитов (табл. 21) и меньшей склонностью к коллоидному помутнению. Последнее объясняется высокой активностью внеклеточных протеолитических ферментов дрожжей этих рас, относительно большей концентрацией этанола в пиве, меньшей величиной его рН.
5.3.2. СОСТАВ СРЕДЫ
Дрожжи развиваются в пивном сусле, и их жизнедеятельность во многом определяется его составом, от которого зависят скорость размножения дрожжей и количество образующейся биомассы.
Источником ассимилируемого углерода в сусле являются сбраживаемые сахара, которые используются пивоваренными дрожжами преимущественно в виде моно- и дисахаридов как источник питательных веществ, строительного материала и энергетических ресурсов. При нормальных условиях брожения пивного сусла 98 % сахаров расходуется на брожение и только 2 % – на дыхание.
Для брожения в пивном сусле наиболее важны сахара мальтозного происхождения, источником которых является крахмал солода и ячменя. Из 70—80 % сбраживаемых углеводов сусла на долю мальтозы приходится 60 – 70 %, мальтотриозы – 14 – 20, глюкозы – 10 – 15 %. Другие моно- и дисахариды содержатся в незначительном количестве.
Пивоваренные дрожжи сбраживают различные сахара с неодинаковой скоростью, что, как и использование других питательных компонентов среды, определяется двумя основными факторами: способностью вещества проникать внутрь дрожжевой клетки через цитоплазматическую мембрану и наличием в дрожжах экзогенных ферментов, вызывающих гидролиз молекул, для которых мембрана оказывается непроницаемой.
Из сахаров сусла дрожжами наиболее быстро потребляется сахароза после гидролиза β-фруктофуранозидазой, локализованной в мембране клетки, затем глюкоза и фруктоза, мальтоза и мальтотриоза. Более медленная скорость сбраживания ди- и трисахаридов объясняется необходимостью синтеза в дрожжах гидролизующих ферментов, а также пермеазных систем, которые делают возможным поступление этих Сахаров в клетку. Наличие легкоусвояемых Сахаров в пивном сусле, в частности глюкозы, тормозит синтез фер ментов для сбраживания ди- и трисахаридов. Концентрация глюкозы в сусле, при которой она уже не оказывает ингибирующего воздействия на образование мальтазы в дрожжах, 0,2 – 0,6 %.
Углеводный состав сусла значительно влияет на флокуляционную способность дрожжей. Факторы, способствующие увеличению в сусле сбраживаемых сахаров, особенно мальтозы и сахара-сырца, отрицательно влияют на флокуляцию дрожжей. После сбраживания 30 % углеводов сусла начинает понижаться бродильная активность клеток. Так как в дальнейшем дрожжи используют собственный запас аминокислот, интенсивность брожения падает.
Для проявления активного метаболизма дрожжей и быстрого брожения большое значение имеет не общее содержание углеводов в сусле, а соотношение количества сбраживаемых Сахаров и ассимилируемых азотистых соединений. Например, при сбраживании сусла с массовой долей сухих веществ не более 14,5 % интенсивность размножения дрожжей зависит как от содержания сбраживаемых сахаров, так и от ассимилируемого азота в сусле. Повышение плотности сусла не сказывается на скорости размножения клеток. В сусле с низкой концентрацией сухих веществпри достаточном количестве ассимилируемого азота размножение дрожжей будет лимитироваться недостатком сахара. Добавление последнего в среду сбраживания увеличивает выход дрожжей.
Дрожжевые клетки для синтеза компонентов, обеспечивающих их рост и размножение, нуждаются в источниках усвояемого азота. Известно, что дрожжи-автотрофы могут синтезировать все аминокислоты, входящие в состав белка, используя неорганические формы азота. С другой стороны, они могут потреблять аминокислоты в готовом виде. Сложные азотистые соединения используются клеткой только после их гидролитического расщепления соответствующими ферментами.
Наиболее интенсивно пивоваренные дрожжи размножаются на средах, содержащих смесь аминокислот. В том случае, если в сусле от сутствуют некоторые незаменимые аминокислоты, часть из имеющихся дез- и трансаминируется дрожжами, и образующийся аммоний используется для синтеза аминокислот. По сравнению с прямой ассимиляцией аминокислот эти процессы идут значительно медленнее.
Недостаточное количество аминного азота в сусле приводит к ослаблению бродильной активности дрожжей и снижению их флокуляционной способности, в результате скорость брожения снижается, ухудшается процесс осветления пива. К подобным явлениям может привести сбраживание дрожжами сусла, полученного с использованием больших количеств несоложеных материалов или заменой значительной части солода сахаром. Низкое содержание α-аминокислот в сусле может являться причиной дегенерации дрожжей.
Азотный обмен дрожжей в пивном сусле имеет большое практическое значение, так как от системы биосинтеза и расщепления аминокислот зависит образование веществ, обусловливающих вкус и запах пива. Вследствие того что от концентрации аминокислот зависит образование высших спиртов и диацетила, сусло не должно содержать усвояемых аминокислот больше, чем дрожжи их могут использовать.
Автором изучено влияние содержания полифенолов в пивном сусле на жизнедеятельность дрожжей. Содержание полифенолов в сусле варьировали, выделяя их сильноосновным анионитом на основе сшитого полистирола – АВ-17-П.
Полученные данные свидетельствуют о том, что извлечение полифенолов изменяет некоторые физико-химические показатели пивного сусла. Наиболее значительные изменения произошли с показателями рН, цветности, окислительно-восстанови тельным потенциалом.
Цветность сусла уменьшается за счет адсорбции анионитом антоцианогенов как основной фракции полифенолов, которые находятся в сусле в окисленной форме и окрашены в коричневый цвет.
Титруемая кислотность сусла после обработки изменилась в допустимых пределах. Сусло с различным содержанием полифенолов было подвергнуто сбраживанию. В ходе главного брожения содержание в бродящем сусле полифенолов и антоцианогенов значительно уменьшается, особенно на 1 – 3-е сутки (рис. 26). Это может быть связано с увеличением степени полимеризации полифенолов в результате окисления, снижения рН, а также воздействий протеаз дрожжей на комплексы полифенолов с белками. Содержание антоцикногенов снижается, очевидно, за счет связывания с альдегидами и ацеталями. В результате часть полифенолов оседает с белками, дрожжами, уносится в пену и т. д. Вместе с тем удаление полифенолов из сусла перед брожением не изменяет характера кривых роста дрожжей, но влияет на удельную скорость роста, время генерации и прирост биомассы, которые заметно различаются в зависимости от количества полифенолов в среде (табл. 23).
С уменьшением содержания полифенолов в сусле при брожении возрастает удельная скорость роста клеток, сокращается продолжительность лаг-фазы, что приводит к заметному уменьшению времени: генерации и повышению выхода дрожжей и одновременно к увеличению активности ферментов гликолиза, ускоренному образованию ацетальдегида, диацетила, ацетоина.
Последующее восстановление альдегидов и кетонов протекает довольно быстро, благодаря чему в молодом пиве концентрация этих метаболитов становится даже ниже, чем в контроле.
Таким образом, при удалении из сусла 30 – 35 % полифенолов продолжительность главного брожения может быть сокращена на 1,0 – 1,5 сут с одновременным повышением качества пива, связанным в первую очередь с меньшей его склонностью к коллоидному помутнению и улучшением органолептических показателей (табл. 24).
В состав сусла входят жиры в виде стеринов и ненасыщенных жирных кислот. Роль, исполняемая стеринами и ненасыщенными жирными кислотами в клетке, весьма велика: они являются частью структурной организации клетки, необходимы для роста и развития микроорганизмов, обладают защитным фактором против действия многих природных соединений и некоторых внешних воздействий. Содержание основных липидных компонентов в сусле зависит от состава используемого сырья. Если в полностью солодовом сусле содержится достаточное количество ненасыщенных жирных кислот, то применение несоложеных материалов приводит к снижению содержания последних. Концентрация стеринов мала и в том и в другом случае, поэтому клетки вынуждены сами синтезировать эти липидные компоненты.
Для увеличения содержания в пивном сусле стеринов и ненасыщенных жирных кислот, особенно при переработке несоложеного сырья в повышенном количестве, предложен способ, предусматривающий внесение в затор липазы в составе биокатализаторов липоризина ГЗХ, липокандина Г15Х.
Использование липазы приводит к увеличению в сусле количества стеринов и жирных кислот соответственю на 12 и 10 %. Кроме того, в нем существенно возрастает содержание редуцирующих веществ (0,5 – 1,5 %) иаминного азота (10,0 – 12,0 %), что свидетельствует об интенсификации в процессе затирания гидролиза крахмала и белков, находящихся с липидами в составе сложных соединений.
В условиях длительного анаэробиоза в клетках дрожжей увеличивается содержание жирных кислот с низкой молекулярной массой – капроновой и каприловой. Они частично выходят в среду и отрицательно влияют на вкус пива и его пеностойкость. Жирные кислоты с увеличенной углеродной цепью усиливают разрушающее действие липидов на пену. Жирные кислоты с короткой цепью наряду с высшими спиртами, уксусной кислотой, ацетальдегидом и глицерином отрицательно действуют на жизнедеятельность дрожжей. Их токсичность объясняется сорбцией на мембранах, в результате чего нарушается обмен между клеткой и средой.
Жизнедеятельность дрожжей в значительной мере определяется минеральным составом сусла, который зависит, с одной стороны, от чиспользуемой воды, с другой – от состава сырья (солода, хмеля). Для своего роста дрожжи нуждаются в довольно большом количестве неорганического фосфора, который участвует в синтезе нуклеиновых кислот и играет огромную роль в энергетике дрожжевой клетки. (Источники серы, входящие в состав белков, некоторых витаминов (биотина, тиамина), а также кофермента А, обычно присутству ют в сусле в достаточном количестве.
Из микроэлементов пивоваренные дрожжи особенно нуждаются в Са2+, Zn2+, Fe2+. Значение этих соединений для жизнедеятельнос ти клетки в том, что они являются составной частью отдельных ферментов, витаминов, активируют или ингибируют многие фермента тивные реакции и тем самым непосредственно вмешиваются в метаболические процессы.
Для нормального роста и жизнедеятельности дрожжей в среде культивирования должны присутствовать факторы роста, большое значение из которых принадлежит витаминам. Пивоваренные дрожжи чаще всего нуждаются в биотине, пантотеновой кислоте и инозите. Почти все они входят в состав активных центров ферментов, используются для синтеза нуклеопротеидов. В связи с этим отсутствие витаминов в клетке приводит к нарушению обмена веществ и делает рост дрожжей невозможным. Солодовое сусло содержит достаточное для поддержания роста дрожжей и брожения количество витаминов, в то время как несоложеные материалы не содержат ростовых веществ.
Образующийся при брожении спирт только на самых первых стадиях, когда количество его в среде небольшое, в какой-то мере стимулирует размножение дрожжей, но уже при концентрации 1 – 2 % он замедляет этот процесс, а при концентрации 5 % задерживает размножение дрожжей. Имеются расы дрожжей, которые при этой концентрации спирта полностью прекращают размножение. В пивоваренном производстве при содержании в бродящем сусле 1,5 – 2,0 % спирта размножение дрожжей практически прекращается.
5.3.3. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Развитие микроорганизмов во многом зависит от такого фактора внешней среды, как концентрация ионов водорода, или рН.
Цитоплазматическая мембрана дрожжевой клетки сравнительно малопроницаема для водородных и гидроксильных ионов, поэтому их концентрация в цитоплазме остается достаточно постоянной, что очень существенно для обеспечения жизненно важных функции клетки.
От рН среды зависят многие внутренние процессы в клетке, такие, как вязкость белков, осмотическое давление, набухание, поверхностное натяжение, а следовательно, и многие поверхностные явления. Поэтому только постоянство рН сусла может обеспечить нормальную жизнедеятельность дрожжей.
От водородного показателя среды зависят процессы размножения культуры и протекание в ней обменных реакций. Прежде всего ионы водорода или гидроксильные ионы непосредственно влияют на живую клетку. Каждый микроорганизм имеет свой максимум и минимум рН, в пределах которого он может развиваться. Для пивных дрожжей оптимум рН лежит в кислой зоне — 4,8 – 6,0.
Косвенное действие рН на клетку заключается в регулировании степени диссоциации веществ среды. В зависимости от того, при ка ком рН действует микроорганизм, он может синтезировать или активировать те или иные ферменты, осуществлять те или иные реакции.
Кроме того, рН влияет на степень диссоциации, растворимость и дисперсность веществ, которые клетка перерабатывает, на состояние промежуточных продуктов метаболизма. От этого зависит, сможет ли микроорганизм потреблять их дальше или будет не в состоя нии их использовать, в результате чего они будут накапливаться. От величины рН зависят скорость поступления питательных веществ в клетку, активность ферментов в синтезе белков, образование витаминов, а, следовательно, и скорость роста дрожжей.
Снижение рН среды по отношению к оптимальному для дрожжей значению приводит к существенному уменьшению синтеза биомассы, увеличению числа мелких клеток. При низких значениях рН наблюдаются морфологическое изменение плазмы, округление клеток, накопление в них жира. Резкое снижение рН может вызвать нарушение соотношения дыхания и брожения клеток.
Таким образом, путем регулирования рН сусла можно интенсифицировать процессы сбраживания и дображивания пива, а также влиять на качество готового напитка.
С участием автора проведены исследования по влиянию рН сусла на интенсивность метаболизма дрожжей: потребление мальтозы и аминного азота, размножение дрожжей, изменение гН2, титруемой кислотности, накопление этанола.
Достижение более низких значений ОВП молодого пива предотвращает его окисление при передаче на дображивание и способствует повышению качества пива и его стойкости.
В ходе главного брожения титруемая кислотность возрастала (см. рис. 28). Наиболее быстрый рост кислотности происходил в образцах с рН сусла 4,8; 5,2, но к концу брожения величина этого показателя достигает примерно одного значения и находится в допустимых пределах.
Влияние рН сусла на течение главного брожения отражается так на накоплении основного продукта брожения – этилового спирта.
Максимальное накопление этилового спирта происходит при сбраживании сусла с рН 5,2. На 5-е сутки брожения содержание этанола в этом образце составило 2,34 %, что на 9,9 % выше, чем в образце с рН 5,6, и на 17 % выше, чем в образце с рН 4,8. Образование спирта в образце сусла с рН 4,8 меньше, чем в контрольном. Таким образом, важнейшим фактором, влияющим на процессы брожения, является рН сусла. Более низкий, чем традиционно, рН сусла позволяет получить молодое пиво с более низкими значения ми рН и ОВП. Значением рН сусла, наиболее благоприятным для протекания процессов главного брожения, является 5,2. Наиболее стойкое пиво можно получить путем снижения рН сусла в более кислую область – до 4,8. Снижение редокс-потенциала сусла до 12 – 13 будет способствовать повышению коллоидной стойкости пива. Таким образом, от величины рН сусла зависят окислительно - восстановительные условия жизнедеятельности дрожжей.
5.3.4. АЭРАЦИЯ
Один из важнейших факторов воздействия на биохимическую активность пивоваренных дрожжей – это перераспределение осуществляемых ими реакций окисления-восстановления. Перемещаясь в среде, электроны вызывают возникновение потенциалов на электродах, погруженных в раствор этого вещества. Показатель гН2 является количественной характеристикой окислительно-восстановительного состояния, т. е. результирующей всех окислительно-восстановительных факторов.
Различные виды микроорганизмов имеют неодинаковые значе ния внутриклеточных рН и гН2. Постоянство рН в протоплазме клетки является важным условием ее жизнедеятельности, в том числе и окислительно-восстановительных процессов. У дрожжевых клеток существует тесная связь между состоянием окислительно–восстановительных систем в клетке и потенциалом окружающей среды. Они обладают специальным механизмом, обеспечивающим постоянную скорость окислительных процессов. Когда они соприкасаются с кислородом, то последний становится акцептором водорода. Если же кислорода не хватает, то водород окисляемого субстрата восстанавливает целую серию окислительно-восстанови тельных систем. Восстановленные вещества системы в клетке и вне ее вызывают образование низкого гН2 в среде.
Величина гН2 очень изменчива в зависимости от внешних усло вий. Так, перепад гН2 при переходе от аэробных к анаэробным усло виям составляет 15 – 40 единиц. Для анаэробных микроорганизмов гН2 является фактором, ограничивающим рост клеток. Показано, что дрожжи размножаются только при низком гН2. Анаэробы в пе риод лаг-фазы выделяют в среду редуцирующие вещества, снижая гН2 и интенсивность обмена веществ клетки. Таким образом, значе ние гН2 характеризует те энергетические условия, которые опреде ляют направление и интенсивность метаболических превращений в дрожжевой клетке.
Ферменты, катализирующие важные жизненные превращения у анаэробов, не активируются при определенном гН2. Поэтому анаэробы не могут существовать выше определенного значения этого показателя. Изменением гН2можно регулировать соотношение активности отдельных звеньев ферментного комплекса, осуществляющего энергетический обмен, что, в свою очередь, вызывает сдвиг во всех процессах обмена веществ. Низкий окислительно-восстановительный потенциал позволяет уменьшить фазу адаптации микроорганизмов в среде и получить готовый продукт высокого качества.
Кислород, растворенный в среде, необходимо рассматривать как важное для дрожжей питательное вещество. Хорошо известности мулирующее действие кислорода на рост и жизнеспособность дрожжей, на скорость сбраживания питательных веществ. В то же время его излишнее количество приводит к нежелательным последствиям: увеличению окислительно-восстановительного потенциала, чрезмерному накоплению биомассы дрожжей, снижению их флокуляционной способности, повышенному образованию продуктов метаболизма дрожжей – высших спиртов, альдегидов, диацетила и др., удлиняющих процесс созревания пива и отрицательно влияющих на его вкус и аромат, а также ухудшающих коллоидную и биологическую стойкость готового напитка. К тому же чрезмерная аэрация может привести к интенсификации дыхания дрожжей, снизив тем самым их бродильную активность.
Основываясь на вышеприведенных недостатках аэрации сусла, И. Я. Веселовым была предложена технологическая схема брожения и дображивания пива, полностью исключающая контакт с воздухом. Во время главного брожения с целью сокращения его продолжительности сусло периодически перемешивают с диоксидом углерода. Дрожжи перед введением в среду разбраживают в охлаж денном без доступа воздуха и насыщенном СО2 сусле. Однако необходимо отметить, что при недостаточном содержании кислорода в сусле размножение дрожжей замедляется, активность популяции снижается из-за низкого общего количества клеток в среде, а это приводит к снижениию скорости сбраживания. Необходимое количество растворенного кислорода в сусле, поступающем на главное брожение, определяется в размере 6 –9 мг/дм.
Особенно важна аэрация сусла при использовании закрытых систем охлаждения и сбраживания сусла, в том числе и цилиндроконических емкостей, в которых ограничен доступ кислорода из-за малой площади поверхности жидкости в аппарате. Некоторыми авторами предлагается при производстве пива в ЦКБ А поддерживать концентрацию кислорода в сусле на уровне 14 – 17 мг/дм3. Степень насыщения охлажденного сусла воздухом должна составлять 55 – 80 %, что при атмосферном давлении и температуре 5 °С составляет 5,8 – 8,4 мг О2/цм3 для 12%-ного сусла и 6,0 – 8,7 мг О2/дм3 для 11%-ного. При насыщении сусла воздухом более 75 % не происходит усиления стимулирующего эффекта на рост дрожжей и скорость сбраживания.
Для определения реальной потребности дрожжей в кислороде необходимо знать его растворимость в сусле, которая зависит от температуры, давления, состава среды. Низкая температура, высокое давление и небольшая плотность сусла способствуют растворению кислорода. Из компонентов среды главную роль в снижении растворимости кислорода играет глюкоза.
На растворимость кислорода воздуха влияют также система его распыления и способ охлаждения сусла. Применение микропористых распылителей, в частности керамических свечей, позволяет значительно повысить растворимость кислорода в сусле, даже если используют закрытую систему его охлаждения, например пластинчатые теплообменники.
Для каждого вида микроорганизмов существует определенная критическая концентрация растворенного кислорода в среде, т. е. тот минимальный уровень кислорода, ниже которого начинается лимитирование роста дрожжей. Эта величина лежит в пределах 0,01 – 0,02 ммоль О2/дм3 среды и зависит от вида микроорганизма, его физиологического состояния, состава среды культивирования. В настоящее время известно, что для каждой культуры критической является концентрация ее на поверхности клетки, а не в среде.
Требуемое количество кислорода зависит, с одной стороны, от свойств отдельных рас, с другой – от условий их предварительного культивирования. У разных рас пивоваренных дрожжей потребность в кислороде может колебаться от 2 до 40 мг/дм3 и выше. В зависимости от способа ведения брожения пивоваренные дрожжи могут получаться в формах, требующих кислорода или не требующих его. Клетки, выросшие в аэробных условиях, не нуждаются в кислороде и хорошо бродят как в аэрированном, так и в деаэрированном сусле. Дрожжи, растущие длительное время без кислорода, будучи добавленными к неаэрированному суслу, характеризуются пониженной способностью к использованию питательных веществ.
Передача кислорода к клеткам осуществляется через ряд фазовых переходов, которые сводятся в основном к двум: перенос кислорода из газовой фазы в жидкую и из жидкой к клетке. Обеспечение микроорганизмов достаточным количеством кислорода в большей степени зависит от перемешивания среды, способствующего диспергированию воздуха, увеличению турбулентности, устранению застойных зон. При постоянном парциальном давлении кислорода увеличение интенсивности перемешивания среды приводит к возрастанию удельной скорости роста микроорганизмов.
При длительном анаэробном культивировании в дрожжевых клетках наступает аноксибиотический анабиоз, в результате чего дрожжи теряют бродильные свойства, прекращают размножаться и перестраивают свой энергетический обмен. Потребность в молекулярном кислороде резко возрастает.
Кислород с точки зрения потребления его при брожении имеет для дрожжей двоякое значение: как акцептор водорода, обеспечивающий окисление и выделение энергии из редуцированных субстратов путем окислительного фосфорилирования, и как микроэлемент, стимулирующий образование ненасыщенных жирных кислот и стеринов. При культивировании дрожжей в аэробных условиях основная часть энергии окисленного субстрата идет на построение клеточного вещества, в результате чего увеличивается выход биомассы. В то же время в анаэробных условиях лишь 1 – 2 % сбраживаемых углеводов расходуется на образование дрожжевых клеток. Неэффективный рост дрожжей при анаэробиозе объясняется тем, что они имеют окислительный механизм синтеза стеринов и ненасыщенных жирных кислот. Поэтому в отсутствие кислорода дрожжи не способны синтезировать эти липидные компоненты мембран и снижение их количества до минимального уровня уже через 4 – 5 клеточных циклов приводит к полной дегенерации клеток. Так как значительный прирост биомассы приводит к повышенному содержанию некоторых продуктов метаболизма дрожжей, то с технологической точки зрения следует ограничивать процессы дыхания и размножения клеток. В связи с этим следует больше внимания уделять второй функции кислорода.
В присутствии кислорода синтез стеринов осуществляется очень быстро. Уже через 20 мин после введения дрожжей в среду культивирования происходит образование стеринов, т.е. к этому моменту были синтезированы клеткой все ферменты и накоплены промежуточные продукты, принимающие участие в биосинтезе эргостерина. Спустя 5 – 7 ч после начала брожения содержание стеринов достигает своего максимума (в зависимости от вида и штамма дрожжей – 4 – 12 мг/г сухого вещества дрожжей). В дальнейшем, в ходе сбраживания, стерины быстро потребляются клеткой для построения необходимых структурных компонентов и к концу процесса их концентрация снижается до 1,0 – 0,5 мг/г сухого вещества дрожжей. Во время активного синтеза стеринов в дрожжах преобладают их эфиры, которые в отсутствие кислорода превращаются в свободные стерины, играющие активную роль в метаболизме клеток и мембранных функциях. Клетки дрожжей с высокой бродильной активностью могут в условиях хорошей аэрации повысить содержание стеринов в шесть раз и более по сравнению с дрожжами, обладающими значительной окислительной активностью. В первом случае окислительно-восстановительные ферментативные системы дрожжей таким образом лимитируют процессы метаболизма, что в них накапливается достаточное количество исходного строительного материала, и в то же время наличие окислительных систем и хорошая аэрация обеспечивают необходимую скорость биосинтеза стеринов.
Аэрация семенных дрожжей приводит к накоплению в них эргостерина, влияя тем самым на размножение и рост клеток, усвоение питательных веществ, образование метаболитов.
Количество синтезируемых стеринов зависит от концентрации вводимых дрожжей. При большом засеве образуется больше стеринов, чем при малом. Исследователи связывают потребность дрожжей в кислороде, а в свою очередь, и скорость сбраживания либо с общей концентрацией стеринов, синтезируемых в присутствии данного количества кислорода, либо с относительным содержанием различных стеринов. Так, одни авторы предполагают, что дрожжи, содержащие эргостерина больше, чем эпи- и ланостерина, обладают низкой потребностью в кислороде; другие связывают низкую потребность дрожжей в кислороде с более высоким содержанием дегидроэргостерина по сравнению с эргостерином.
Одна из функций, выполняемых в дрожжах стеринами или ненасыщенными жирными кислотами – структурная. Они участвуют в построении клеточных мембран, в частности митохондриальных. Дрожжевые клетки, выросшие при анаэробиозе в присутствии эргостерина, имеют все мембранозные системы: ядерную, цитоплазматическую и вакуолярную. При этом они хорошо выражены. Структура клеток, растущих в отсутствие эргостерина, отличается неопределенностью внутренних структур. Анаэробно выращенные клетки содержат промитохондрии – структуры со слабой ферментативной активностью, Кроме того, промитохондрии различаются и содержанием липидов. они характеризуются небольшим количеством стеринов, низким содержанием ненасыщенных жирных кислот и высоким насыщенных с короткой цепью.
Аэрация анаэробно выращенных дрожжей в присутствии источника энергии индуцирует быстрый (за 1 – 8 ч) синтез ненасыщенных жирных кислот, стеринов, окислительно-восстановительных ферментов и активизацию дыхания. Клетки начинают делиться, формируя типичные митохондриальные структуры. Энергетический обмен перестраивается с анаэробного на окислительный. Такая перестройка обмена дрожжевых клеток, вызванная аэрацией анаэробно выращенных клеток, получила название дыхательной адаптации.
Дыхательная адаптация включает в себя превращение промитохондрии в функционально полноценные органеллы благодаря созданию цепи переноса электронов. Скорость дыхательной адаптации существенно зависит от состава среды культивирования анаэробной культуры. У клеток, выращенных на слабосбраживаемых субстратах и в присутствии липидных добавок, она выше, чем у клеток, выращенных на глюкозе и истощенных по липидным компонентам (дыхательная активность появляется через 3 – 5 ч после аэрации).
Клетки дыхательного типа заметно отличаются от анаэробных клеток. Аэробные клетки характеризуются повышенной способностью к поглощению кислорода и окислительным процессам, функции брожения в них снижены, в клетках мало гликогена, и они проявляют заметную активность в отношении образования и накопления липидов.
От содержания кислорода в сусле зависит также использование дрожжами азота. С увеличением концентрации кислорода в среде возрастает скорость потребления азотистых соединений дрожжами. В условиях недостатка кислорода азот также потребляется клетками, ноне полностью в них утилизируется. Особенно важно поддерживать в сусле оптимальную концентрацию кислорода при использовании сусла с повышенным содержанием несоложеного сырья.
Кислород является важнейшим регулятором активности ферментов и тем самым в значительной степени определяет особенности энергетического обмена дрожжей рода Saccharomyces. При лимитировании роста под влиянием кислорода гликолиз – основной путь использования углеводов среды. Возрастание содержания кислорода в сусле повышает активность таких ферментов, как фосфофруктокиназа и фосфоглицераткиназа. Деаэрация сусла и сверхокисление его по сравнению с нормальным содержанием кислорода в среде (8 мг/дм3) приводят к снижению ферментативной активности гексокиназы и пируваткиназы, но к более высокой активности фосфоглицераткиназы. Резкое увеличение активности гексокинагзы и фосфофруктокиназы происходит при небольшой аэрации среды. В анаэробно выращенных клетках активность фосфофруктокиназы в 7 раз выше, чем в условиях аэробного роста дрожжей.
Аэрация сусла способствует увеличению активности в дрожжах таких ферментов подготовительной стадии спиртового брожение, как мальтоза и мальтотриаза, но снижению активности алкогольдегидрогеназы.
Несмотря на то, что спиртовое брожение идет в анаэробных условиях, в клетках дрожжей все же функционирует цикл трикарбоновых кислот в виде окислительной ветви до α-кетоглутарата и восстановительной от оксалоацетата до сукцината. Даже небольшие изменения в содержании кислорода в сусле существенно влияют на активность дыхательных ферментов дрожжей.
Слабая аэрация и сверхокисленпе сусла повышают активность цитратлиазы, но снижают активность малатдегидрогеназы. Нормальная аэрация сусла, обеспечивающая растворение 8 мг О2/дм3, способствует возрастанию активности малатсинтазы, NADF-зависимой изоцитратдегидрогеназы, сукцинат- и малатдегидрогеназы; переокисление сусла приводит к проявлению максимальной активности фумаразы. В присутствии кислорода активность в дрожжах ферментов транспорта электронов увеличивается в 3 – 4 раза.
Хотя рост и размножение пивоваренных дрожжей протекают в основном в условиях анаэробиоза, однако они проявляют каталазную активность. По ее величине можно судить об интенсивности процессов дыхания дрожжей во время их роста, в которых участвует каталаза. Снижение концентрации растворенного кислорода в среде приводит к уменьшению активности каталазы в 1,7 раза, что свидетельствует о переходе дрожжей от дыхательного типа к бродящему, Аэрация дрожжевых клеток в воде в течение 10 ч способствовала увеличению активности фермента в 1,3 раза.
Таким образом, в зависимости от концентрации растворенного кислорода в среде активность ферментов дрожжевой клетки может значительно колебаться.
Наличие кислорода в сусле влияет при сбраживании и на образование побочных продуктов жизнедеятельности дрожжей. При аэробиозе количество высших спиртов возрастает и придает напитку «тяжелый» вкус. Количество высших спиртов зависит от интенсивности аэрации, во всех случаях переключения обмена веществ дрожжей с брожения на дыхание уменьшается образование высших спиртов на единицу биомассы дрожжей. Установлена оптимальная концентрация кислорода 9 – 10 моль г/мин для образования изобуганола и изопентанола. Выше этой концентрации количество спиртов уменьшается.
По мнению одних авторов, снижение высших спиртов при аэрации тесно связано с более высокой активностью ферментных систем дрожжей в аэробных условиях. Другие объясняют эту тенденцию более «чистым» процессом спиртового брожения при аэробиозе, в результате чего образуется меньше вторичных продуктов, в том числе и высших спиртов.
Накопление в среде высших спиртов характеризует собой итог синтетической деятельности дрожжей, непосредственно связанной с синтезом клеточного вещества и с теми превращениями в живой клетке, которые обеспечивают ее существование.
Любая обработка сусла (аэрация, перемещение), вызывающая пастеровский эффект, способствует образованию при брожении диацетила. Поскольку увеличение концентрации кислорода в среде сбраживания повышает активность дрожжей, вследствие этого на ранних стадиях брожения образуется больше ацетолактата (прямого Предшественника диацетила), что может отрицательно сказаться на количестве диацетила в пиве. Аэрация на последних стадиях брожения увеличивает содержание диацетила из-за ускоренного распада ацетолактата.
Образование диацетила идет и в отсутствие кислорода, так как в реакции декарбоксилирования α-ацетомолочной кислоты могут участвовать и другие акцепторы водорода. Если в среде их концентрация недостаточна, а ацетолактата много, то в пиве содержится незначительное количество диацетила.
Аэрация сусла способствует образованию повышенных количеств альдегидов, в том числе уксусного, придающих пиву незрелый вкус. Регуляция биосинтеза эфиров имеет особенно большое значение при сбраживании сусла высокой плотности. В этом случае происходит значительное накопление эфиров, что связано с замедлением роста дрожжей из-за недостаточного содержания кислорода в сусле, так как с увеличением плотности последнего растворимость кислорода снижается. В этом случае для регуляции образования эфиров предлагают использовать либо ограниченную аэрацию сусла, либо дрожжи с низкой потребностью в кислороде.
В присутствии кислорода при сбраживании образуется меньше летучих кислот. Например, при увеличении концентрации растворимого кислорода в среде от 6,6 до 18,82 мг/дм3 общее количество летучих кислот снижалось с 1,7 до 0,97 мг/дм3, несмотря на резкое возрастание биомассы, что объясняется превращением в аэробных условиях уксусной кислоты в ацетил-СоА через цикл Кребса.
Однако по мере повышения степени аэрации сусла при брожении возрастает количество α-кетоглутаровой и пировиноградной кислот. Это свидетельствует об изменениях направленности обменных процессов при аэрации в сторону образования более окисленных продуктов метаболизма дрожжей. При повышенной аэрации сусла образование органических кислот при брожении усиливается и соответственно снижается рН пива, что способствует выделению и выпадению в осадок некоторых фракций белков с одновременным оседанием дрожжевых клеток. Это, в свою очередь, положительно влияет на коллоидную и биологическую стойкость готового пива, но в то же время ухудшает пенообразование. Аэрация сусла также положительно влияет на удаление сернистых веществ.
В КемТИППе изучено влияние кислорода на жизнедеятельность отечественных рас пивоваренных дрожжей. Потребность дрожжей в кислороде для рас 11, F, 41, 71 низкая, для рас 70, 776 – умеренная, для рас 8а (М), S-Львовская, 44 – высокая. Дрожжи, характеризующиеся низкой и умеренной потребностью в кислороде, синтезируют при сбраживании большее количество стеринов, чем клетки с высокой потребностью в кислороде.
Снизить потребность дрожжей в кислороде целесообразно не за счет аэрации сусла, а путем аэрообработки дрожжей перед их введением в среду сбраживания, так как в присутствии кислорода и при наличии предшественников синтез стеринов в клетках протекает достаточно быстро. При этом количественный и качественный состав метаболитов, образующихся при сбраживании сусла обработанными дрожжами, является более благоприятным для вкуса и аромата пива. Кроме того, аэрированные дрожжи обладают повышенной удельной скоростью роста, меньшим временем генерации и флокуляции, способностью давать большое количество почкующиеся клеток. Рекомендовано аэрацию дрожжей проводить при температуре 1 – 2 °С в течение 30 – 40 мин в молодом пиве при соотношении 1:2, затем выдерживать их в анаэробных условиях в течение 3 – 4 ч при температуре 5 – 6 °С. В результате аэрации содержание в дрожжах эргостерина увеличивается в 4 – 7 раз и тем самым обеспечивается возможность анаэробного роста популяции пивных дрожжей. После аэрации потребность дрожжей в кислороде снижаетсй и увеличивается на 20 – 25 % их бродильная активность как результат активации в дрожжах α-глюкозидазы на 75 %, β-фруктофуранозидазы на 80 %, фосфофруктокиназы на 65 %, алкогольдегидрогеназы на 100 %, пируватдегидрогеназы на 50 % и других ферментов, Доказано, что аэрация дрожжей не приводит к значительной интенсификации дыхания и конструктивного обмена клеток в отличие от аэрации сусла.
5.3.5. ТЕМПЕРАТУРА
Одним из наиболее доступных способов регуляции метаболизма, дрожжей является температура. Однако поддержание повышенной температуры на стадии главного брожения приводит наряду с интенсификацией сбраживания к ухудшению качества готового пива. Поэтому, поскольку температура стимулирует обмен веществ в микроорганизмах только на начальной стадии культивирования, избежать ухудшения качества пива можно путем прогрева самих дрожжей перед их использованием.
Исследования хлебопекарных дрожжей активированных предварительным прогревом, показали, что в результате снижается величин окислительно-восстановительного потенциала в бродящей среде и создаются более благоприятные условия для брожения. Кроме того, увеличивается бродильная активность.
Прогрев водной суспензии бактерий вас. Sublrtlis 103 при определенных условиях с последующим культивированием дает увеличение амилолитической активности в культуральной жидкости на 20 – 40 %. Оптимальные условия тепловой обработки – темяература 50 °С, продолжительность прогрева 30 мин. При этом скорость биосинтеза увеличивается более чем в 2 раза.
Предварительная термоактивация амилолитических ферментных препаратов позволяет уменьшить дозы ферментных препаратов, применяемых в хлебопекарном и спиртовом производствах. При этом снижается себестоимость продукции, а также сокращается расход зерна на производство солода для спиртовой промышленности. Таким образом, прогрев культуры микроорганизмов перед внесением их в среду приводит к активации всех систем жизнедеятельности клетки и более интенсивному протеканию обменных процессов в ходе культивирования этих микроорганизмов.
С участием автора проведены исследования влияния прогрева пивоваренных дрожжей перед засевом в сусло на их жизнедеятельность.
Объектом исследований служили дрожжи расы 11. Главное брожение сусла проводили как по «холодному», так и по «теплому» режиму.
С учетом характера процесса и качества получаемого молодого и готового пива при использовании активированных дрожжей главное брожение было сокращено на 1 сут, дображивание на 5 – сут.
Результаты сбраживания (рисунок 29) показали, что в условиях эксперимента максимальная активная концентрация дрожжей наблюдается через 2 сут. Эта величина больше по отношению к контрольному образцу на 58 %, для которого максимальный период соответствует 3 сут брожения.
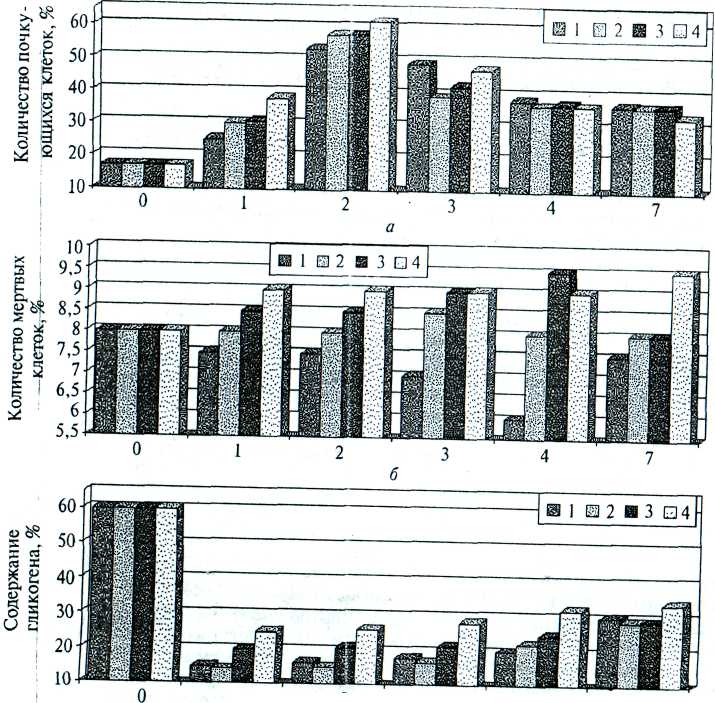
Прогрев пивоваренных дрожжей перед засевом положительно влияет на их способность к размножению. В течение первых суток брожения у активированных дрожжей было заметно увеличение доли почкующихся клеток, в то время как в дрожжах контрольного образца аналогичный прирост числа почкующихся клеток происходит лишь через сутки. Несовпадение по времени максимумов концентрации дрожжей и прироста почкующихся клеток объясняется обратно пропорциональной зависимостью между концентрацией клеток в среде и скоростью их размножения. К концу главного брожения содержание почкующихся клеток в опытном и контрольном образцах становится почти одинаковым, что свидетельствует о переходе процесса в стационарную фазу. Вместе с тем тепловая активация дрожжей заметно не влияет на содержание в среде мертвых клеток.
Продолжительность брожения, сут
Рисунок 29 – Зависимость жизнедеятельности дрожжей от тепловой активности:
а – размножение дрожжей; б – количество мертвых клеток; в – содержание гликогена, г – бродильная активность
1 – контроль; 2 – активация в воде; 3 – активация в 11%-ном растворе сахарозы; 4 – активация в 11%-ном пивном сусле
Анализируя характер изменения содержания гликогена в дрожжах, прогретых перед засевом, следует отметить, что уже через сутки содержание гликогена перестает уменьшаться и начинается его прирост, в то время как в контрольном образце снижение продолжается в течение 2 сут. Это свидетельствует о более быстрой адаптации опытных дрожжей к условиям среды. В опытном образце уже на вторые сутки брожения содержание гликогена достигает 42 % и в течение следующих 2 сут лишь незначительно увеличивается. В контрольном образце максимального значения исследуемый показатель достигает лишь на четвертые сутки, оставаясь все же ниже, чем в опытном образце. В конце брожения содержание гликогена как в опытном, так и в контрольном образцах становится практически одинаковым.
Интенсивность сбраживания углеводов сусла, активность ферментов, катализирующих спиртовое брожение, отражает в значительной степени показатель бродильной активности дрожжей. Его значение существенно увеличивается сразу же после прогрева. Для прогретых дрожжей максимальное значение бродильной активности наблюдается на третьи сутки, а для неактивированных – на четвертые, и оно примерно на 10 % выше.
Средние размеры клеток на вторые сутки брожения в опытном образце заметно меньше, чем средние размеры клеток исходных дрожжей в опыте и клеток суточного роста контрольного образца (табл. 26).
Таблица 26 – Изменение размеров дрожжевых клеток в ходе главного брожения, мкм
Образец |
Продолжительность брожения, сут |
|||||||
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Опыт
|
7,46х х6,09 |
6,62х х6,09 |
6,29х х5,23 |
7,03х х6,27 |
7,26х х6,11 |
7,29х хЗб |
7,29х х6,34 |
|
Контроль |
7,46х х6,09
|
7,31х х5,93
|
6,97х х5,60 |
6,75х х5,45 |
7,26х х5,76 |
7,26х х5,90 |
7,27х х 6,00 |
7,28х х6,20 |
Это свидетельствует о бурном размножении клеток после тепловой активации. Минимальные размеры у дрожжей контрольного образца наблюдаются на третьи сутки, т. е. на сутки позже, чем у опытного, а максимальные средние размеры клеток отмечены на пятые сутки в опытном образце и на шестые – в контрольном.
Хотя наблюдается некоторое уменьшение размеров клеток опытного образца в период активного размножения по сравнению с контролем, к концу брожения размеры первых становятся больше, чем вторых. Это еще раз доказывает благотворное влияние тепловой активации на рост клеток.
5.3.7 МИКРОБИОЛОГИЧЕСКАЯ ЧИСТОТА
Наличие посторонней микрофлоры отрицательно влияет на жизнедеятельность дрожжей. Известны способы обработки дрожжей, освобождающие их от посторонней инфицирующей микрофлоры, различными минеральными кислотами, антибиотиками, в сверхвысокочастотном поле, ультразвуковыми волнами и т. п.
Известен способ обработки дрожжей 1 %-ным раствором серной кислоты, 0,1 – 0,5%-ным раствором уксусной кислоты в течение 10 мин с последующим добавлением щелочи, а также соляной или лимонной кислот. Промывка дрожжей 1 %-ным раствором серной кислоты дает положительные результаты, но несколько угнетающе действует на дрожжи. Поэтому норму введения промытых дрожжей при первом использовании увеличивают на 10 – 20 %.
Обработка дрожжей персульфатом аммония превращает флокулирующие дрожжи в нефлокулирующие. При промывке суспензии дрожжей минеральными кислотами для очистки их от сопутствующих бактерий используют влияние на дрожжи экстремально низкого рН. Заметное ухудшение размножения дрожжей наступает при рН менее 2,6, а бродильной активности — при рН ниже 2,2. Нейтрализация кислоты сразу же после обработки дрожжей несколько уменьшает отрицательное влияние такого воздействия. Поэтому рекомендуется промывать дрожжи раствором фосфорной кислоты с персульфатом аммония при рН 2,8.
После кислотной промывки физиологическая активность дрожжей к концу главного брожения полностью восстанавливается. Наиболее устойчивы к кислотной промывке дрожжи рас 11, 8а (М), 70, S-Львовская. Промывка дрожжей щелочными растворами разрушает карбоксилазу дрожжей, по этому для очистки дрожжей без изменения их свойств используют щелочные или водные препараты из хмеля, а также антибиотики: полимексин, тетратрицин, пенициллин и др.
Качество дрожжей во многом зависит от правильного хранения. В дрожжах, хранящихся под водой, продолжается обмен веществ, хотя они и не размножаются и не сбраживают. Для сохранения свойств дрожжей нужно максимально снизить их метаболизм и ограничить влияние вредных факторов. Израсходовав резервные вещества, дрожжи ослабевают, и наступает их автолиз. Повышение температуры хранения более 4 °С вызывает изменение физиологических свойств дрожжей при новом брожении, понижение их бродильной способности и способности к размножению.
После хранения количество мертвых клеток в дрожжах увеличивается и становится больше 5 %. Производственные дрожжи лучше хранить под водой не более 24 ч. Под молодым пивом дрожжи хорошо сохраняются в течение 4 недель. Имеются сведения о положительном влиянии на дрожжи хранения в фосфатном буфере с рН 5,0 – 5,5, в этом случае срок их хранения увеличивается до 5 недель.
Интерес исследователей привлекает применение серебряной воды в качестве эффективного средства для уничтожения посторонней микрофлоры в дрожжах. Действие ионов серебра на бактериальную клетку хорошо изучено. По действию ионов серебра на дрожжи имеются лишь отдельные работы, где указано, что дрожжи менее устойчивы к серебру, чем плесневые грибы, но более устойчивы, чем бактерии.
Все встречающиеся в пивоварении бактерии и плесневые грибы, кроме их спор, гибнут в течение короткого времени при обработке дозами серебра 0,5 – 0,6 мг/дм3. Наиболее стойкой оказалась пивная сарцина, однако в течение 1 ч микроорганизм погибает.
Но определенные дозы серебра в растворе могут оказывать и стимулирующее действие на рост микроорганизмов. Автором изучена возможность обеззараживания и активации пивоваренных дрожжей воздействием ионов серебра.
Объектом исследования служили производственные дрожжи расы 11. Изучение эффекта воздействия серебра на дрожжи проводили, изменяя его концентрацию в растворе от 0,005 до 0,5 мг/дм3, используя бытовой ионатор ЛК-31.
Проведены сравнительные исследования характера действия серебра на посторонние микроорганизмы и клетки чистых культур дрожжей. Инфицирующими микроорганизмами, как правило, являются дрожжи Sacharomyces.
Результаты действия ионов серебра на клетки культурных и диких дрожжей приведены в таблице 28.
Таблица 28 – Действие ионов серебра на различные виды микроорганизмов
Вид микроорганизма |
Концентрация ионов серебра в воде, мг/дм3 |
||||
|
0 |
0,005 |
0,008 |
0,01 |
0,1 |
Время обработки 24 ч |
|||||
Saccharomyces cerevisiac Saccharomyces uvarum Toruba alba |
++ ++ ++ |
+++ +++ +++ |
+++ ++ ++ |
++ - + - - |
- |
Время обработки 48 ч |
|||||
Saccharomyces cerevisiae Saccharomyces uvarum Toruba alba |
++ ++ ++ |
++ ++ ++ |
++ + - + - |
+ - -- |
- - -
|
Условные обозначения: «++» — рост культуры; «+++» — интенсивный рост культуры; «++ - » — некоторое подавление роста культуры; «+ - » — подавление роста культуры; « - » — отсутствие роста культуры.
Таким образом, изменение концентрации серебра от 0,005 до 0,008 мг/дм3 не вызывает гибели культур. Однако можно отметить, что концентрация серебра в водном растворе 0,005 мг/дм3 стимулирует развитие посторонних микроорганизмов. Концентрация серебра 0,008 мг/дм3 несколько подавляет рост диких дрожжей при обработке производственной культуры в течение 48 ч. На дрожжи Toruba alba концентрация ионов серебра 0,01 мг/дм3 действует летально, одновременно интенсивно подавляя рост пивоваренных дрожжей, а концентрация серебра в воде 0,1 мг/дм3 убивает культурные и дикие дрожжи. Очевидно, оптимальной концентрацией ионов серебра для обработки дрожжей можно считать 0,008 мг/дм3 при продолжительности воздействия 48 ч. Однако в этом случае не удается полностью избавиться от посторонней микрофлоры. Эффективность обработки дрожжей ионами серебра оценивали при сбраживании ими пивного сусла.
Бродильная активность дрожжей, испытавших воздействие ионов серебра, несколько отличается от бродильной активности контрольной пробы. Причем воздействие ионами серебра в концентрации 0,005 мг/дм3 снижает бродильную активность дрожжей третьей генерации на 0,7 – 0,9 г С02 на единицу сухой массы дрожжей (ед. с. м. д.); седьмой генерации — на 0,3 – 0,6 г С02 на ед.с.м.д, а обработка ионами серебра концентрацией 0,008 мг/дм3 и 0,02 мг/дм3. повышает бродильную активность дрожжей на 0,3 – 1 г СО, на ед.с.м.д.
рН сусла, сбраживаемого дрожжами, испытавшими воздействие ионов серебра, ниже рН сусла, сбраживаемого необработанными дрожжами. Несколько быстрее при этом идет накопление спирта.
Содержание спирта в молодом пиве, сброженном дрожжами, испытавшими воздействие ионов серебра концентрацией 0,008 – 0,01 мг/дм3, на 0,4 – 0,6 % выше, чем в контрольной пробе.
Таким образом, дрожжи, обработанные ионами серебра, сбраживают пивное сусло так же, как и в контрольных образцах, в течение 7 сут, но имеют повышенную бродильную активность, что приводит к некоторому увеличению содержания спирта в молодом пиве и снижению его рН.
Лекция 6
СБРАЖИВАНИЕ ПИВНОГО СУСЛА
Основными результатами сбраживания пивного сусла являются снижение концентрации сусла, образование основных и побочных продуктов брожения, флокуляция дрожжей, снижение рН и гН2, повышение температуры.
Состав сусла во время брожения изменяется за счет сбраживания сахаров, потребления веществ сусла на построение новой массы дрожжей, выделения в среду веществ дрожжами в процессе их жизнедеятельности.
СБРАЖИВАНИЕ САХАРОВ
В результате брожения сахаров в пиве накапливаются спирт, диоксид углерода и различные побочные продукты. До 75 % экстракта сусла состоит из сбраживаемых сахаров. Несбраживаемая часть экстракта представлена декстринами, белками и минеральными веществами.
Диффузия сахара в дрожжевые клетки и спирта из клеток в среду как хорошо растворимых веществ зависит фактически только от градиента концентраций. В интервале концентраций сахаров в пивном сусле осмотическое давление изменяется пропорционально содержанию сахара в среде. Благодаря сорбции сахаров дрожжевой клеткой на ее поверхности поддерживается достаточно высокая концентрация питательных веществ, что обеспечивает хорошие условия для диффузии сахара внутрь клетки. При этом уровень адсорбционного равновесия зависит от температуры среды: чем она выше, тем быстрее достигается равновесное состояние.
Отдельные
сахара сусла сбраживаются в определенной
последовательности
в зависимости от скорости диффузии в
дрожжевую клетку.
Быстрее всех сбраживаются фруктоза и
глюкоза. Сахароза инвертируется до
глюкозы и фруктозы в начале брожения
под действием фермента
![]() -фруктофуранозидазы,
находящейся в цитоплазме
дрожжевой клетки.
-фруктофуранозидазы,
находящейся в цитоплазме
дрожжевой клетки.
После
исчезновения в сусле моносахаров дрожжи
начинают потреблять мальтозу,
предварительно гидролизуя ее ферментом
![]() -глюкозидазой
до глюкозы. Мальтотриозу
дрожжи потребляют при главном брожении
и при дображивании.
Но в сусле, богатом моно- и дисахарами,
этого может
и не произойти. Характерно,
что наиболее высокую скорость сбраживания
сахаров
обеспечивают те расы, у которых
максимальная бродильная активность
наблюдается на третьи сутки брожения.
-глюкозидазой
до глюкозы. Мальтотриозу
дрожжи потребляют при главном брожении
и при дображивании.
Но в сусле, богатом моно- и дисахарами,
этого может
и не произойти. Характерно,
что наиболее высокую скорость сбраживания
сахаров
обеспечивают те расы, у которых
максимальная бродильная активность
наблюдается на третьи сутки брожения.
Быстросбраживающие расы по сравнению со среднесбраживающими отличаются большей скоростью усвоения глюкозы и мальтозы в начале процесса, и период, предшествующий началу потребления мальтозы, у последних рас более продолжителен. Для сбраживания пивного сусла, содержащего повышенную концентрацию глюкозы, целесообразно использовать дрожжи 11, 8а(М) – у них подавление активности системы транспорта мальтозы в клетку прекращается при сравнительно высокой концентрации глюкозы 0,7 – 0,8 %. Если в сусле содержится более 1,5 % глюкозы, то уменьшается скорость размножения дрожжей и увеличивается число клеток, ухудшается флокулирующая способность дрожжей в пиве, возрастает концентрация диацетила.
Изменение азотистого состава. Азотистый состав горячего охмеленного пивного сусла для обеспечения оптимального брожения, гармоничного вкуса, букета и стойкости пива должен соответствовать (при содержании общего азота 100 мг /100 см3) следующим примерным количественным пропорциям по фракциям (%): А (высокомолекулярный азот) — 22, В (среднемолекулярный азот) — 11, С (низкомолекулярный азот) — 64.
Недостаток усвояемого азота вызывает увеличение продолжительности главного брожения и повышение в пиве содержания побочных продуктов брожения, особенно высших спиртов.
Во время главного брожения изменяется содержание азотистых веществ из-за потребления, а затем выделения их дрожжевыми клеткам и, образования белково-полифенольных компонентов, выпадающих в осадок при понижении рН и накоплении спирта.
Количество аминокислот сусла при брожении уменьшается пропорционально интенсивности размножения дрожжей. В конце брожения, когда прирост дрожжей прекращается, количество аминокислот начинает увеличиваться вследствие образования аминокислот из белков сусла под действием протеолитических ферментов дрожжей.
При начальном содержании аминокислот в сусле (по азоту) 25 мг/100 см3 в период главного брожения их количество снижается до 13 мг/100 см3, а в конце остается на том же уровне или увеличивается до 15 мг/100см3. При брожении потребляется примерно 25 – 40 % аминокислот сусла и 28 – 48 % общего азота сусла. Содержание общего азота ниже по сравнению с содержанием аминокислот, поскольку часть белков при сбраживании коагулирует и выпадает в осадок вместе с дрожжами.
Несмотря на то что дрожжи могут синтезировать все аминокис лоты, роль прямой ассимиляции их из сусла очень велика. Причем прямое использование аминокислот сусла обеспечивает наиболее быстрый рост дрожжей.
Различные аминокислоты потребляются дрожжами с разной скоростью. В период дображивания в наибольшей степени дрожжами потребляются метионин, серии, цистеин – 49 – 60 % от общего их количества, усвоенного за весь цикл развития. Видимо, эти аминокислоты ответственны не только за биосинтез и действие ферментов, но и за процесс почкования и деления клеток. На всех других стадиях брожения в основном усваиваются глутаминовая кислота, фенилаланин и лейцин. В период логарифмической фазы роста дрожжи потребляют лейцин, лизин, тирозин, аминомасляную кислоту, фенилаланин, глутаминовую кислоту. В этой фазе они усваиваются на 44 – 77 %. Несмотря на то что белковые вещества образуют незначительную часть экстракта (от 3,1 до 5,6 %), они влияют на ценообразование и могут быть причиной помутнения пива.
Изменение белковых фракций в процессе главного брожения незначительно в сравнении с изменением содержания аминокислот. Содержание белковых фракций с молекулярной массой более 12 000, 30 000 и 60 000 при брожении почти не изменяется, но число фракций с молекулярной массой свыше 2600 и 4600 уменьшается.
Низкие температуры при длительной выдержке пива в отделении дображивания приводят к значительным количественным изменениям белковых фракций. В течение первой недели дображивания общее количество азотистых соединений и отдельных белковых фракций уменьшается незначительно, в течение второй недели продолжает уменьшаться содержание общего азота и сокращается число высокомолекулярных фракций. При дображивании имеет значение существенное снижение содержания белковых фракций с молекулярной массой более 2600 и 4600, поскольку именно они склонны к образованию крупных агрегатов с полифенолами и являются источниками помутнения при хранении пива. Доля фракций с молекулярной массой свыше 60 000 уменьшается быстрее при температуре выдержки ниже 0°С. Для получения коллоидностойкого пива выдержку необходимо проводить при более низких температурах.
Изменение азотистого состава сусла в процессе сбраживания частично зависит от действия протеолитических ферментов дрожжей. Обычно активность внеклеточных протеолитических ферментов пивных дрожжей незначительна, но при брожении она возрастает и достигает максимума на третьи-четвертые сутки брожения, а затем несколько снижается. Пептидазная активность проявляется еще трое суток при дображивании, но на четвертые сутки полностью исчезает. Можно ожидать, что определенное значение имеют протеолитические ферменты дрожжей в обеспечении белковой и коллоидной стойкости пива, поскольку активность выделяемых в среду протеиназ и пептидаз влияет на степень ферментативного расщепления белков при главном брожении и дображивании.
Наибольшее потребление дрожжами азотистых веществ сусла происходит в начале главного брожения. Их количество в клетках достигает 40 – 45 % содержания сухого вещества, дальнейшее усвоение клетками азотистых веществ не превышает нескольких процентов.
Изменение водородного показатель. Процессы сбраживания сусла и дображивания молодого пива сопровождаются снижением рН до 4,4 – 4,6 при главном брожении и до 4,2 – 4,4 при дображивании. Сусло до введения в него дрожжей имеет рН 5,3 – 5,6. Снижение рН при сбраживании происходит вследствие образования диоксида углерода и органических кислот. Независимо от рН сусла молодое пиво всегда имеет рН в интервале 4,2 – 4,6, что связано с формированием в пиве в процессе сбраживания буферных систем, в первую очередь фосфатных. В ходе брожения система буферных веществ изменяется, с одной стороны, в результате потребления дрожжами фосфатов, с другой – вследствие образования органических кислот, которые в присутствии соответствующих солей функционируют как буферы. Так, в интервале рН 4,0 – 5,0 буферные системы пива представлены глутаминовой и аспарагиновой кислотами, пептидами, содержащими эти кислоты, а также органическими кислотами. По мере снижения рН молодого пива его буферная емкость уменьшается. Состав затора и способы затирания влияют на буферную емкость сусла. К ее увеличению приводит подкисление затора молочной кислотой, а использование сахара заметно снижает. В последнем случае получают пиво с более низким рН. В сусле с низким рН белки распадаются полнее и буферных веществ накапливается больше. При более высоком рН сусла протеолитический гидролиз белков происходит слабее и буферных веществ в сусле образуется меньше. Снижение рН во время брожения способствует осветлению пива. С увеличением скорости размножения клеток кислотность при брожении нарастает быстрее. Это способствует флокуляции и седиментации дрожжей, что, в свою очередь, приводит к снижению интенсивности брожения. При дображивании активная кислотность пива снижается незначительно. Готовое пиво имеет рН 4,0 – 4,4. Более низкие значения характерны для пива, инфицированного кислотообразующими бактериями. Флокуляция дрожжей. Флокуляция дрожжей в ходе сбраживания сусла во многом определяется используемой расой дрожжей. Преимущество быстросбраживающих рас проявляется также и по флокуляционной способности. Физиологическое состояние дрожжей зависит от содержания в сусле сбраживаемых сахаров, ассимилируемых азотистых соединений. Для проявления метаболической активности и бродильной способности дрожжей важно не общее содержание углеводов в сусле, а количество сбраживаемых углеводов в сусле и их соотношение с ассимилируемыми веществами. Правильный баланс этих веществ в сусле важен и для нормальной флокуляции дрожжей. Флокулирующие дрожжи гораздо чувствительнее к составу среды, чем нефлокулирующие. Углеводный состав сусла существенно влияет на бродильную и флокуляционную способность дрожжей. Сбраживаемые сахара, особенно мальтоза и сахароза, задерживают флокуляцию дрожжей до тех пор, пока содержание их в среде не снизится до определенного критического уровня. При сбраживании дрожжами сусла с концентрацией сухих веществ не выше 14,5 % интенсивность их размножения зависит от содержания сахара и ассимилируемого азота в сусле. Дальнейшее увеличение сахара уже не сказывается на размножении клеток. В слабом же сусле, содержащем достаточное количество ассимилируемого азота, размножение лимитируется только недостатком сахара, и поэтому его добавление увеличивает выход дрожжей. Содержание в сусле недостаточного количества аминного азота (менее чем 200 мг/дм3 в 10 %-ном сусле) ослабляет бродильную активность дрожжей и снижает их флокуляционную способность. Вследствие этого замедляются брожение и дображивание и ухудшается осветление пива. Такое явление может произойти, например, при замене значительной части недостаточно мелко дробленного солода сахаром. Недостаток ассимилируемого азота в сусле может быть вызван также использованием больших количеств несоложеных материалов, так как рис и ячмень содержат гораздо меньше -аминного азота, чем солод. Влияние других факторов на флокуляцию дрожжей в общем можно сформулировать так: факторы, ускоряющие размножение клеток, как правило, затрудняют флокуляцию. Так, чем больше дрожжей вводят в сусло, тем быстрее наступает флокуляция. Брожение при низкой температуре также благоприятствует этому процессу. Образование хлопьев дрожжей и их последующее оседание в ходе сбраживания определяются двумя факторами: образованием на поверхности дрожжей слизистой оболочки и наличием электрических зарядов у дрожжевых клеток. Дрожжевые клетки, попадая в сусло, обволакиваются слизистой пленкой, состоящей в основном из белков, а также полифенольных веществ, нерастворимых солей Са2+, кремниевой кислоты и гумми-веществ. Клеящие свойства оболочки способствуют тому, что дрожжи в конце брожения собираются в хлопья, которые под собственной тяжестью осаждаются на дно. Слизистая пленка на дрожжевых клетках может быть растворена протеиназами дрожжей. Причем если эти ферменты малоактивны, дрожжи так же выпадают в осадок. Если же протеиназы достаточно активны, то они растворяют белки оболочки и дрожжи находятся в сусле во взвешенном состоянии. В зависимости от состояния дрожжей в сусле при брожении они называются либо оседающими хлопьевидными (легко агрегируются), либо пылевидными. Дрожжи первого типа сбраживают сусло неглубоко, дрожжи второго типа обладают высокой сбраживаемостью. Дрожжи, находясь в состоянии покоя, имеют в основном положительный заряд, во время размножения они становятся отрицательно заряженными, а к концу брожения, т. е. при рН 4,2 – 4,6, вновь приобретают положительный заряд. Большая часть белковых веществ сусла заряжена отрицательно, а при переходе через изоэлектрическую точку и при дальнейшем понижении рН пива при обретает положительный заряд. Моментов, способствующих взаимному электростатическому притяжению дрожжей и белков при брожении, может быть два: в начале брожения, когда белки заряжены отрицательно, а дрожжи положительно; в конце брожения, когда складывается обратная картина. В первом случае дрожжи находятся в стадии размножения и их немного, количество образующихся хлопьев незначительно. Во втором же случае они соединяются очень интенсивно и выпадают в осадок в значительном объеме.
ОБРАЗОВАНИЕ АРОМАТИЧЕСКИХ И ВКУСОВЫХ КОМПОНЕНТОВ ПИВА
В процессе сбраживания сусла наряду с основными продуктами брожения — этанолом и диоксидом углерода благодаря действию ферментативного комплекса дрожжей образуются побочные продукты. Содержание некоторых из них возрастает с увеличением продолжительности процесса. Другие накапливаются до максимального количества, а затем их содержание уменьшается вследствие сложных превращений.
Содержание метаболитов в пиве зависит от расы дрожжей, их физиологического состояния и условий функционирования клеток, но в значительной степени определяется интенсивностью азотистого обмена дрожжей и скоростью их размножения. Содержание побочных продуктов брожения также зависит от технологии сбраживания.
Регулирование образования продуктов метаболизма дрожжей, определяющих вкус и аромат пива, имеет большое значение для получения напитка высокого качества.
Среди составных компонентов пива огромную роль в создании характерных аромата и вкуса игра ют летучие вещества: эфиры, диацетил, высшие спирты, кислоты, альдегиды, а также серосодержащие соединения.
Значительную часть из побочных продуктов брожения составляют высшие спирты, влияющие на вкус и аромат готового пива даже в низких концентрациях. Образование высших спиртов начинается сразу же после начала брожения. В наибольшем количестве из высших спиртов образуется изопропанол – 70 %. На оставшиеся 30 % высших спиртов приходятся пентанол – 44 мг/дм3, 2,3-бутанол – 4, пропанол – 3, триптофол – от 0,16 до 10, тиразол – от 4 до 10, фенилэтиловый спирт – от 10 до 40 мг/дм3, следы изопентанола. Совокупность высших спиртов представляет собой сивушное масло. Интенсивное образование высших спиртов происходит при 30 °С. В диапазоне температур 13 – 15 °С содержание высших спиртов увеличивается в 1,1 – 1,3 раза по сравнению с «холодным» режимом. Повышение температуры особенно заметно влияет на содержание изоамилола, амидола, пропанола и изобутанола. Между концентрацией спиртов и составом сусла имеется линейная зависимость.
Очень важное значение имеет содержание в сусле источников усвояемого азота, необходимого для нормального роста дрожжей, особенно аминокислот. Различные аминокислоты по-разному влияют на образование высших спиртов. Потребление дрожжами одних аминокислот сусла не ведет к образованию высших спиртов, использование других – изменяет их концентрацию. Разные сорта ячменя могут быть причиной образования в пиве разных количеств высших спиртов, что зависит от содержания в сырье углеводов и аминокислот. Обнаружено, что сивушного масла при брожении образуется меньше, если вместо аминокислот использовать легкоусвояемый источник азота, например аммонийные соли или аспарагин, Усиление аэрации сусла приводит к усилению образования высших спиртов. С увеличением нормы вводимых дрожжей количество высших спиртов также увеличивается.
Органические кислоты, синтезируемые в процессе брожения, способствуют снижению рН и коагуляции вещества пива. От органических кислот и их солей в некоторой степени зависит вкус пива.
Муравьиная кислота содержится в пиве в количестве 20 – 40 мг/м3. Она может также образовываться при расщеплении жиров, как и молочная кислота. Содержание в разных сортах пива молочной кислоты составляет 40 – 280 мг/дм3.
В пиве содержатся эфиры: этилацетат 10 – 20 мг/дм3, имеющий фруктовый запах и усиливающий горький вкус пива; этилформиат – 0,8 мг/дм3, следы амилацетата и изометилоктана, эфиры не летучих кислот 39—52 мг/дм3. Общее количество сложных эфиров составляет 35 – 83 мг/дм3. Пиво с повышенным содержанием эфиров имеет грубый вкус.
Уровень кетонов в пиве зависит от скорости, с которой они метаболизируются дрожжами.
Диацетил является наиболее важным компонентом пива, образуемым дрожжами, так как он определяет зрелость и качество напитка. Содержание диацетила различно в пиве разных типов.
Пиво с нормальным вкусом должно содержать ацетоина 6,10 мг/дм3, диацетила 0,2 – 0,46, 2,3-бутиленгликоля 400 – 500 мг/дм3. Ацетоин придает пиву плесневый и затхлый привкусы, а 2,3-бутиленгликоль в больших количествах – выраженную горечь, но поскольку пороговая концентрация его довольно высока, то присутствие последнего практически не влияет на вкус пива. Диацетил формирует неприятный вкус и, кроме того, отрицательно действует на дрожжи: энергия размножения дрожжей обратно пропорциональна, а содержание мертвых клеток прямо пропорционально концентрации диацетила.
Дрожжи в наиболее активной фазе быстро редуцируют диацетил в ацетоин и 2,3-бутиленгликоль. При этом концентрация диацетила, значительно большая, чем должна быть в пиве, снижается почти мгновенно. Подсчитано, что потенциальная скорость удаления диацетила в течение брожения в 10 раз выше скорости его образования из ацетолактата. На последних стадиях брожения диацетил еще образуется, но общая его концентрация уменьшается.
Во время брожения концентрация диацетила в среде близка к нулю. На этом основании считают, что кетоны потребляются дрожжами в таких же количествах, в каких образуются. После удаления дрожжей из сбраживаемого сусла уровень диацетила увеличивается и становится относительно высоким. Добавляя дрожжи в среду, быстро снижают содержание кетонов.
При повышенных количествах дрожжей содержание диацетила интенсивно нарастает в течение первых суток брожения, затем замедляется, а с третьих суток быстро снижается. На конечных фазах брожения дальнейшее превращение диацетила преобладает над его синтезом. Для многих рас дрожжей в конце брожения содержание диацетила в молодом пиве одинаково: 1,0 – 1,1 мг/дм3.
Удаление диацетила из пива (редукция) зависит от активности дрожжей, их способности эффективно восстанавливать диацетил. Расы пивоваренных дрожжей значительно различаются по этой способности. Для каждой расы эффективность редукции диацетила зависит от физиологического состояния дрожжей.
Редукцию диацетила ускоряет повышение температуры. Так, при 20 °С она проходит за 1 – 2 ч, при 3 – 4 °С — в течение нескольких дней и при 0 °С — в течение нескольких недель. В целом поддержание высокой температуры при главном брожении дает низкий уровень диацетила.
Перемешивание сбраживаемой среды механическим способом (циркуляцией) усиливает образование ацетолактата, но, несмотря на это, во время созревания пива ускоряется удаление диацетила. При этом большое значение имеет распределение дрожжей в пиве: плохо диспергированные или флокулирующие дрожжи удаляют диацетил гораздо хуже, чем хорошо диспергированные. Аэрация не увеличивает содержание диацетила в пиве, но повышает активность дрожжей, и поэтому на ранних стадиях брожения образуется больше ацетолактата. Это может отрицательно повлиять на количество диацетила в пиве, а, следовательно, на качество пива.
Аэрация на последних стадиях брожения увеличивает содержание диацетила в пиве из-за ускоренного распада ацетолактата. Это самая вероятная причина увеличения количества диацетила в пиве.
Использование несоложеных материалов может повысить образование диацетила, так как в сусле, полученном с использованием не соложеных материалов, с дефицитом по ассимилируемому азоту и другим питательным веществам, вырастают менее активные дрожжи. В этих случаях конечная степень сбраживания низка и снижение количества диацетила в пиве достигается добавлением фермента глюкоамилазы.
Присутствие сернистого ангидрида, сероводорода и меркаптанов считают основной причиной появления неприятного (незрелого) вкуса молодого пива. Для синтеза этих соединений дрожжи используют серу из сульфатов, сульфитов и азотистых соединений, содержащих серу. Их количество зависит от качества сырья, интенсивности аэрирования и кипячения охмеленного сусла. Но они могут образоваться в ходе технологического процесса, например, при реакции метионина с карбонильными соединениями, при метаболизме дрожжей и других микроорганизмов. Сера выделяется из сусла в виде грубых и тонких осадков, при брожении в результате изменения рН, температуры и частично превращается в летучие соединения, которые удаляются с газами при брожении. Содержание SO2 в пиве составляет 10 – 20 мг/дм3, H2S 42,6 – 47,8 мкг/дм3, меркаптанов 5 – 15 мг/дм3. Из последних ухудшают вкус пива диметил сульфид, этилмеркаптан и др. Их содержание в пиве составляет 0,5 – 0,97 мг/дм3. Если брожение протекает медленно, то в бродильные газы переходит больше сероводорода, чем при быстром брожении. Образование меркаптанов поддерживают взвеси, попавшие в сусло. Вредное влияние серосодержащих соединений можно снизить аэрированием охмеленного сусла и исключить путем обильного осаждения грубых и тонких взвесей.
СВЯЗЫВАНИЕ ДИОКСИДА ВОДОРОДА
Углекислый газ СО2 в достаточном количестве благотворно действует на вкусовые свойства и придает пиву вязкость, а также приятный освежающий вкус, способствует пенообразованию, предохраняет его от контакта с воздухом, в некоторой степени консервирует, сдерживая развитие посторонней вредной микрофлоры. Пиво, не достаточно насыщенное СО2, имеет плохой, выдохшийся вкус.
Насыщение пива углекислым газом ограничено. Оно может содержать только такое количество СО2, которое допускают химический состав и его физические свойства.
На стадии главного брожения в молодом пиве накапливается до 0,2 % СО2. Во время дображивания содержание его должно быть повышено до такой степени, чтобы в готовом пиве после выдержки и фильтрования содержалось не менее 0,3 %. Такое дополнительное насыщение пива СО2 может быть обеспечено за счет сбраживания в этот период 1 % экстрактивных веществ. Поэтому процесс главного брожения ведут таким образом, чтобы в молодом пиве осталось несброженным примерно 1 % сахаров.
Растворимость СО2 в жидкости подчиняется закону Генри, в соответствии с которым при постоянной температуре концентрация газа, растворенного в жидкости, прямо пропорциональна давлению газа, находящегося с ней в равновесии. Например, при повышении температуры на 1 oC объем СО2 при том же давлении снижается на 0,01 %. И наоборот, при повышении давления на 0,01 МПа растворяется на 0,04 % больше углекислого газа.
Степень насыщения пива СО2 зависит от температуры и давления: в период дображивания температура 0 – 2 °С и давление 0,30 – 0,45 МПа. В этих условиях полное насыщение пива СО, заканчивается уже за 8 суток, т. е. на стадии собственно дображивания. Осветление, формирование вкуса и аромата практически только начинаются после того, как процесс насыщения пива СО2 будет закончен. Этим и вызвана необходимость выдержки пива в отделении дображивания.
Карбонизированное пиво имеет избыток СО2, который можно удалить механическим воздействием. Основное количество СО2 может быть удалено лишь изменением давления и температуры.
Таким образом, в пиве диоксид углерода присутствует в трех формах: газообразной, растворенной и связанной.
Давление СО2 в пиве обусловливается подвижным равновесием газовой и растворенной форм СО2. Диоксид углерода плохо растворяется в бродящем сусле, в связи, с чем он быстро насыщает среду и затем адсорбируется на поверхности дрожжевой клетки, образуя тесно связанный с ней газовый пузырек. Адсорбированный диоксид углерода препятствует поступлению питательных веществ в клетку и снижает скорость брожения. При достижении газовым пузырьком СО2 определенного размера он всплывает вместе с дрожжевой клеткой и, дойдя до поверхности, сливается с воздушной средой, а клетка опускается в бродящую жидкость и процесс повторяется.
Диоксид углерода в газообразной и растворенной формах взаимодействует также с веществами пива – спиртами, сахарами, кислотами, солями, а также с белками, хмелевыми смолами и красящими веществами и др. Эти компоненты будут определять степень связывания и насыщения пива СО2. Форма связывания углекислого газа в пиве может быть физико-химической и химической.
Физико-химическое связывание СО2 носит адсорбционный характер и зависит от химического состава и физических свойств пива. Тонкорассеянные в пиве коллоиды, такие, как декстрины, белки, пектиновые вещества и хмелевые смолы, имеют очень большую общую поверхность и поэтому высокую сорбционную способность. Следовательно, объем связанного этими соединениями СО2 зависит от размера площади поверхностей этих веществ и тем самым от их общего содержания в пиве.
Находясь в растворенном состоянии, диоксид углерода образует угольную кислоту, молекула которой является диполем и поэтому способна к межмолекулярному взаимодействию. При рН 4,4 – 4,6 коллоидные белковые частицы пива обладают положительным зарядом, а молекулы угольной кислоты – отрицательным. Поэтому они будут адсорбироваться на поверхности молекул белка). Вполне вероятно, что таким способом может быть связано значительное количество СО2.
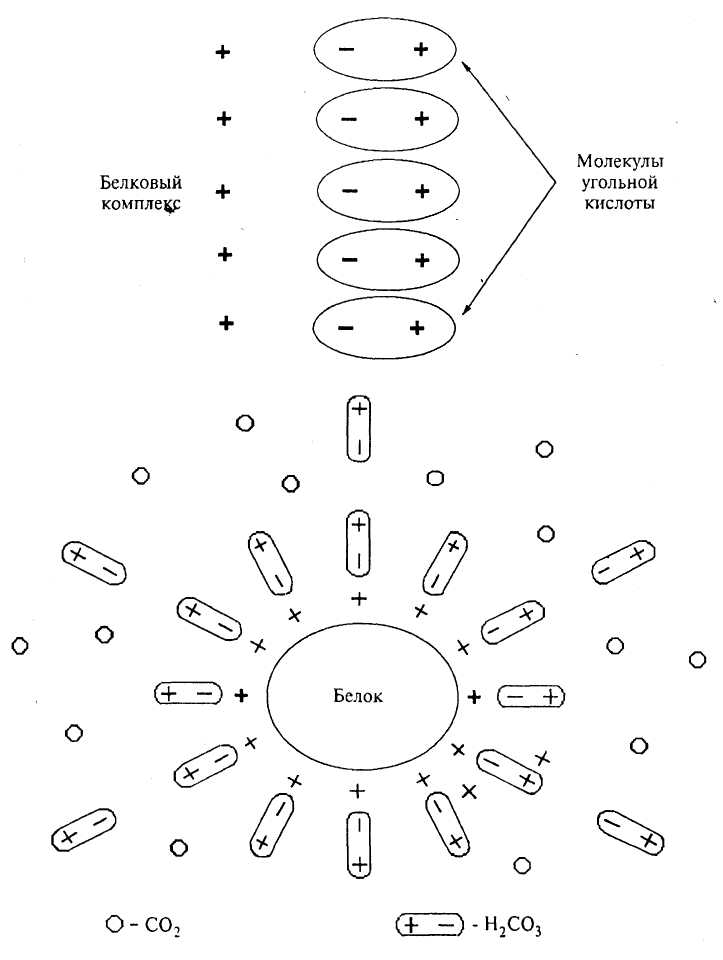
Рисунок – Физико-химическое связывание диоксида углерода в пиве
С физико-химической точки зрения на эффективность связывания СО2 в пиве влияет его вязкость. Чем больше этот показатель, тем большее сопротивление оказывает жидкость при выделении пузырьков СО2. Последнее возможно только тогда, когда пузырьки достигнут определенного размера. Вязкость пива повышают главным образом сахара, декстрины, белки и пектиновые вещества.
Побочные продукты брожения являются также коллоидно-растворимыми веществами. Они покрывают выделяющиеся пузырьки углекислого газа адсорбционными пленками и не позволяют им агрегироваться.
Диоксид углерода в виде угольной кислоты может вступать и в химические реакции с компонентами пива. Угольная кислота, являясь двухосновной, способна взаимодействовать с гидроксилсодержащими веществами и образовывать ди- и моноэфиры угольной кислоты.
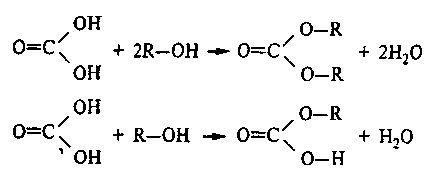
Полные эфиры угольной кислоты обладают достаточной хими ческой стойкостью, и эти реакции доказаны для метилового и этилового спиртов, глюкозы и сахарозы. Теорию химического связывания угольной кислоты поддерживают виноделы. Они утверждают, что такие соединения образуются в процессе брожения благодаря эстеразной активности дрожжей. Но они неустойчивы при нормальном давлении, а устойчивы в условиях хранения пива под давлением, снижение давления приводит к их разложению и выделению пузырьков СО2.
Количество связанного диоксида углерода увеличивает присутствие в пиве продуктов автолиза дрожжей, белков и аминокислот. Большинство этих соединений обладают поверхностно-активными свойствами, являясь гидрофильными коллоидами. К последним относятся также спирты и альдегиды. Диоксид углерода может также химически связываться с азотистыми веществами по аминогруппам в белках, пептидах, аминокислотах, которые можно отнести к амфотерным электролитам, имеющим положительный заряд.
ОСВЕТЛЕНИЕ ПИВА
Процесс осветления пива основан на гравитационном разделении жидкой и твердой фаз. Он протекает непрерывно. В большинстве случаев осаждению предшествуют физико-химические процессы, и часть компонентов пива переходит в нерастворимое состояние, образуя взвеси. Когда частицы взвесей достигают определенного размера, они постепенно оседают и пиво осветляется.
Молодое пиво представляет собой полидисперсную гетерогенную систему с различной степенью дисперсности содержащихся в ней частиц. При перекачке в отделение дображивания пиво непрозрачно, поскольку содержит определенное количество дрожжевых клеток, различных взвешенных частиц.
Крупные частицы оседают быстро, скорость оседания мелких очень низка, поэтому необходима длительная выдержка молодого пива. При понижении температуры пива в подвале до 0—2 °С количество частиц еще более возрастает, поскольку в таких условиях белковые вещества более активно взаимодействуют с полифенольными соединениями и частично выпадают в осадок. Таким образом, с точки зрения удаления веществ, способствующих возникновению коллоидного помутнения, процесс осветления является благоприятным для качества готового пива.
Осветление пива происходит только после окончания процесса дображивания и после выравнивания температуры во всем объеме. Во время дображивания нестабильные коллоидные вещества из-за постоянного движения пузырьков углекислого газа, дрожжей чаще сталкиваются друг с другом, взаимодействуют и коагулируют. Частично они адсорбируются на поверхности дрожжевых клеток и увлекаются ими в осадок, частично — пузырьками СО2.
ФОРМИРОВАНИЕ ВКУСА И АРОМАТА
Формирование вкуса и аромата пива является наиболее важным процессом при дображивании. В этот период грубые вкус и запах молодого пива превращаются в тонкие, приятные, законченные вкус и аромат готового пива. В основе созревания пива лежат преимущественно окислительно-восстановительные превращения веществ пива. Степень окисления компонентов пива обусловлена количеством в нем кислорода, длительностью его воздействия и противодействием редуцирующих веществ, содержащихся в пиве.
В процессе дображивания дрожжи адсорбируют горькие вещества, за исключением изогумулона, поэтому горечь пива смягчается.
Главную часть продуктов обмена веществ дрожжей, претерпевающих сложные химические превращения в созревающем пиве, составляют альдегиды. Эти вещества наиболее легко подвергаются окислительно-восстановительным реакциям, в результате которых образуются кислоты, спирты, эфиры. Эфирообразование может происходить как за счет реакции этерификации между спиртом и кислотой, так и за счет реакции между альдегидами. Вторая реакция более вероятна, поскольку об этом свидетельствует снижение при дображивании содержания альдегидов. С этиловым спиртом альдегид превращается в диэтилацеталь, а при конденсации — в альдоль. Может происходить также окислительно-восстановительный, когда две молекулы альдегида образуют спирт и кислоту.

Все эти процессы играют существенную роль в формировании аромата и вкуса пива и дают основание считать количественное содержание альдегидов в пива показателем степени его зрелости.
Выделяющийся при дображивании диоксид углерода уносит из пива летучие вещества и среди них соединения серы, например, H2S.
Запах пива зависит также от содержания и природы других ароматических веществ, образующихся при брожении. В зависимости от продолжительности выдержки пива количество кислот увеличивается на 20 – 25 %, эфиров —на 25 – 30%. В молодом пиве содержится 12,6 мг/дм3 кислот и 4,7 мг/дм3 эфиров, в 14-суточном пиве — соответственно 15,6 и 6,15, в 28-суточном — 16,9 и 6,80 мг/дм3.
1 – диацетил, ацетилальдегид, сульфиды; 2 – этиловый спирт, сложные эфиры, высшие спирты, органические кислоты (уксусная, янтарная); 3 – α-аминный азот; 4 – веществ, которые содержатся в солоде и сусле
Рисунок– Изменение характера содержания некоторых компонентов пива во время главного брожения и дображивания.
При дображивании общая восстановительная способность пива достигает конечной выровненной величины. Она свидетельствует о стойкости пива к изменению окислительно-восстановительного потенциала при окислении. Восстановительную способность пива определяют отдельные редуцирующие вещества. Наиболее выразительно проявляются в готовом пиве редуктоны, меланоидины, соединения с SH-группой, полифенольные, горькие вещества и некоторые другие. С точки зрения окислительно-восстановительных процессов эти вещества разделяются и определяются по скорости окисления их кислородом, присутствующим в пиве, что отражается на качестве напитка. Например, редуктоны и меланоидины реагируют с кислородом быстрее и предохраняют таким образом от окисления остальные редуцирующие вещества пива, и продукты их окисления не являются вредными для вкуса и стабильности пива. Наоборот, окисление соединений с SH-группами, полифенолов и горьких веществ отрицательно влияет на вкус и коллоидную стабильность пива.
Установлено, что азотистые вещества существенно изменяются при дображивании. Очевидно, вначале это связано с жизнедеятельностью дрожжей, а на последующих стадиях выдержки азотистый состав пива изменяется преимущественно за счет автолиза клеток. При автолизе происходит ферментативное разрушение дрожжевой клетки под действием собственных ферментов, которое включает гидролиз гликопротеинов клеточной оболочки, а также протоплазматических структур и выделение продуктов распада в окружающую среду. На автолиз дрожжей влияют температура, рН, гН2. Оптимум рН автолиза дрожжей 4,0 – 4,4. Процесс протекает очень медленно под действием протеолитических ферментов при обеднении среды питательными веществами.
При автолизе наблюдаются цитологические изменения дрожжевых клеток: происходит гидролиз протоплазмы, при этом вакуоли увеличиваются, а количество и размер внутриклеточных гранул и глобул уменьшаются, возрастает зернистость цитоплазмы. Автолитические процессы ведут к нарушению основного пути клеточного метаболизма, что приводит к отмиранию дрожжевой клетки. Оболочка клетки гидролизуется, вследствие чего содержимое клетки выделяется в окружающую среду. Одновременно разрушаются субклеточные структуры в дрожжах, что вызывает выделение в среду клеточного сока.
Продуктами автолиза являются пептиды, аминокислоты, витамины, компоненты нуклеиновой кислоты, эргостерол, жиры, ферменты (пептидаза, протеаза, инвертаза). Многие из них являются поверхностно-активными веществами и положительно влияют на пеностойкость пива.
Общее количество белка при дображивании снижается на 25 %, уменьшается содержание, причем значительно, почти всех аминокислот, за исключением пролина. Например, содержание аланина и γ-аминомасляной кислоты снижается на 75 – 80 %, тирозина — на 90 % и т. д. Изменение состава белка за счет автолиза влияет на качество пива, его органолептические свойства и коллоидную стойкость. Эти вещества придают пиву бархатистую консистенцию и способствуют полноте вкуса. Процессы, происходящие с веществами от сырья до готового пива, перечислены ниже
Процесс |
Вещества |
Конечные продукты |
Окислительно-восстановительный |
Полифенолы, азотистые вещества, углеводы, органические кислоты, альдегиды, спирты |
Кетозы, хиноны, альдегиды, кислоты, спирты, диоксид углерода |
Этерификация |
Спирты, кислоты, альдегиды |
Эфиры |
Меланоидинообразование |
Азотистые вещества, карбонильные соединения, полифенолы |
Альдегиды, кислоты, спирты, редуктоны, меланоидины |
Гидролиз |
Азотистые вещества, липиды, крахмал, некрахмалистые полисахариды |
Белковые фракции по Лундину А, В, С, пептиды, аминокислоты, моносахара, кислоты, декстрины, олигосахариды |
Конденсация |
Азотистые вещества, полифенолы, карбонильные соединения |
Полимеризованные полифенолы, белково-полифенольные и белково-углеводные комплексы |
Контрольные вопросы и задания. 1. Какие основные процессы происходят при затирании? Какие из них являются определяющими с точки зрения качества сусла и пива. 2. Назовите стадии осахаривания крахмала и дайте их определение. Обоснуйте их последовательность. 3. Охарактеризуйте механизм воздействия в отдельности α- и β-амилаз на амилозу, амилодекстрин, а также совместное действие амилаз на крахмал. Какие отличительные особенности имеет процесс в последнем случае? 4. Из чего состоят углеводы сусла? Насколько полно параметры затирания обеспечивают возможность для действия амилолитических ферментов? Обоснуйте на конкретных примерах (рН, температуры и т. д.). 5. Как изменяются некрахмалистые полисахариды при затирании? 6. Какие протеолитические ферменты действуют при затирании и почему? 7. Какое качественное различие имеется в продуктах гидролиза белков, образующихся при солодоращении и затирании? 8. Какие продукты гидролиза белков при затирании имеют технологическое значение? Дайте их классификацию и охарактеризуйте каждую фракцию азотистых соединений. 9. Какие соединения создают кислотность заторов? Какие процессы способствуют их накоплению? 10. Какие вещества затора определяют его буферность? 11. Какие соединения солода и ячменя не претерпевают изменений при затирании? 12. Обоснуйте необходимость стерилизации сусла и инактивации в нем ферментов. Как и в течение какого времени протекают эти процессы? 13. Укажите стадии осаждения белков при кипячении. Насколько полно протекает каждая из стадий и почему? 14. Какие факторы влияют на окисление полифенольных веществ при кипячении? Назовите отличительные особенности этих групп полифенолов. 15. В чем заключается механизм растворения α-и β-горьких веществ в сусле? Отразите химизм реакции. Назовите продукты этого процесса. Какие соединения определяют горечь сусла и пива? 15. Какие процессы и соединения из сырья и образующиеся при кипячении обусловливают повышение цветности охмеленного сусла? Влияют ли на нее технологические факторы кипячения сусла с хмелем? 16. Какие изменения происходят с хмелевыми эфирными маслами при кипячении? 17. К каким микроорганизмам относят пивоваренные дрожжи? 18. Какие признаки отличают верховые и низовые дрожжи друг от друга (механизм сбраживания раффинозы, физиология поведения при брожении, температура брожения, способность агглютинировать и т. д.)? 19. Назовите элементы структуры дрожжевой клетки, их функции и составляющие химические соединения. 20. Какое вещество накапливается в дрожжах при брожении? Как содержание этого вещества характеризует сбраживающую способность? Какое соединение сусла необходимо для его накопления? 21. Как размножаются пивоваренные дрожжи?22. Назовите фазы роста дрожжевой культуры и охарактеризуйте их. Назовите химический состав дрожжей. 23. Расщепление каких соединений является основным для жизнедеятельности дрожжей? 24. Дайте сравнительную характеристику дыхания и брожения: по промежуточным стадиям; по конечным продуктам. 25. Охарактеризуйте процесс спиртового брожения по фазам, промежуточным и конечным продуктам. 26. Какова сбраживаемость различных видов сахаров? Назовите ферменты, переводящие сахара из несбраживаемого в сбраживаемое состояние. Какова проницаемость клеточной оболочки для сахаров? 27. Назовите пути потребления аминокислот дрожжами. Какие аминокислоты наиболее важны для синтеза белка? 28. Как изменяется содержание азотистых веществ в сусле во время сбраживания? 29. Какое значение имеют минеральные вещества для жизнедеятельности дрожжевой клетки? Приведите примеры. 30. С чем связано снижение концентрации бродящего сусла? 31. Какие продукты брожения являются определяющими для создания вкуса и аромата пива? 32. Почему рН молодого пива почти не зависит от рН исходного сусла? 33. Как изменяется буферная система пива по отношению к таковой в сусле? 34. Назовите пути образования кетосоединений при брожении? Как они влияют на качество пива? 35. Какие факторы определяют образование альдегидов и кетонов при брожении и каковы пути снижения их содержания в пиве? 36. Как образуются сложные эфиры при сбраживании пивного сусла? 37. Как изменяется окислительно-восстановительный потенциал при сбраживании? 38. Какие изменения происходят с полифенолами при брожении? В чем причина этих изменений? 39. С чем связано снижение интенсивности цвета в процессе сбраживания сусла? 40. Какие процессы происходят при дображивании? Происходят ли эти процессы параллельно или последовательно и почему? 41. В чем заключается собственно дображивание и каковы предпосылки для его осуществления? 42. Назовите способы связывания диоксида углерода в пиве. 43. Какие процессы протекают при формировании вкуса и аромата пива в процессе дображивания? 44. Что такое восстановительная способность пива и какими соединениями она обусловлена? 45. Как окисление конкретных веществ пива отражается на его вкусе? 46. Какие изменения претерпевают азотистые соединения при дображивании? Охарактеризуйте влияние этих изменений на качество готового пива.
Лекция 7
