
- •Глава 1 особенности структуры химического состава зерновых культур, перерабатываемых в пивоварении
- •Тема 2 химический состав ячменя
- •Тема 3 азотистые вещества, витамины и минеральные вещества ячменя и солода
- •Тема 4 полифенольные вещества ячменя и солода
- •Тема 5 Химический состав хмеля
- •Глава4 основные процессы при производстве солода
- •Глава 5 основные процессы при приготовлении пива
- •Глава 6 биологическая стойкость пива
- •Глава 7 коллоидная стойкость пива
- •Глава 8 состав и свойства пива
Тема 3 азотистые вещества, витамины и минеральные вещества ячменя и солода
План
1Белки: состав, строение и свойства
2 Нуклеиновые кислоты
3Витамины
4 Минеральные вещества: соли и оксиды
Азотистые вещества ячменя представлены в основном высокомолекулярными соединениями - белками, в меньшей степени - низкомолекулярными веществам органической и неорганической природы.
Белки. Белковые вещества ячменя играют важную роль в технологических процессах пивоварения и влияют на качество готового пива: его вкус, цвет, пенистость и стойкость при хранении. Продукты гидролиза белков -пептиды и аминокислоты - необходимы для питания дрожжей при брожении, они участвуют в сложных процессах метаболизма дрожжевой клетки.
Белки представляют собой длинные цепи остатков аминокислот, соединенных между собой пептидными связями (-СО-NH-), и состоят из следующих элементов: углерода, водорода, кислорода, азота и серы в соотношениях, %: С 50,6-54,5; Н 6,5-7,3; О 21,5-23,5; N 15,0-17,6; S 0,3-2,5. Кроме того, во многих белках содержатся также Fe2+, Fe3+, Co2+, Ca2+, Mg2+ и др. К аминокислотам, составляющим основу белков, относятся следующие: аланин, валин, лейцин, изолейцин, глицин, фенилаланин, аргинин, лизин, гистидин, аспарагиновая и глутаминовая кислоты, серин, треонин, тирозин, триптофан, цистеин, цистин, метионин, пролин, оксипролин.

Пептидные связи в белках образуются при взаимодействии α-аминогруппы одной из аминокислот с α-карбоксильной группой другой с отщеплением воды.
На боковых цепях аминокислот находятся обычно важнейшие функциональные группы белков: сульфгидрильная - SH; дисульфидная – S-S-; аминная - NH2; карбоксильная - СООН; гидроксильная - ОН и т. д. Эти группы обусловливают реакционную способность белка и его отдельных участков. В_ячмене белки, как правило, соединены с крахмалом, полисахаридами, полифенолами, ионами металлов и др.
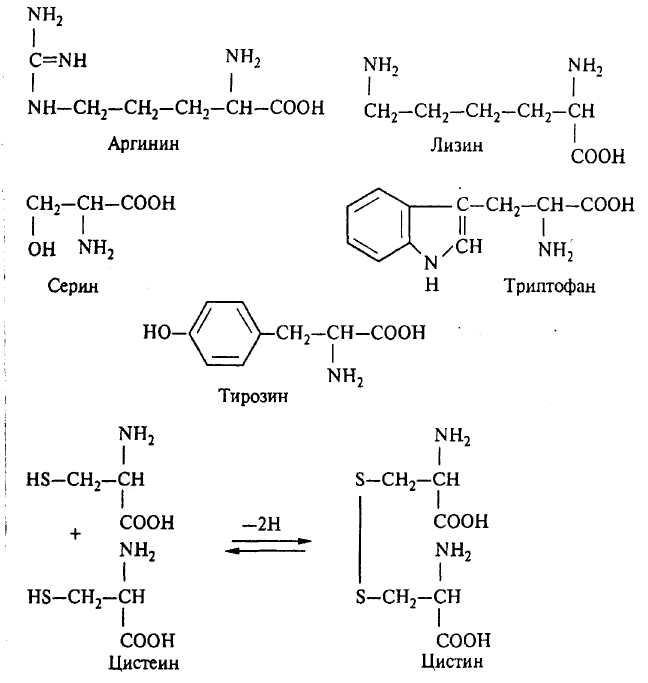
Белки легко осаждаются минеральными кислотами: салициловой, пикриновой, фосфовольфрамовой и фосфомолибденовой, а также солями тяжелых металлов. С рядом соединений они дают характерные реакции: биуретовую, ксантопротеиновую и т. д. На этом основаны многие количественные и качественные методы определения белка. Белки обладают способностью связывать значительные количества воды - гидратироваться. Процесс гидратации состоит в связывании дипольных молекул воды с ионными группами в белках.. I
Форма белковой молекулы может быть весьма различной: от шарообразной до вытянутой. В первом случае - это глобулярные белки, во втором фибриллярные. Глобулярные белки (основная группа белков) имеют молекулярную массу 104--105, размер 1,5-6,0 нм. Белки молекулярной массой 105 содержат 800-850 аминокислотных остатков, длина каждого остатка составляет приблизительно 0,35 нм. Пространственная конфигурация белков определяет их биологическую активность, лежит в основе ферментативных, гормональных и других свойств. Различают четыре уровня пространственной конфигурации белковой молекулы: первичная - соединение аминокислот в линейной цепи; вторичная - пространственное расположение полипептидной цепи в виде α-спирали, β-складчатого слоя; третичная - специфическое укладывание α-спирали в виде глобулы или фибрилл; четвертичная -соединение нескольких частиц белка с третичной структурой в одну укрупненную.
Наличие всех видов структур у белков необязательно. Часто отсутствует четвертичная, может быть нарушена спиралевидная конфигурация цепей либо третичная структура.
Поддержание характерной пространственной макроструктуры частиц белка осуществляется за счет взаимодействий участков цепей и образования между ними поперечных связей: дисульфидных, гидрофобных, электростатических водородных (рисунок 4).
Рисунок 4 - Связи,
стабилизирующие пространственную
структуру
белков
1
— ионная
связь; 2—
водородная
связь; Зи
4— некоторые
типы ван-дер-ваальсовых взаимодействий;
5
—
дисульфидный мостик (ковалентная связь)
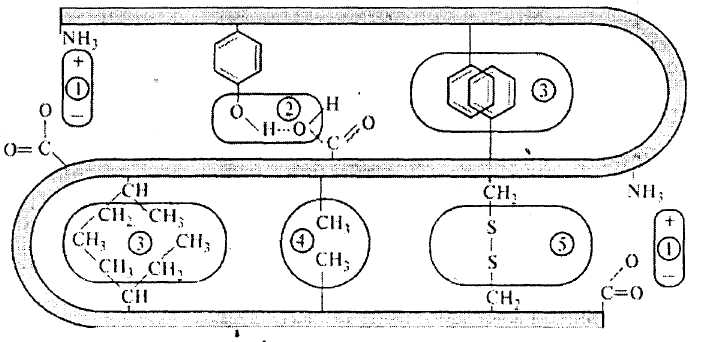
Образование дисульфидных мостиков происходит так. В присутствии солей железа или других катализаторов тиоловая группа -SH цистеина в белках легко окисляется с образованием дисульфидной группы –S-S-. В молекуле белка два остатка цистеина могут образовывать ковалентную связь в виде дисульфидной связи. Дисульфидные связи нестабильны и легко подвергаются перегруппировкам.
Электростатические взаимодействия происходят между кислотными и основными группами аминокислот, входящих в структуру белка.
Формирование структуры биологических макромолекул кроме водородных связей определяется гидрофобными связями. Именно от последних зависят те реальные формы, которые принимают макромолекулы белков. В отличие от водородных гидрофобные связи неполярные и возникают между боковыми группами белков, имеющих углеводородную природу, без участия воды. Молекулы воды как бы выталкиваются из той сферы, в которой возникает гидрофобное взаимодействие. К таким взаимодействиям способны остатки валина, лейцина, изолейцина, фенилаланина. Гидрофобные связи, как и водородные, имеют низкую величину энергии, но если их число достаточно велико, то они способны придать большой молекуле устойчивую структуру. При комнатной температуре другие молекулы не могут нарушить эту структуру, но по мере повышения температуры возрастающие сила молекулярных столкновений и энергия внутримолекулярных колебаний легко вызывают разрыв как водородных, так и гидрофобных связей.
Нарушение пространственной структуры белка называется денатурацией. Она бывает физической - под действием на белок нагревания, облучения (ультразвук, ультрафиолетовые лучи), сильного встряхивания, растирания; химической - под действием кислот, щелочей, органических растворителей, минеральных солей и т. д.
Таким образом, денатурация белка - это изменение пространственного расположения пептидных цепей в молекуле белка, которое возникает вследствие разрыва слабых связей при действии денатурирующих факторов. При этом в разной степени разрушаются вторичная, третичная и четвертичная структуры белка.
Все белки по особенностям первичной структуры разделяют на две группы: протеины, или простые белки, состоящие только из остатков аминокислот; протеиды, или сложные белки, - соединения простого белка с веществом небелковой природы.
Протеины в зависимости от степени растворимости разделяют на альбумины, глобулины, проламины, глютелины.
Альбумины растворяются в воде; глобулины в воде нерастворимы, но растворяются в водных растворах некоторых солей; проламины нерастворимы в воде и солевых растворах, но растворяются в 60-80 %-м этиловом спирте; глютелины растворимы только в растворах щелочей. К протеинам относят также фосфорпротеины, протамины, протеиноиды.
Фосфопротеины - это белки, в которых фосфорная кислота связана сложноэфирной связью с оксигруппами серина и треонина. Протамины отличаются небольшой молекулярной массой и содержанием на 80 % щелочных аминокислот - аргинина, гистидина, лизина. Протеиноиды характеризуются высоким содержанием серы, фибриллярностью, нерастворимостью.
Протеиды в зависимости от химической природы простетической группы разделяют на липопротеиды, гликопротеиды, хромопротеиды и нуклеопротеиды. В качестве простетической группы липопротеиды содержат жироподобные вещества - липоиды, гликопротеиды - углевод, хромопротеиды - пигменты, нуклеопротеиды - нуклеиновую кислоту.
Липопротеиды в большом количестве содержатся в протоплазме клеток. Типичный хромопротеид - гемоглобин. Гликопротеидами являются многие оксидоредуктазы. Нуклеопротеиды - особенно важная группа сложных белков, играющих громадную роль в жизнедеятельности организма. Они сосредоточены преимущественно в клеточных ядрах. Белки ферментов зачастую также содержат простетические группы.
Когда небелковый компонент фермента обусловливает специфичность ферментативной активности, простетические группы называются коферментами, а белковая часть - акоферментом. Это, как правило, оксидоредуктазы, и окислительно-восстановительные функции в них выполняет простетическая группа в виде азотистого гетероцикла. Кофермент часто является витамином или его производными.
Белки эндосперма ячменя в основном относятся к протеинам и характеризуются следующими показателями (таблица 1).
Таблица 1- Характеристика фракций белка ячменя
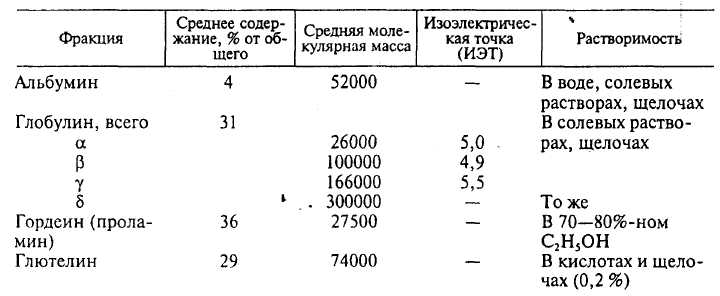
Лейкозин (альбумин). Это нейтральный белок, содержит в значительном количестве серу (1,6-2,2 %), водные растворы его начинают коагулировать при 59 °С, состоит из 16 компонентов.
Эдестин (глобулин). Различные фракции его локализуются в различных частях ячменя: γ - в зародыше, α и β - в алейроновом слое. β-Фракция наибольшая по содержанию среди глобулинов – 50-80 %. Во время солодоращения количество β-фракции не изменяется, α - несколько уменьшается, γ - уменьшается значительно, δ-фракции в солоде уже нет. Количественное содержание фракций в глобулине: α - 3,5; β - 3,5-6; γ-2,5 (% общего содержания глобулина). β-Глобулин - это гетерогенная смесь из 20 компонентов, характеризуется высоким содержанием аспарагиновой кислоты, аланина, глицина, лизина и аргинина.
Глобулин более устойчив к нагреванию и труднее, чем альбумин, коагулирует из растворов. Он начинает коагулировать только при 90 ºС. Так как он растворим в слабых солевых растворах, то сначала переходит в сусло, а затем и в готовое пиво, в определенных условиях вызывая его помутнение. Глобулин содержит серу в виде группы -SH; очень реакционноспособный белок, что также ускоряет его выпадение в осадок в готовом пиве.
Глютелин. При гидролизе сильными кислотами глютелин образует большое количество глютелиновой кислоты и лейцина. Наличие дисульфидных связей делает его сходным по свойствам с глобулином, но растворяется глютелин только в присутствии восстановителей. В последнее время показано, что извлечь глютелин можно не только с помощью едких щелочей, но и растворов редуцирующих веществ, например аскорбиновой кислоты. Из глютелина и гордеина в ячмене может образовываться клейковина - белковый комплекс, способный активно поглощать воду, набухать, увеличиваясь в объеме, и превращаться в упругую массу, которая растягивается и пружинит, как резина. Пивоваренные ячмени с низким содержанием белка обычно не содержат клейковины.
Гордеин (проламин). Он содержит до 8 фракций. Основные аминокислоты проламинов - глутаминовая кислота и пролин. Гордеину сопутствуют всегда антоцианогены, соединенные с ним адсорбционными и химическими связями. С увеличением содержания белка в ячмене особенно возрастает количество гордеинов. Отмечено их присутствие в помутнении готового пива.
|Весь белок распределен в зерне ячменя следующим образом, % : 4-5 всего белка ячменя сосредоточено в оболочке, 84-86 — в эндосперме и 13-15 — в зародыше. Часть белка эндосперма прочно связана с клеточными стенками крахмальных зерен, причем у высокобелковистых ячменей эта связь гораздо более прочная, чем у обычных пивоваренных ячменей.
Нуклеиновые кислоты. Нуклеиновые кислоты - это органические соединения с большой молекулярной массой (0,65-13) ·107. Они растворяются в растворах щелочей, при гидролизе распадаются на пуриновые и пиримидиновые основания, моносахариды, фосфорную кислоту. Молекулы нуклеиновых кислот построены из нуклеотидов. Каждый нуклеотид состоит из азотистого основания (пуринового или пиримидинового), пентозы (рибозы или дезоксирибозы) и остатка фосфорной кислоты. Производные пурина и пиримидина имеют исключительное биологическое значение прежде всего потому, что некоторые его окси- и аминопроизводные входят наряду с пиримидиновыми основаниями в структуру нуклеиновых кислот и имеют, таким образом, отношение к программированию синтеза белков и явлениям наследственности.
Пуриновые основания включают аденин (6-аминопурин), гуанин (2-амино-6-оксипурин), ксантин (2,6-диоксипурин). Пиримидиновые основания - этотимин (5-метил-2,4-диоксипиримидин), цитозин (2-окси-4-аминопиримидин) и урацил (2,4-диоксипири-мидин).
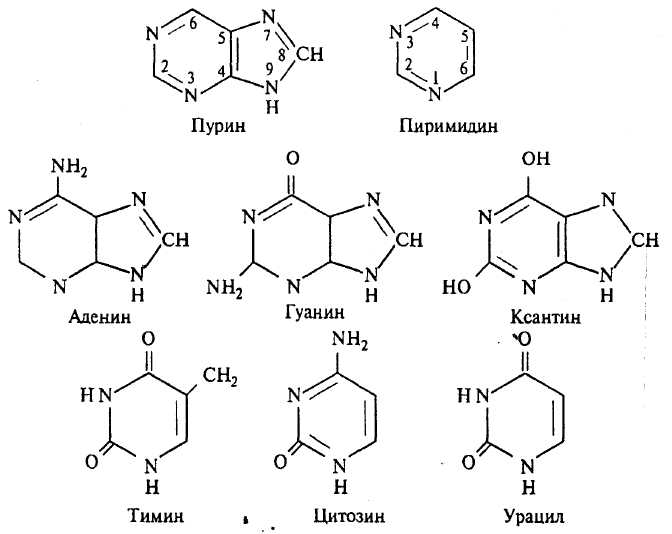
В основе структуры нуклеиновых кислот лежит каркас, образованный фосфорной кислотой, связанный с молекулами дезоксирибозы или рибозы. Первый углеродный атом пентозы связан N-гликозидной связью с первым атомом азота в пиримидинах или девятым атомом азота в пуринах. Имеется два типа нуклеиновых кислот, различающихся тем, какой сахар входит в их состав: рибоза или дезоксирибоза. В первом случае кислота называется рибонуклеиновой - РНК, во втором дезоксирибонуклеиновой - ДНК.
Соединения рибозы или дезоксирибозы с азотистым основанием называются нуклеозидами. Нуклеозиды, соединяясь с одной молекулой фосфорной кислоты, образуют нуклеотиды.
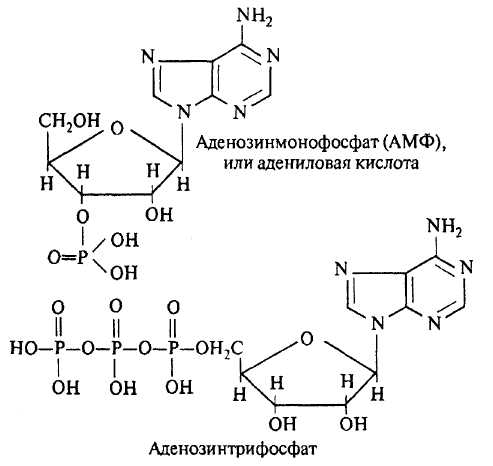
!
Например, аденозинмонофосфат (АМФ) может связываться с одним или двумя остатками фосфорной кислоты и переходить соответственно в аденозиндифосфат (АДФ) или аденозинтрифосфат (АТФ). Соединение между двумя фосфатными остатками (так называемая макроэргическая связь) особенно энергоемко. При многих биохимических превращениях освободившаяся при расщеплении этой связи энергия используется для построения АТФ из АДФ или АМФ. И, наоборот, благодаря отщеплению от АТФ одного или двух фосфатных остатков высвобождается энергия, которая используется для построения других энергоемких соединений. Таким образом, АТФ служит важнейшим накопителем и передатчиком энергии при биологических превращениях веществ зерна, например при его прорастании. АДФ, АТФ и АМФ играют особо важную роль в биологических проявлениях обмена веществ, в частности в процессах дыхания и брожения. При гидролизе связи между фосфатными остатками в АТФ освобождается около 29 кДж, в то время как при гидролизе обычной сложноэфирной связи – 8-13 кДж.
Пирофосфатная связь в АТФ отличается от эфирной связи рибозы с первой фосфорной группой вдвое большим количеством свободной энергии, образующейся при отщеплении концевой фосфорной группы. АТФ входит в состав важнейших коферментов - никотинамидадениндинуклеотидов (NAD):
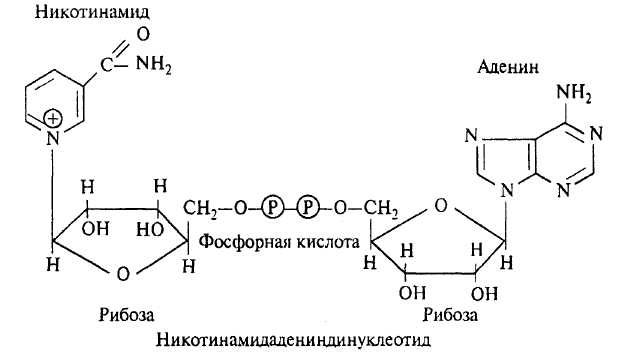
Таким образом, нуклеотиды играют основную роль в процессах биосинтеза белка, входят в состав важнейших ферментных систем зерна, регулируют фосфорилирование и окислительно-восстановительные процессы как во время формирования и созревания зерна, так и во время его проращивания. В нуклеиновых кислотах закодирована генетическая информация организма, и благодаря им эта информация реализуется. Нуклеиновые кислоты зерна наряду с белками являются важнейшими биополимерами, образующими протоплазму живой клетки.
Пуриновые и пиримидиновые основания стимулируют рост растений и микроорганизмов. Вместо них в состав нуклеотидов, принимающих участие в построении окислительно-восстановительных ферментов, могут входить витамины.
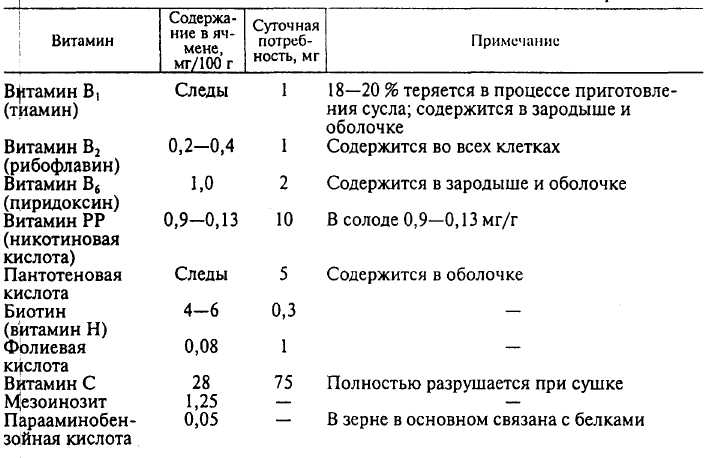
Витамины являются естественной составной частью растений, в том числе зерна ячменя (таблица 2).
Таблица 2 - Витамины ячменя

Важнейшей функцией витаминов является их вхождение в состав биохимических систем клеток, а именно коферментов (таблица 3).
Таблица 3 - Важнейшие клеточные коферменты

Витамин В является частью фермента пируватдекарбоксилазы, участвующей в углеводном обмене; рибофлавин входит в состав флавиновых ферментов, обеспечивающих нормальное клеточное дыхание. Витамин В6 -составная часть аминотрансфераз, катализирующих декарбоксилирование аминокислот и реакцию переамини-рования. Витамин РР входит в состав анаэробных дегидрогеназ.
Минеральные вещества. Содержание минеральных компонентов в ячмене составляет 2,4-3,3 %. Зола ячменя имеет следующий состав (%): Р2О5 -35,1;Cl-1,02; CaO - 2,64; SO3- 1,8; К2О- 20,92; MgO - 8,83;SiO2 - 25,91; Na2O - 2,89; Fe2O3 - 1,19.
Отдельные ионы находятся в связанном с органическими веществами состоянии. Остатки фосфорной кислоты входят в состав фитина, фосфатидов, нуклеиновых кислот. При ферментативном гидролизе этих соединений освобождается фосфорная кислота. В большом количестве в ячмене содержится калий. Кремниевая кислота находится главным образом в оболочке зерна и связана с целлюлозой. Большая часть минеральных веществ сосредоточена в зародыше: 6- 6,5 % массы зародыша.
