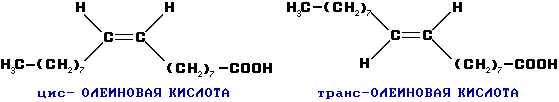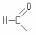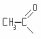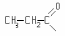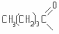ФГБОУ ВПО «Северо-Осетинский государственный университет им. К.Л. Хетагурова», физико-технический факультет, кафедра технологии и конструирования швейных изделий
РЕФЕРАТ
по химии
На тему: «Карбоновые кислоты»
Подготовила студентка 1 курса
физико-технического факультета
Рамонова Фатима
Руководитель: доцент Неёлова О.В.
Владикавказ, 2014
Содержание
1 |
Введение |
3 |
2 |
История открытия |
4 |
3 |
Номенклатура |
4 |
4 |
Изомерия |
6 |
5 |
Физические свойства |
7 |
6 |
Получение |
8 |
7 |
Химические свойства |
11 |
8 |
Применение |
13 |
9 |
Заключение |
15 |
10 |
Литература |
16 |
|
|
|
ВВЕДЕНИЕ
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Название карбоксил произошло от двух слов: «карбонил»
и «гидроксил».
Остаток любой карбоновой кислоты
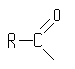
носит общее название ацил. В зависимости от кислоты каждый из этих остатков носит соответствующее название:
Остаток кислоты |
Формула |
Название ацила |
Муравьиной |
|
Формил |
Уксусной |
|
Ацетил |
Пропионовой |
|
Пропионил |
Масляной |
|
Бутирил |
Валериановой |
|
Валерил |
Основность кислот определяется числом содержащихся в них карбоксильных групп. Так, например, одноосновные кислоты содержат одну карбоксильную группу, двухосновные – две карбоксильные группы.
История открытия
Уксусная кислота знакома людям с древности. Получение при сухой перегонке (нагревании без доступа воздуха) древесины описано в сочинениях Иоанна Глаубера и Роберта Бойля. Однако природа этого вещества не была известна до XIX века. Алхимики считали, что при брожении вина винный спирт превращается в уксус, принимая на себя частицы соли - винного камня (гидротартрат калия). Ещё в XVIII веке брожение объясняли соединением кислых и горючих начал вина. Лишь в 1814 году Якоб Барцелиус определил состав уксусной кислоты, а в 1845 году немецкий химик Адольф Вильгельм Герман Кольбе осуществил её полный синтез из угля.
Муравьиную кислоту впервые получил в 1670 году английский естествоиспытатель Джон Рей, нагревая муравьёв в перегонной колбе.
Номенклатура
Наиболее часто для карбоновых кислот применяются исторически возникшие названия, связанные в большинстве случаев с названием их природных источников. Поэтому, чтобы в дальнейшем хорошо ориентироваться в номенклатуре органических соединений, следует запомнить названия простейших одноосновных кислот жирного ряда.
По рациональной номенклатуре названия кислот производятся от названий углеводородов, соответствующих радикалам, с которыми связана карбоксильная группа, с прибавлением окончания карбоновая и слова кислота, например:
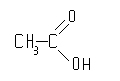 метанкарбоновая
кислота
метанкарбоновая
кислота
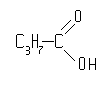 пропанкарбоновая
кислота
пропанкарбоновая
кислота
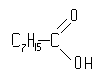 гептанкарбоновая
кислота
гептанкарбоновая
кислота
По женевской номенклатуре названия кислот составляются из названий углеводородов с тем же общим числом атомов углерода, что и в кислоте, с прибавлением окончания -овая и слова кислота.
Ниже приведены названия некоторых кислот в следующем порядке - исторически сложившееся название, название по рациональной, затем по женевской номенклатуре (слово «кислота» везде опущено):
- НСООН - муравьиная (карбоновая, метановая);
- СН3СООН - уксусная (метанкарбоновая, этановая);
- С2Н5СООН - пропионовая (этанкарбоновая, пропановая);
- С3Н7СООН - масляная (пропанкарбоновая, бутановая).
Наиболее часто в практике встречаются исторически сложившиеся названия кислот. Лишь для сложно построенных кислот пользуются женевской номенклатурой:
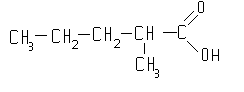 2-метилпентановая-1
кислота
2-метилпентановая-1
кислота
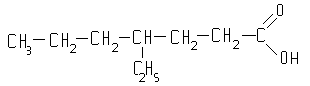 4-этилгептановая-1
кислота
4-этилгептановая-1
кислота
Изомерия
Структурная изомерия
Изомерия скелета в углеводородном радикале (начиная с С4)
СН3─СН2─СН2─СООН СН3─СН─СООН
бутановая кислота │
СН3
2-метилпропановая кислота
Межклассовая изомерия
СН3─СООН HOCН2─СОН
уксусная кислота гидроксиэтаналь
HOCН─СН2
\ /
O
Гидроксиэтиленоксид
Пространственная изомерия
Возможна цис- и транс- изомерия в случае непредельных карбоновых кислот: