
- •Мазмұны
- •2. Өсімдіктердің мүшелерін және жекелеген бөліктерін өсіруді алғаш рет хіх-хх ғасырда неміс ғалымдары бастаған.
- •4. Биотехнологиядағы жекелеген жасушаларды және ұлпаларды өсіру үш бағытта қолданылады.
- •5. Өсімдік шаруашылығында биотехнологияны қолдану негізгі екі бағытта жүргізіледі:
- •1. Клетки, иммобилизованные в или на инертном субстрате, образуют биомассу гораздо медленнее, чем растущие в жидких суспензионных культурах.
- •2. Кроме медленного роста иммобилизация клеток позволяет им расти в тесном физическом контакте друг другом, что благоприятно отражается и на химических контактах.
- •2. Клондық микрокөбейтудің әдістері.
- •3. Қолтық бүршіктердің меристемасының дамуын индумиялау
- •6. Сомалық будандастыру цитология, генетика, молекулалық биология, физиология салаларында теориялық мәселелерді зерттеу үшін, сондай-ақ практикалық селекцияда қолданылады.
- •Гендерді тасымалдайтын векторлар
- •10.3. Гендерді өсімдіктерге тасымалдау әдістері
- •Гендік инженерияның мүмкіндіктері мен даму болашағы
2. Клондық микрокөбейтудің әдістері.
Клондық микрокөбейтудің әдістерінің бірнешеуі белгілі, оларды кейбір авторлар жасанды ортада өскен ұлпалардан морфогенетикалық процесстердің жүруіне байланысты жіктейді. Н.В.Катаева жөне Р.Г.Бутенко әдістерді жаңа түрде жіктеуді ұсынады, олардың басқалардан айырмашылығы, оның негізіне жасанды ортада бұрыннан бар және жаңадан бастама клеткалардан пайда болған өсімдіктер арасындағы айырмашылық алынған.
Бірінші типтегі өсімдіктер тұтас өсімдікте бұрыннан бар меристемаларды / сабақтың ұшы, қолтық және бұйыкқан бүршіктерін / активтендіру арқылы алынған. Меристемадан пайда болған бұл өсімдіктер генетикалық жағынан ата-аналық формаларымен бірдей, себебі меристемалар көпшілік жағдайда генетикалық тұрақтылығын сақтайды.
Өсімдіктердің екінші типі бүршіктер мен эмбриоидтардың пайда болуын индукциялау арқылы алынады. Маманданған және каллустық клеткалардан алынған бұл өсімдіктер, жасанды ортада генетикалық тұрақсыздығымен сипатталады және ата-аналық өсімдіктерден біраз өзгеше болуы мүмкін. Сөйтіп, бұл әдісті тек кейбір каллустары генетикалық тұрақтылығымен ерекшеленетін немесе регенераттар арасындағы ауыткушылық табиғи аутқушылық деңгейінен аспайтын өсімдіктерге қолдануға болады.
Бүршіктер мен эмбриоидтардың пайда болуы: 1/ тікелей экспланттың маманданған ұлпаларынан /репродуктивтік мүшелер ұлпаларынан, эпидермистен, субэпидермалық ұлпалардан, жапырақ қабыршағы мезофилліктен т.б. 2/ эксплант клеткаларынан түзілген бастапқы каллустан; 3/ басқа ортаға көшіріп отырғызылған кіштустан.
Енді нақтылы морфогенетикалық реакциялардың негізінде өсімдіктің пайда болуын қарастырамыз. .
3. Қолтық бүршіктердің меристемасының дамуын индумиялау
Қолтық бүршіктің өсуін активтендіру және қолтык, өркенін қолдану, өсімдіктерді вегетативтік жолмен көбейтудің ең кең таралған әдістерінің бірі. Тұтас өсімдіктерде қолтық бүршіктерінің өсуі апикалдық басымдылык арқылы тежеледі. Қолтық меристемаларының өсуін ынталандыру үшін, сабақтың үшын алып тастайды немесе қолтық бүршігін цитокининдермен өндейді.
Қоректік ортаға цитокининдерді енгізу жанама бүршіктердің жаңануына әсер етеді және сан жағынан өте көп қолтық өркендерінің дамуын ынталандырады. Қолтық бүршіктердің отырғызуға дайындайтын өсімдіктерге 10000 лк болатын жарық түсіреді, яғни ондай өсімдіктердің көпшілігіне ең қолайлы температура шамамен 25°С тең болады.
Сонымен, қолайлы жағдайлар толық жасалғаннан кейін, пайда болған каллус белсенді түрде бөліне бастайды да, бүршікке немесе эмбриондге бастама береді. Бүршіктен дамып жетілген, тамырланған өркен мсіі микрокалемшелеу жұмыстары жүргізілсе, онда ол көбейту коэффиииентін айтарлыктай арттырады. Өркендерді тамырландыру, ол тұтас өсімдік өсіріп алудың басты шарты.
Ұрық тәрізді құрылымдар - эмбриондар, бүршіктерге карағанда сабақ пен тамырдың апекстерінің бір мезгілде дамуын қамтамасыз етеді. Каллустық клеткалардың ұрық клеткаларына айналып, одан кейін олардан эмбриоидтардың түзілуі, фитогормондар арқылы реттелетін процесс. Егер, каллустардың маманданбаған клеткаларының эмбриондық клеткаларына айналуына ауксиндер кл-хт болса, ал эмбриондык клеткалардан эмбриоидтар түзілуі үшін фитогормондардың кажеті жоқ. Сондықтан, ауксин концентрациясы ортада толығымен немесе тіпті жоқ болуы керек. Дегенмен, бұл ережені де мүлдем шындық деп қабылдауға болмайды, себебі кейбір өсімдіктер түрлерінде сомалық эмбриогенезді индукциялау цитокининдер мен иббереллшідердің катысуы арқылы жүзеге асады. Сомалык эмбриогенез орхидея және цитрус тұқымдастарына жататын өсімдіктерді микрокөбейту үшін кеңінен колданылады.
Сөйтіп, каллустардан өсімдіктер өсірудің екі жолы да -эмбриоидтар пайда болуы және органогенезі - өте тиімді, кейбір жағдайларда өсімдіктерді микрокөбейтудің жалғыз мүмкін жолдары, мысалы, зәйтүн пальмасы үшін %
4. Тікелей эксплант клеткаларынан косалкы өркендердің және мүшелердің түзлуі экспланттарды жасанды ортада өсіргенде каллустық ұлпалар барлық уақытта бірдей түзілмейді. Кейбір жағдайларда бүршіктердің маманданған ұлпалардан тікелей пайда болғаны байқалады. Өсімдіктердің оқшауланған ұлпаларының жеке клеткалары корреяляциялық қарым-қатынастың бұзылуынан дифференцияланып, меристемалық аймактар пайда болуы мүмкін, соларда кейіннен өркендік бүршіктер салына бастайды. іп vitro жағдайында осы қосыңқы бөлшектер эпидермистен, жапырақ қабыршағының мезофиллінен, субэпидермистен пайда болады. Қосалқы өркендерді тамырландырса, тұтас өсімдік алуға қол жеткізуге болады. Осы әдісті пайдаланып жасанды қоректік ортада өскен ұлпалардан бірқатар өсімдіктерді: шегіргүлді, фрезияны, пиязшықтарды т.б. көбейтіп алады. Қосалқы өркендердің жетілуі жанама және интерколярлық /мүшенің ортаңғы, буынаралык/ меристемалардың есебінен жүруі мүмкін. Шығу тегі меристемалық болуына байланысты, бұл өсімдіктер генетикалық жағынан ата - аналық формаларымен бірдей.
Эксплант ұлпаларында пайда болған меристемалық аймақтардағы клеткалардың дифференциалануы эмбриондар түзілуі жолымен жүруі мүмкін, бірақ ондай құбылысты өте сирек байқауға болады.
Соңында былай қорытынды жасауға болады, өсімдіктің тек бір түріне ғана емес, керек десе жеке ұлпалардың өзіне тән нақты морфогенетикалық реакциясын ескеріп, оны клондық микрокөбейту кезінде пайдалануға болады. Ақырында әдіс өсімдіктердегі болатын табиғи мутациялардан асып кетпейтіндей генетикалық тұрақтылықты қамтамасыз етуі керек.
Бақылау сұрақтары
Өсімдіктерді клоңдық микрокөбейту және оның артықшылығы
Колтык бүршіктердіц меристемасының дамуын индумиялау
Тікслей эксплант клеткаларынан косалкы өркендердің және мүшелердің түзлуі
Басқа ортаға көшіріп отырғызылған каллустан алу
Дәріс № 23,24
Эксплантты іn vіtro жағдайында өсіру. Микрокөбейту
Жоспар: 1. Вируссыз тұқым шаруашылығы
2. Меристемадан өсімдіктің өсіп шығуы (регенерациясы).
3. Микрокөбейту жұмыстары
Вируссыз негіздегі картоп тұқымының шаруашылығы – тауарлы шаруашылықтағы оның өнімділігі мен сапасын арттырудың ең тиімді жолы.
Вируссыз тұқым шаруашылығы бірқатар сатылардан тұрады:
1. Картоп сортын сауықтыру. Осы мақсатпен апикальді меристема әдісі немесе оның термо немесе химиотерапиямен байланысы кең көлемде қолданылады.
2. Зертханалық және жылыжайларда сауықтырылған өсімдіктер мен түйнектердің жедел көбеюі.
3. Біріншілік және таңдаулы тұқым шаруашылығымен айналысатын маманданған шаруашылықтардың қажеттілігін қанағаттандыратын көлемде далалық жағдайдағы меристемалық клондардың бір-екі жылдық көбеюін біріккен клонды материалдардың зақымданғанын бақылау арқылы алу.
4. Жоспарланған көлемде картоптың супер-супертаңдаулы және таңдаулы түрлерін алғанға дейін өнімнің сапасын сақтауға және қайталанатын инфекциядан сақтауға бағытталған арнайы технологияны сақтау арқылы арнайы тұқым шаруашылығында сауықтырылған негізгі материалды көбейту.
Бірінші әдістемелік нұсқаулардың шыққан уақытысынан бастап, ұштық меристема әдісін қолдану арқылы картоп сорттарын сауықтыру технологиясы біздің еліміздегі біріншілік-таңдаулы тұқым шаруашылығының негізгі бөлігі болды.
Осы уақыт аралығында бірқатар ғылыми-зерттеу мекемелері картоп сорттарын сауықтыру, сауықтырылған негізгі материал өндірісі және онымен картоптың тұқым шаруашылығын қамтамасыз ету жөнінде үлкен жұмыстар атқарылды.
Жеке элементтердің, сонымен қатар бүкіл технологияның жетілдірілген әдістемесі келтірілген. Бұл вируссыз негізгі материал алу өндірісін тиімді шешуге мүмкіндік береді.
Меристеманы түйіннің жасыл немесе этиолирленген өскіндерінен бөліп алады. Меристеманың жасыл өскіндерден түзілуі техникалық процесс, онда олар жақсы ажыратылады және түзілуі кезінде зақымдануға төзімдірек болады. Бірақ этиолирленген түйінді қолданғанда сауықтыру жұмыстарының эффективтілігі жоғары болады, себебі мұндай өскіндердегі вирустар концентрациясы айтарлықтай төмен, сондай-ақ вирусы жоқ ұштық меристема аумағы жарықта өсірілген өскіндердікінен әлде қайда көп болады. Түйіндер 2 см немесе одан үлкен болып өскеннен кейін оны бөліп алады.
Меристеманы өсіру жұмыстары сынапты-кварцті немесе БУВ типті бактериоцидті шамның көмегімен залалсыздандырылған микробиологиялық боксте жүргізіледі. Жұмысты бастар алдын жұмыс орнын (столды, бинокулярлы лупаны) және пробиркалары бар штативті спиртпен сүртеді. Өскіндермен жұмыс жасауға арналған құралдарды (пинцеттерді, скальпельдерді, инелерді) әрдайым қолданар алдында спиртке салып, содан соң от жалынына қару арқылы залалсыздандырып отырады.
Залалсыздандыру жұмысы сапалы болуы үшін КПГ-І типті ламинар-боксті немесе изотоптармен жұмыс жасау үшін арнайы жабдықталған плексиглазды бокс-камераларды қолданады. Өскіндерді меристеманы бөліп алар алдын 0,1% диацид ерітіндісінде залалсыздандырады (этанолмеркурхлорид пен ацетил пиридиний хлоридінің қоспасы). Диацид ерітіндісін бидистильденген суда даярлайды. Өскіндерді химиялық стаканға салып диацид ерітіндісін құяды да 3-5 мин залалсыздандырады, содан соң үш рет залалсыздандырылған сумен шаяды. Сондай-ақ 1-6% кальций гипохлоридінің ерітіндісімен немесе натрий не 0,1% сулема ерітіндісімен де залалсыздандыруға болады.
Дезинфекцияланған өскіндерді залалсыздандырылған Петри табақшаларына салып, солып қалмас үшін бірнеше тамшы автоклавталған су тамызады. Кескін кесіп алар алдын өскіннің ұшындағы ұштық жабын жапырақшасын алып тастайды. Бұл операцияны масштабты торы бар 24 есе үлкейтілген бинокулярлы микроскоптың астында дисцизионды медициналық иненің көмегімен жасаған дұрыс. Беттік жабындық қабаты (зачатков(примордий)) жоқ өлшемі 100-250 мк ұлпа кесіндісінен тұратын меристеманы цангалы ұстағышта қысылған кәдімгі жіңішке инемен бөліп алады. Сондай-ақ бұл үшін үшкірленген дисцизионды инені немесе циангалы ұстағышқа қысылған алмасты да қолдануға болады. Меристеманың ұшындағы да, жанындағы да өсу нүктелерін кесіп көруге болады. Беткі қабықшаны сылып алу мен меристеманы бөліп алу операцияларының әрқайсысын жеке-жеке залалсыздандырылған құралдармен жасайды. Кесіп алынған меристеманы иненің ұшымен пробиркадағы қоректік ортаның бетіне егеді. Сосын пробирканы жалынның үстінде тығынмен жауып, қайта штативке қояды. Барлығына егіп болғаннан соң штативті целлофан дорбамен ортаның кеуіп кетпеуі үшін жауып қояды. Қоректік ортаға егілген меристемасы бар пробирканы күнделікті жарық пен ылғал температуралық режимі бар арнайы камераға ауыстырады. Көбіне мұндай режимді сақтау үшін ауаны кондиционирлейтін қондырғысы бар люминесцентті шамдармен немесе меристема ұшынан өсімдіктерді өсіруге арналған арнайы жарықтық қондырғылармен (СУВР-Р, СВ-11 типті климаттық камералар) жабдықталған бөлмелерді қолданады. Бөлме температурасы РТ-2 және үш БК-1500 кондиционерінің көмегімен автоматты түрде реттеліп отыратын болса, онда көлемі 5×6 мбөлмеде бір мезгілде 6000 өсімдік өсіруге болады. Камераның температурасы 24-250С, жарықталуы 6±2 мың лк., фотопериоды – 16 сағ., ылғалдылығы - 70%-ға жуық болады. Меристемадан өсімдіктің жақсы өсіп шығуы үшін ең маңыздысы бұл оларды бөліп алу мен тұрақты режимі бар камераға қою арасындағы периодты қысқарту. Меристеманы егіп, одан 5-6 жапырақты өсімдіктің өсіп шығуына кететін уақыт 30-45 күнді құрайды, бірақ кейбір меристемалар тіршілікке бейім бола тұра 2-8 айда өсімдікті регенерацияламайды.
Өсімдік толық өсіп шыққанға дейін меристемадан өсіп шыққан өскіндерді дәл сол ортаның жаңасына не құрамы басқа ортаға ауыстырып отырғызады.
Алынған 5-6 жапырақты өсімдікті бөліп, әр жапырақшаны өсімдік өсіп шығуы үшін қоректік ортасы бар пробиркаларға отырғызады. Сонымен, бір уақытта регенерант-өсімдіктерге электронды-микроскопиялық бақылау жүргізеді.
Препараттарды даярлағанда бірінші және одан кейінгі кескіндерді отырғызу барысында өсімдіктің төменгі бөлігінен жапырағы жақсы жетілген бір кескінді іріктеп алады. Нақты толық нәтижеге қол жеткізу үшін әрдайым 2-4 препараттан тізбектеп отырғызу кезінде кем дегенде үш рет диагностикалау қажет. Бақылау үшін иммуноферментті анализдің in vitro зақымданған өсімдігін қолданған кезде жақсы нәтижелер алынды (ELIZA-TEST). Вирусы бар регенерант-өсімдіктерді алып тастайды. Вирусы жоқ өсімдіктерді шартты белгілермен белгіленіп, in vitro кескіндеу арқылы көбейтеді.
Дәріс № 14
Клондық микрокөбейту əдісін қолдану жəне оның болашағы.
Жоспар : 1. Клондық микрокөбейту әдісін өсімдік өсіруде пайдалану
2. Микрокөбейтудің барлық кезеңдері
3. Микротүйнектер арқылы көбейту
Өсімдіктерді көбейтудің дағдылы вегетативтік әдістерімен салыстырғанда клондық микрокобейтудің артықшылығын келтірген.
Өсу коэффициентінің жоғарылығы. Бір гербари өсімдігінен дағдылы әдістерді қолдану арқылы жылына 50-100 өсімдік өсірілсе, ал ұлпаларды қоректік ортада көбейту арқылы 1 млн. өсімдік алуға болады; алманың бір жоғарғы бүршігінен 8 айдың ішінде 60 мың өскін алуға болады.
Өсімдіктерді жыл бойы өсіруге болады:
Әдіс өте тиімді және үнемді. іп vitro жағдайында кішірек лаборатория көлемінде мыңдаған өсімдік өсіруге болады.
Өсімдіктерді көбейтумен қатар оларды вирустар мен патогендік микроорганизмдерден сауықтыру бірге жүретіндігі.
Ұлпаларды іп vitro өсіру арқылы вегетативтік жолмен өте қиын немесе тіпті көбеймейтін өсімдіктерді, мысалы, пальманы көбейтуге болатындығы.
Осы келтірілген артықшылықтарына байланысты клондық микрокөбейту әдісін өсімдік өсіруде және селекцияда мынандай мақсаттарға қол жеткізу үшін пайдалануға болады:
1. ауыл шаруашылығы дақылдарының белгілі сорттарын тез және нәтижелі түрде көбейту;
2. көбею коэффициенті төмен құнды екпе және жабайы ағаштар тұқымдары дәндері арқылы көбейгенде ұрпактары белгілері бойынша ажырап кететін, ал дағдылы әдістер мен вегетативтік түрде көбейюі өте жай немесе тіпті көбейтілін өсімдіктерді көбейту;
3. гетерозистік будан тұқым өндірісі үшін линияларды нәтижелі түрде алу және көбейту;
4. вирустардан және патогендік микроорганизмдерден тазартылған, шаруашылык әсемдік дақылдардан көшет материалды алу және оларды аурулардан сақтау;
5. кұнды таңдаулы өсімдіктерден генетикалық жағынан бірдей ұрпақ алу мақсатында көбейту, мысалы, гаплоидтық өсімдіктерді, клеткалық және гендік инженерия әдістері арқылы кұрастырылған бірлі-жарым өсімдіктерді көбейту;
6. көп мөлшерде жасанды тұқым алу. Жасанды тұқым деп, даму кезеңдері бірдей жасанды қабықшалармен қапталған, эмбриоидтарды атайды. Қабықшалар эмбриондарды қолайсыз жағдайлардан берік қорғайды және ұзақ уақыт аралығында тіршілік қабілетін сақтауын камтамасыз етеді. Әзірше бұндай "тұқымдарды" лаборатория жағдайында аз мөлшерде алып, тек ғылыми- зерттеу және селекциялык жұмыстарда қолдануда. Биотехнология бұл "тұқымдардың" өте көп мөлшерде алынуын қамтамасыз етуі керек.
іп vitro көбейтудің этаптары микрокөбейтудің барлық бастапқы
өсімдіктерді клондау арқылы процесстерін 4 кезеңге бөлуге болады.
Бірінші этап. Өсімдіктердің бастапқы ұлпаларының экспланттарын іп үІіго өсіру. Бұл кезеңде қоректік ортада инфекциядан таза ұлпаларды өсіріп, олардың тіршілігін сақтап, экспланттардың тез өсуіне қол жеткізу керек. Өсімдіктерді көбейтуде жетістікке жету, эксплантты дұрыс тандап алудан басталады, бұл кезде донорлық өсімдіктің өсу фазасы және өсу жағдайларын ескеру керек.
Екінші этап. Нактылы микрокөбейту кезеңі, яғни эксплантта бастама клеткалар /инициальдар/ санын көбейтіп, олардан өркендердің пайда болуына жағдай жасау.
Үшінші этап. Көбейтілген өркендерді тамырландыру және оларды сақтау. Бұл кезенде тамыр жүйесінің қалыпты өсуіне толык жағдай жасалады, қоректік ортаға тамыр пайда болуына жауапты фактор-ауксин косылады. Одан кейін өсімдіктерді топыраққа отырғызуға дайындау басталады немесе сақтау үшін төмен температура жағдайына ауыстырады. Онда өсімдіктің өсуі тежелінеді,темекі теңбіл кеселі вирусының концентрациясы өсімдіктің жоғарғы ұшына карай азая беретінін анықтады. Өсімдіктердің жартысында өркенінің жоғарғы ұшында немесе аппикальдық меристемаларында вирус табылмаған. Вегетативтік жолмен көбейетін дақылдарды вирустық аурулардан сауықтыру үшін, апикальдық меристемаларды өсіру әдісін колдану 1952 жылы Морель мен Мартин жұмыстары арқасында басталды. Олар бұл әдісті теңбіл кеселі вирусынан георгинді сауықтыру үшін пайдаланды.
Меристемалық ұлпаларда вирустардың көбею қабілеті төмен екендігі туралы біркелкі пікір жоқ. Меристемаларда вирустардың жоқ болуы, кейбір зерттеушілердің пікірі бойынша, өсімдіктің жоғарғы ұшының меристемасында өткізгіш жүйенің жоқ болуынан, ал гоазмодесмалар көлемі өте кіші немесе тіпті жоқтың қасы, сондықтан вирустардың клеткадан клеткаға ауысуы тежеледі. Басқа ғалымдар бұл фактіні вирус нуклео- протеинінің синтезін жүргізбейтін меристемалық клеткалардың ерекше метаболизмінен деп түсіндіреді. Жылумен өңдеу арқасында /34-40°С/ өсіп келе жатқан өркеннің ұшында вирустардың көбеюінің тежелуі жағдай, меристема дифференциланғанда вирустардан таза клеткалардың пайда болуы мүмкін. Вирустардан таза өркеннің өсіп шығуы үшін, донорлық өсімдіктерді /апикальдық меристема алынатын өсімдіктер/ өңдеуде табысқа қол жеткізу үшін, жоғары өсуіне жақсы жағдай жасап, 34-40°С температурада неғұрлым ұзақ ұстау керек.
Өсімдіктерді жылумен өңдеп оның меристемасын жасанды ортада өсіріп, міндетті түрде вирустарды тексеру қажет, ол үшін түрлі әдістер қолданылады. Оның біреуі - вирусты айқындаушы өсімдіктер - вируспен зақымданған өсімдіктен бөлінген шырынды тамызғанда, арнайы сезімталдық реакция арқылы жауап беретін өсімдіктер. Вирустарды анықтаудың электрондық микроскоптан әдісі өте жоғарғы дәлдік көрсететіні анық, бірақ бұл жол өте қымбат және көп еңбек сіңіруді қажет етеді, сондықтан сан жағынан көп мөлшерде өсімдіктерге бақылау жүргізу үшін күнделікті тәжірибеде қолдануы мүмкін емес. Вирустарды анықтауда сезімталдығы өте жоғары иммуноферменттік талдау болып табылады, ол " антиген-антидене " комплексінің ферменттік активтігін аныктауға негізделген. Бірақ ол үшін арнайы реактивтер жиынтығы қажет. Серологиялық әдіс арқылы вирустарды жылдам анықтау мен бірге ерекшелеуге болады. Дегенмен, бұл әдістің сезімталдығы орташа және барлық вирустарды анықтауға арналған сывороткалар жоқ.Егістік дакылдарды және жеміс-жидектерді, сәндік өсімдіктерді сауықтыру үшін жылумен өңдеуді және меристемаларды жасанды ортада өсіруді қатар қолданып, таза өсімдіктерді вирустарды анықтау арқылы іріктеп алу жұмыстары комплексті түрде жүргізілуі керек. Г. Лейке т.б. көрсетулері бойынша, тәжірибелерде қолдануға болатын, вирустардан тазартылған материал алуда табыска қол жеткізудің негізгі шарттары төменде көрсетілгендей.
І. Материалды жылумен өңдеу мүмкіндігі. 2. Меристемаларды жасанды қоректік орталарда өсіруге болатындығы. 3. Вирустарды аныктауға арналған жоғарғы дәлдігі бар тесттердің бар болуы. 4. Сауықтырылған өсімдіктің көбею коэффициентінің жоғары болуы. 5. Қайтадан вирустармен зақымдалмауы үшін, сауықтырылған бастапқы материалды толық оқшауланған жағдайда көбейтуді ұйымдастыру. 6. Бастапқы материалды жыл сайын алмастырып отыру үшін вирустардан тазартылған материалдың жеткілікті мөлшері қажет. Әртүрлі дақылдарда осы көрсетілген шарттардың орындалуы бірдей емес. Қазіргі уақытта осы әдісті қолдану аркылы шаруашылықтарда пайдаланып, сүрген картоптың барлық бағалы сорттары сауықтырылған және алдыңғы қатарлы елдерде тұқым шаруашылығы тәжірибесінде кең қолданылады.
Вирустардан тазартылған картоп өндіру технологиясы картоп түйнегінің термотерапиясынан басталады. Вирустардың тиюіне байланысты жылумен өңдеу 7 күннен 7 апта бойына жүруі мүмкін. Түйнектер сондай-ақ вирустарға қарсы ингабиторлары мен және түйнектердің өсуі үшін стимуляторлармен өңделеді. Меристемалардың ұсақ бөлшектерін алу үшін, ұзындығы 3-5 " болатын түссіз немесе сәл ғана жасыл өркендерді пайдалана зарарсыздандырылған бокстың ішінде сырттай зарарсыздантылған және жуылған негізгі өркендерді бірнеше бөлшектерге бөледі. Мөлшері 50-100 мкм меристемалауды оқшаулау тәжірибе жүзінде мүмкін емес, сондықтан меристемалармен бірге бүршіктегі бастапқы жапырақта оқшауланады, сондықтан оның мөлшері үлкейіп 500 мил жетеді, одан да үлкен болады. Осы мөлшерінің үлкен болуынан вирустардан таза экспланттар алу мүмкіндігі төмендейді, бірақ меристемалардың дифференциялану дәрежесі артады.
Агарланған қоректік ортаға отырғызылған аспек егер өсіп жетіледі де, кейін ұзындығы 0,3- 0,5 см өскіндер пайда болғанда оларды тамыр түзілуі және өсуді ынталандыру үшін, жаңа қоректік ортаға ауыстырып отырғызады 5-7 жапырағы шыққаннан кейін, бұл өсімдіктерді қалемшелейді, әрбір қалемшөп құрамы жағынан шығыңқы қоректік ортамен бірдей қоректік ортасы бар пробиркаларға отырғызады. Бір қалемше вирустардың бар-жоғын анықтау үшін пайдаланылады. Таза өсімдіктер картоптың вируссыз линияларын беретін негіз салушылар болады. Таза линияларды көбейтуді тездету үшін, жүйелі түрде қалемшелеу әдісін қолданады. Меристемаларға тарапында қалемшелерден өсімдіктердің өсіп жетілуі әжептеуір тез, тамыр жүйесі өте мықты және жапырағының саны да көп болады. Өсімдіктерді пробиркаларда қалемшелеу әдісін қолданып 2-3 ай ішінде 2-3 мың өсімдік өсіріп алуға болады.
Осы өте нәзік өсімдіктерді /супер-супер элита/ әрі қарай сақтауға қояды немесе теплицаға топыраққа отырғызады. Ескеретін жағдай, жұмыстың бұл кезеңі жауапты болғандықтан ұқыптылықты талап етеді. Л. Н. Трофимецтін қызметкерлерімен бірге анықтауы бойынша, колайлы жағдай жасалса сортты сауықтыру үшін орташа шамамен 40 апекстің меристемалары жеткілікті және 7-8 ай ішінде іп vitro жағдайында 30-40 мың түйнек алынады деп есептейді. Сауықтыру тиімділігі көбінесе сорттык ерекшелікке, вирустармен бастапқы зақымдануына, жыл мерзіміне т.б. жағдайларға тәуелді.
Оқшауланған жағдайда тештицада көбейтілген өсімдіктер суперэлита болады, одан кейін суперэлиталық тұқым алынатын орындарда көбейтіледі. Іріктеліп алынған таңдаулы өсімдіктер элита өндірістік питоминктерде көбейтіледі және олардан алынған түйнектер /тұқымдык материал/ өндірістік негізде өнім алу үшін шаруашылықтарға беріледі. Бірақ 5-6 жыл аралығында тұқым қайтадан вирустармен зақымданады, сондықтан, жаңадан сауықтырылған тұқымдық материал қажет болады. Соңғы кезде көбейту тиімділігін арттыру максатымен сауықтырылған өсімдіктерді микротүйнектер арқылы көбейту әдісі жүзеге асырылуда. Ол үшін қалемшелерді құрамы ерекше ортаға отырғызып, 10-15° С температуа,да ұстайды. Соның нәтижесінде 3-8 апта ішінде жапырақтар қолтығында көптеген бұршақтай микротүйнектер түзіледі. Оларды сақтау да оңай және топыраққа отырғызғанда шығыны болмайды.
Зерттеушілер картоп өсімдігін сақтау үшін, каллустық ұлшіны пайдалануға да тырысуда. Каллустарды қайталап жаңа коректік ортаға отырғызу кезінде каллус клеткалары вирустардан тазарады және табиғи немесе жасанды түрде индукцияланған морфогенез жүреді де, таза регенерант өсімдіктері шығады. Кейбір сорттар үшін каллусты коректік ортада өсіру әдісі, апикальдык, меристемаларды өсіргенге қарағанда тиімділігі жоғары екені анықталған (Сурет 9). микротүинек- микротүтіктер терді сактау 4о С
9 Сурет. Картоп өсімдігін сауықтыру және микротүйнектер арқылы көбейту ұлпаларды қоректік ортада өсіріп фитонаюгендік инфекциялардан таза тұқымдык материал алудың әдісі бірқатар көкөністік, жеміс-жидектік және сәндік дақылдар үшін жете зерттеліп, әдістемелері жасалған. Меристемаларды мұздатып сақтау /сұйық азотта- 196"С температурада/, қаржы мен өндірістік орын, еңбекті үнемдей отырып бастапқы материалдың генетикалық тұрақтылығы сакталатын, инфекциялардан таза генофоид коллекциясын ұстауға мүмкіндік жасайды. Аурулардан таза тұқымдық материалдар қолданып, өсімдік шаруашылығының тиімділігін арттыруға болады. Тиімділіктің артуы болашақта өсімдіктерді сауықтырудың өндірістік биотехнологиясының негізін қалайтын болады.
Дәріс №15
Апикальдық меристеманы өсіру.
Вирус жұққан өсімдіктерді айқындау
Жоспар: 1. Апикальдық меристеманы өсіру
2. Меристема ұшы мен термотерапия әдісін біріктіру
3. Ұштық меристема әдісін химиотерапиямен біріктіру.
Қоректік ортаға егілген меристемасы бар пробирканы күнделікті жарық пен ылғал температуралық режимі бар арнайы камераға ауыстырады. Көбіне мұндай режимді сақтау үшін ауаны кондиционирлейтін қондырғысы бар люминесцентті шамдармен немесе меристема ұшынан өсімдіктерді өсіруге арналған арнайы жарықтық қондырғылармен (СУВР-Р, СВ-11 типті климаттық камералар) жабдықталған бөлмелерді қолданады.
Бөлме температурасы РТ-2 және үш БК-1500 кондиционерінің көмегімен автоматты түрде реттеліп отыратын болса, онда көлемі 5×6 мбөлмеде бір мезгілде 6000 өсімдік өсіруге болады. Камераның температурасы 24-250С, жарықталуы 6±2 мың лк., фотопериоды – 16 сағ., ылғалдылығы - 70%-ға жуық болады. Меристемадан өсімдіктің жақсы өсіп шығуы үшін ең маңыздысы бұл оларды бөліп алу мен тұрақты режимі бар камераға қою арасындағы периодты қысқарту. Меристеманы егіп, одан 5-6 жапырақты өсімдіктің өсіп шығуына кететін уақыт 30-45 күнді құрайды, бірақ кейбір меристемалар тіршілікке бейім бола тұра 2-8 айда өсімдікті регенерацияламайды.
Өсімдік толық өсіп шыққанға дейін меристемадан өсіп шыққан өскіндерді дәл сол ортаның жаңасына не құрамы басқа ортаға ауыстырып отырғызады.
Алынған 5-6 жапырақты өсімдікті бөліп, әр жапырақшаны өсімдік өсіп шығуы үшін қоректік ортасы бар пробиркаларға отырғызады. Сонымен, бір уақытта регенерант-өсімдіктерге электронды-микроскопиялық бақылау жүргізеді.
Препараттарды даярлағанда бірінші және одан кейінгі кескіндерді отырғызу барысында өсімдіктің төменгі бөлігінен жапырағы жақсы жетілген бір кескінді іріктеп алады. Нақты толық нәтижеге қол жеткізу үшін әрдайым 2-4 препараттан тізбектеп отырғызу кезінде кем дегенде үш рет диагностикалау қажет. Бақылау үшін иммуноферментті анализдің in vitro зақымданған өсімдігін қолданған кезде жақсы нәтижелер алынды (ELIZA-TEST). Вирусы бар регенерант-өсімдіктерді алып тастайды. Вирусы жоқ өсімдіктерді шартты белгілермен белгіленіп, in vitro кескіндеу арқылы көбейтеді.
Картоп түйнегін вирустан сауықтыру үшін термотерапия әдісін ең алғаш Англияда Кассанис (Kassanis, 1956ж.) жасаған болатын.
Вирустарды зерттеу барысында олардың өсімдіктерде жоғары температурадағы (360С жуық) ерекшеліктері бойынша оларды екі топқа бөлді. Бірінші топтағы вирустар өсімдіктерді зақымдап, 360С-та өсімдік бойында көбейеді,бірақ бұл жағдайда олар қалыпты температураға қарағанда- 200С баяу көбейеді. Екінші топтағы вирустар 360С-та өсімдікті зақымдау және оның бойында көбейе алу қасиетін жояды. Осыған байланысты Кассанис келесідей қорытындыға келді, яғни бірінші топтағы вирустармен зақымданған өсімдіктерді жылумен емдегенде вирустардың мөлшері азаяды, бірақ көбею деңгейі аздап баяулайды, инфекция толығымен жойылмайды. Егер өсімдікті қалыпты температурада қайта ұстасақ (+ 200С температурада), вирустың концентрациясы біраз уақыттан соң қайта бастапқы деңгейге келеді.
Екінші топ вирустарымен зақымданған өсімдіктерді 360С-та ұстағанда олардың концентрациясы белгілі мөлшерде төмендейді, жас вирустық бөлшектердің синтезі тоқтайды да өсімдік біртіндеп вирустан тазарады. Кассанис мәліметтері бойынша таяқша және жіпше тәрізді вирустардан өсімдіктерді термотерапиямен емдеу әрекеті оңды нәтиже бермеді, ал шар тәрізді вирустармен зақымданған өсімдіктер сауықтырылды.
Өсімдікте 360С температурада вирустардың зақымдап, көбейе алу қасиеті көбіне олардың нақты температуралық инактивациясымен (НТИ) корреляцияланбайды. Мысалға, томат бойын аласа және шөптесін ететін вируспен (НТИ-800С) 360С өсірілген өсімдікті зақымдау мүмкін емес, ал осындай жағдайда зақымданған өсімдіктерді вирустан тазартуға (емдеуге) болады. Томатты қола түстес ететін вирустар (НТИ-450С) өсімдіктерді зақымдап, 360С-та көбейе береді. Ал мұндай жағдайда 200С температурамен салыстырғанда ауру күші үдей түседі. Осындай мәліметтерге сүйене отырып, Кассанис 360С температурада өсімдіктердегі вирустардың инактивациясы тікелей температураның әсері емес, жасушалар жүйесіндегі вирустар синтезінің бұзылуының нәтижесі деп есептеді. Температурасы 500С жуық суға өсімдік бөліктерін жылдам батырып алғанда вирустың инактивациялануы вирусқа тікелей әсер етумен түсіндіріледі.
Өсімдікті вирустардан тазарту процесі көбіне өсімдіктің әр бөлігін жеке-жеке емдеу арқылы іске асады. Картоп жапырағын орайтын вирусы (КЖОВ)бар картоп түйінін 20 күн бойы 360С ұстау арқылы оны вирустан тазартуға болады, ал зақымданған өсімдік дәл осындай жолмен вирустан тазартылмайды.
Жылумен өңдеу режимін әр вирусты өсімдік үшін жеке тәжірибе түрінде анықтайды. Картоп түйнегін КЖОВ емдеуде оптимальды режимді іздестіру жұмыстары оларды қыздыру барысында түйіндер шығынын минимальды етіп, толығымен емдеуге мүмкіндік берді. Кассанис жоғары температураға төзімді түйнектердің әртүрлі сорты туралы мәліметтер келтірді. Мажестик сортының түйнектерін 37,50С температурада 25 тәулік бойы қыздырғанда түйнектерінің 36%, Арран Консул сортының - 60% түйнегі шығынға ұшырап, қалғандары 100%-ға сауықтырылды.
Хемид пен Лок (Hamid, Locke, 1961) түйнектерді бөлікке бөліп қыздырды. Бөлікке бөлінген түйнектер бүтіндеріне қарағанда тез бұзылады (мысалға, 370С бір-екі апта ұстағанда). Ең тиімді әдіс бұл тәулігіне 2-3 сағ. 400С температурада, ал қалған уақытта 16-200С температурада 56 күн бойы ұстайды. Осы кезде барлық түйнек бөліктері бұзылмай, вирустардан тазартылды. Осындай нәтижеге 2 сағ. 450С (қалған уақытта – 25-300С) екі апта бойы ұстағанда да қол жеткізілді.
Упрети мен Нагаиш (Upreti, Nagaich, 1968) Үндістанда ауру түйіндерді ыстық суға батыру әдісін сынақтан өткізді. Температурасы 550С суда ұстағанда түйнектерді 30%-ы жарамсызданып, қалғаны толық сауықты.
Термотерапия әдісінің көмегімен түйнектерді мозайка тәрізді вирустардан, сондай-ақ картоп түйінінің бұранда тәрізденуін тудыратын үтір тәрізді вирустардан емдей алмайды. Сонымен бірге, түйнектерді жоғары температурада өсіру осы вирустардан емдеу кезінде беткі меристема әдісінің тиімділігін жоғарылатуға көмектеседі.
Түйнектерді термотерапиялау әдісі келесідей ретпен орындалады:
Тыныштық периодтан өтіп өзек жара бастаған түйнектерді әрқайсысының ауданы шамамен 2×2,5 м екі бөлмеден тұратын термобокске термотерапияға қояды. Бокс алдындағы бөлме температурасы 28-300С аралығында, ал боксте 37-380С болады.
Термотерапияға жіберілетін түйнектер кесілмеген, инфекция, ризоктония склероциясы жоқ және жақсылап (тазалап) жуылған болуы тиіс. Оларды бокс стеллаждарында залалсыздандырылған құммен толтырылған кюветаларға салады. Температура автоматты түрде реттеліп отырады, ауаның салыстырмалы ылғалдылығын 75% шамасында буландырылған тұздың қанық ерітіндісімен (NaCl) бокстегі кювета қамтамасыз етеді. Бокста жарықты тек күнделікті субстратты екі рет ылғалдандыру кезінде жағады. Өскіндер этиолирленген, ұзын болып өседі.
Түйнек өскіндерінің ұшын физиологиялық побурение алдын алу үшін үнемі әр 7-10 күн сайын Кнопа ерітіндісі мен Мурасиге-Скуга бойынша микроэлементтермен азықтандырады: 1 л Кноп ерітіндісіне 5 мл микроэлементтердің негізгі ерітіндісі (1×1000).
Тәжірибе жұмыстары көрсеткендей термотерапияның оптималды ұзақтығы 4 апта шамасында және оны вирустың түрі мен құрамы, сорттың биологиялық ерешелігіне байланысты анықтайды.
Жоғары температурада нашар өсетін бірқатар сорттар үшін екі фазалы термотерапияны қолданады: оларды бір-екі апта 28-300С бокс алдындағы бөлмеде өскіндер пайда болғанша ұстайды да кейіннен төрт аптаға жуық боксте 37-380С ұстайды.
Термостатпен салыстырғанда термобокс өсіп келе жатқан түйнектерді тұрақты температурамен, ылғалдандырудың тиімді жолдарымен, газ алмасумен қамтамасыз етеді, нәтижесінде түйнектер шіріместен, барлық сорттар үшін (ерте және кеш пісетін) термотерапия периоды ұзақ қолданылады.
Келтірілген технология түйнектерге қолданылатын термотерапия әдісінің ұзақтығын сорттың биологиялық ерекшеліктерін ескерместен 12-16 аптаға ұзартуға, алынатын өскіндер санын 1,5-8,0 есеге арттыруға, сортты сауықтыру технологиясының бір сатысы ретінде термотерапияға кететін шығынды азайтуға мүмкіндік береді.
Ұлпаның культурасымен біріктірілген термотерапияның ерекше бір әдісін канадалық ғалымдар Стейс–Смит пен Меллор (Stace-Smith, Mellor, 1968) ұсынған. Жылумен өңдеу үшін картоптың инфекциялық өсімдігінен кесіп алынған тамыр ұштары қолданылады. Кескінді 5 сағ. бойы гетероауксин ерітіндісінде (50 мг/л) өңдейді. Жылумен өңдеуді ауаның температурасы 33-370С, топырақтың температурасы 30-320С, жарық периодының ұзындығы – 16 сағ. жарық көзімен жабдықталған бөлмелерде не камераларда жүргізеді. Өсімдіктерді 300С дейін жылытылған сумен суарады. Өсімдіктерді мұндай талаптарда 4-6 апта өсіреді, сосын олардан өлшемі 0,3-1 мм өркен алып қоректік ортаға егеді. Жылумен өңдеуді күзде не қыста бастаған жөн, себебі жұмысты вегетация процесі басталғанша аяқтап үлгеру керек. Алынған өркендердің қарқынды өсуі көктемде немесе ерте жазда байқалады. Өлшемі 0,6-0,8 мм өркендер өлшемі одан кішілеріне қарағанда тез өседі. Өркендерді 25 есе үлкейтіп көрсететін құралдың астында кеседі. Өркен кинетин мен индолсірке қышқылы (ИСҚ) қосылмаған Мурасиге-Скуга қоректік ортасында жақсы тамырланып, өседі, оптималды рН мөлшері 5,7. Агар (0; 5,0; 10,0 г/л) мен сахарозаның (20 және 30 г/л) концентрациясы өркеннің өсуіне онша әсерін тигізбейді. Жаңа қоректік ортаға тек қажет болған жағдайда көшіреді. Мысалға, өркен өте баяу дамыса.
Бұлайша біріктіру жұмыстары қоректік ортаға вирустардың ингибиторларын қосуға негізделген. Картоп шаруашылығы ҒЗИ ең алғаш картопты понкреативті рибонуклеазалы (РНКаза) ұштық меристема әдісімен сауықтыру жұмысының жоғары эффективтілігі анықталды. РНКаза меристеманы кесу алдында өскіндерді өңдеуге, не қоректік ортаға 0,001-0,1% концентрацияда қосу арқылы қолданады.
Түйнек өскіндерін РНКазамен өңдеуді инфильтрация әдісімен вакуум-камерада 20 мин бойы жүргізеді.
РНКазаны негізгі қоректік ортаға екі әдістің көмегімен қосады. Бірінші жағдайда РНКаза ерітіндісін Зейц фильтрімен фильтрлеу арқылы залалсыздандырады. Сосын РНКаза ерітіндісін залалсыздандырылған жағдайда жылы автоклавталған қоректік ортасы бар колбаға құяды да, жақсылап араластырған соң пробиркаға құяды.
Екінші жағдайда РНКазаны залалсыздандырылған суға ерітіп, жылы автоклавталған қоректік ортаға қосады да бокста залалсыздандырылған пробиркаларға құяды.
РНКазаның 0,001-0,1% концентрациясын қолданғанда меристеманың морфогенезіне және регенеранттардың шығымына жақсы әсер ететіндігі анықталды. Сондай-ақ бұл жағдайда сауықтыру эффективтілігі артады. Меристемалардың РНКазасы бар Мурасиге-Скуга ортасына бейімделуі сортына байланысты 10-35%-ға артты, алынған регенеранттар саны 30-40%-ға көп болды.
РНКазасы бар қоректік ортадағы сау регенеранттардың пайызы бақылауға қарағанда (РНКазасы жоқ қоректік орта) 1,2-2,0 есе жоғары болды.
Дәріс № 16
Прогамдық сəйкессіздік, яғни ұрықтанудың басталмауы.
Жоспар:
Жаңа сорттар шығару
Ұлпаларды қоректік ортада өсіру әдісін селекцияда колдану.
3. іп vitro жағдайында ұрықтану кезіндегі және ұрықтанудан кешегі сәйкессіздікті жеңу.
Жаңа сорттар шығару 4 эволюциялық принципке сүйенеді: будандастыру, рекомбинация, мутация және селекция. Осы келтірілген негіздердін барлығы да іп vitro жағдайында табысты түрде жүзеге асады. Клеткаларды өсіру әдісі дағдылы селекция әдістеріне қарағанда, генетикалық жағынан өзгерген өсімдіктерді қысқа уақыт аралығында алуға мүмкіндік жасайды. Клеткаларды жасанды ортада өсіру ең алдымен генетикалық базисті кеңейту арқылы селекция тиімділігін арттырады. Оған кол жеткізу үшін, селекция процессіне мәдени өсімдіктердін жабайы тұқымдастарын кең көлемде қатыстыру керек. іп vitro жағдайында ұрықтану және ұрықты жасанды ортада өсіру / эмбриокультура / арқылы ұрықтану және ұрықтанудан кейінгі сәйкессіздіктерді жеңіп әріден будандастыру кезінде тіршілікке қабілеті бар түраралық және туысаралық будандар алуға болады. Қатаң түрде сақталатын сәйкессіздіктен, жыныстық жолмен алынбайтын гендер комбинациясын жасаудың басқа әдісі ол протопласттарды қоректік ортада өсіруге негізделген сомалық будандастыру.
Гаплоидтық өсімдіктер алу үшін клеткаларды өсіру әдісінің мүмкіндігі өте зор. Генетикалық базисті кеңейтудің жаңа мүмкіндіктері, мутацияларды іп vitro туғызып және клетка деңгейінде сұрыптау жүргенде ашылады, ал оның бәрі тек клеткаларды жасанды ортада өсіргенде ғана жүзеге асырылады. Құнды белгілері бар, жекеленген бірден-бір регенерант өсімдіктерді тиімді түрде микроклондау әдісі арқылы көбейтуге болады.
Генетикалық жағынан бірдей регенерант өсімдіктерді негізінен бастағанда каллус арқылы алады. Каллустарды бірнеше рет қайталап жаңа қоректік ортаға отырғызып өсіру каллустық ұлпаларда цитогенетикалык, ортаның пайда болуына әсер етеді. Бұндай каллустардан орта регенерант өсімдіктер бастапқы өсімдіктен айтарлықтай өзгеше болады. Бұл кұбылыс өсімдіктердің жаңа формаларын шығару үшін қолданылады, ондай өсімдіктер сомаклондық варианттар деп аталады, олар да өсімдіктер селекциясы үшін генофондыны байытады.
Тікелей ДНҚ -ы деңгейіне генетикалык әрекет жасау инженерияның зерттеу бағыты генетикалық информацияларды жүргізу негізінде жаңа өсімдіктер формаларын шығаруға жол ашады.
Сөйтіп, клеткаларды өсіру әдісінің мүмкіндіктері соншалық зор болғандықтан, оның селекцияға жасайтын ықпалы арқасында адамзат келесі " жасыл революциясына " қол жеткізе алады.
Өсімдіктерді генетикалык жағынан жақсартудың биотехнологиялық әдістері;
1. Дағдылы және жаңа әдістерді байланыстыру
2. Клеткалық инженерия
3. Генетикалық . инженерия
4. Генетикалық базисті кеңейту.
5. Селекциялық процессті тездету.
6. Негізгі жаңа формаларды құрастыру.
іп vitro жағдайында ұрықтану кезіндегі және ұрықтанудан кешегі сәйкессіздікті жеңу.
Барлық дүние жүзі бойынша маңызды азық-түліктік дақылдарының генофондының кедейлену процессі күшеюде. Көптеген дамыған мемлекеттердің егістік алқаптарының саны аз, генетикалык жағынан гомогенді суперсорттар алып жатыр. Бұндай жағдайда модель түрлердің генофонды толықтыру мәселесін шешетін әріден будандастыру әдісінің маңызы артады. Сонымен бірге, әріден будандастырудың мүмкіндігі програмдық және гюстгамдық генетикалық сәйкессіздендіру әсерінен қолданылмайды. Програмдық сәйкессіздік деп, будандастыруға алынған парлар арасында ұрықтану процесінің жүрмеуін атайды, оның физиологиялык себебі, тозаңның пісіп жетілетін уақытының сәйкес келмеуі, тозаң өсуге қабілеті болмауынан немесе тозаң түтігінің өсуінің тоқтап қалуынан және морфологиялык, себебі / тозаң түтігінің қыска болуы т.б. /,тозаң ұрық қалтасына жетпейді, аналық гаметаның жұмыртқа клеткасымен косылуының мүмкін еместігінен. Парлардың генетикалық сәйкессіздігі де болуы мүмкін, ол барлық деңгейлерде байқалады: аналықаузы және мойны, тұқым бүршігі.
Постгамдық сәйкессіздік ұрықтанудан кейін байқалады, ол будан ұрықпен оны қоршап тұрған ұлпалардың генетикалық сәйкессіздігі, оны ұрық дамуының барлық кезеңдерінде байқауға болады. Түраралык будандастыру кезінде қосарлана ұрықтану процесінің жай жүретіні спермийлердің ажырамауы, дара ұрыктану фактілері жиі байқалады. Үш ядроның бірдей қосылуы /спермийдің және екі полярлық ядролардың косылуы/ болмаған жағдайда эндосперм қалыптаспайды, тіпті олардың косылуы жүргеннің өзінде эндосперм жай қалыптасады. Эндосперм дамып келе жатқан ұрыққа қоректену және реттелу факторларының көзі екені белгілі. Ұрықтың дамып жетілу жылдамдығы әр уақытта бір калыпты емес, жылдамдығының төмендегенін ұрық дифференцияланған кезде байкауға болады.
Бұл ұрықтың азғындауына және өлуіне әкеліп соғады, онымен бірге әр түрлі аномалиялар пайда болады, қорытындысында сапасы жок жетілмеген ұрығы бар тұқым калыптасады.
Дәріс №17
Эндоспермді іn vіtro өсіру.
Жоспар:
Оқшауланған ұрықты коректік ортада өсіру
іп vitro жағдайында ұрықтануды өткізу
Тіршілікке кабілеті жоқ түраралық және туысаралык будандар ұрығын өліп қалудан сақтап, оны жасанды қоректік ортада өсіру, біртіндеп постгамдық сәйкессіздікті жеңу үшін таптырмайтын әдіске айналуда. Осы әдісті қолдану негізінде көптеген түраралық / томат, асқабақ, құрма, зәйтүн, шие мен алша т.б. / және туысаралық / арпа мен бидай, диплоидтык және тетраплоидтық күріш, арпа, кара бидай т.б. / будандар алынды. Жетілмеген, оқшауланған ұрықтарды іп vitro жағдайында ойдағыдай өсіру бірнеше факторға, алдымен ұрыктың жетілу сатысына, одан кейін оның дифференциялану дәрежесіне байланысты. Оқшауланған дифференцияланбаған ұрықтарды өсірудің қиындығы, іп vitro жағдайында эндоспермнің гормондық ролін тура қайталаудың мүмкін еместігіне негізделген. Ұрық пен эндосперм арасында тығыз функционалды байланыс, әсіресе ұрықтың дамуының / эмбриогенез / ерте кезеңде бар екендігі ұрықтарды жасанды қоректік ортада өсіргенде нақтылы түрде белілі болады. Жас және жетілген эндоспермдердің гормондык комплекстері кұрамы жағынан өзгеше жас эндосперм ұрықтың дифференциялануын ынталандырса, жетілген эндосперм бұл процессті тежейді. Сондыктан, жетілмеген ұрықтар жетілгендермен салыстырғанда қореқтік орта құрамына өте жоғары талап қояды, олардың өсуі үшін қоректік орта құрамына физиологиялық активті заттар, сонымен қатар жас эндоспермдерден бөлінген экстракт, кокос сүті қосылады.
Т.Б.Батыгина және В.Е.Васильева әр түрлі пион ұрыгын табиғи және жасанды ортада өсіріп, эмбриогенез барысында маңызды кезеңді анықтады, ол кезең ұрық дамуының дербестілігі. Осы кезеңнен бастап ұрық аналық организмнен тәуелсіз болады, әрі қарай эмбриогенез процесін өтіп шығуға және қалыпты өркен беруге қабілеіті. Өсімдіктердің әр түрінің ұрығының тәуелсіз болу фазасын анықтаудың маңызы үлкен, себебі, осы уақыттан бастап ұрық өз бетінше қарапайым құрамында гормондар жоқ ортада өсіп жетіле алады. Пион өсімдігі ұрықтары үшін тәуелсіздік ұрық дамуының өте ерте жүрек тәрізді фазасында, ягни тұқым жарнағы дифференцациялана бастаған кезінде басталады.
Жетілмеген окшауланған ұрыктарды өсіруде табыска жету үшін, құрамы лайықты қоректік орта қажет, бұл орта ұрықтың қалыптасуын аяқтауға және өсе бастауына мүмкіндік жасайтын болу керек. Ұрыктарды өсіруге арналған әмбебап коректік орта жоқ, сондықтан орта құрамын іріктеу және үйлесімділігін келтіру, ұрыкты өсіру жұмыстарының негізгі мәселелері. Өсімдіктердің кейбір түрлері ұрықтарының дамуына азоттың органикалык, тұздары және калийдің жоғары концентрациясы, сұйық қоректік орта т.б. факторлар жақсы әсер еткен. Ұрықтарды жасанды ортада өсіргенде каллус түзілуі жиі кездеседі. Одан кейін, каллустың органогенезге өтуін индукциялап регенерант өсімдіктерді алуға болады. Каллусогенез және оның морфогенетикалық потенциалы көптеген факторларға байланысты. Ол факторлар: генотип, үрықгың дифференциялану дәрежесі, қоректік орта т.б.
КазМҰУ өсімдіктер физиологиясы және биохимия кафедрасында арпа және бидай ұрықтарын жасанды қоректік ортада өсіру жұмыстары табысты түрде жүргізілген. Арпаның әр түрлі экспланттарынан жетілген ұрықтан, жетілген ұрықтың бөліктерінен, гүлшоғырынан, жетілмеген ұрықтан каллус ұлпалары алынды. Анықталғандай, каллус ұлпаларының морфогенетикалық қабілеті бастапқы экспланттың типіне байланысты болып шықты. Жас гүлшоғыры және жетілмеген ұрықтар ұлпаларының регенерацияға ең жоғары қабілеттілігі бар. Морфологиялық және анатомиялық құрылысы сонымен қатар морфогенетикалық қабілеті бойынша өзгеше 10 түрлі ұлпалар типі бар екені аныкталды. Зерттеулер нәтижесінде, эмбриогендік линиялардың пайда болу жиілігі қоректік ортадағы 2,4 -Д концентрациясына байланысты екені анықталды. 2,4 -Д- ның жоғары концентрациясында жарты жыл бойы эмбриоидтар түзуге қабілетін сақтайтын линия алынды.
Жұмсақ бидай / Тrіtісиm аеstіvиm / және қатты бидайдың / Тrіtісиm durum / 14 сортының жетілу дәрежесі әр түрлі ұрықтары бөлініп, оларда каллус түзілу және морфогенез процесстері зерттелген. Каллус түзілудің қарқындылығы жоғары болды / 89- 100% /. Каллус ұлпаларының гемморизогенезге қабілеттілігі бірнеше факторларға байланысты, олар генотип, қоректік ортаның құрамы, экспланттың физиологиялық жағдайы және оның қоректік ортаға бағытталуы. Тұтас өсімдік беруге, қатты бидай сорттарымен салыстырғанда жұмсақ бидай сорттары және жетілмеген ұрықтарынан пайда болған каллус ұлпалары, толық дифференцияланған ұрықтардан алынған ұлпаларға қарағанда өте жоғары қабілеттілік көрсетті. Қоректік орталардың ішінде регенерацияға Гамборг В3 және Уайт орталарына қарағанда Мурасиге және Скуг ортасы өте қолайлы екендігі анықталды.
Бидайдың Саратовская 42 сортының жетілмеггн ұрыктарын қоректік ортаға дән жарнағын жоғары қаратып отырғызғанда пайда болган каллус ұлпаларының 70% астамы гемморизогенезге, яғни өркен жөне тамыр түзуге қабілеттілік көрсетті. Бидайдың екі сорты Целинная 21 және Саратовская 42 регенеранттарының тұқымы алынды.
Дамуының өте ерте кезеіңде тұрған ұрықтардан өсімдік алудың тағы бір әдісі, ол тұқым бүршікті және түйінді іn vitro жағдайында өсіру. Мұндай жағдайда өсіп келе жатқан ұрықтарды оқшаулаған кезде оның механикалық зақымдалуы мүлдем болмайды және объектілерді зигота кезеңінен емес, одан әлде қайда ерте, жетілген ұрық қалтасы кезеңінен бастап қоректік ортада өсіруге болады.
Дегенмен, көптеген эндоспермі жоқ өсімдіктердің тұқым бүршіктерінен тіршілікке икемді дәндерді алу өте қиын. Егер тұқым бүршікті оқшаулаған кезде орталық клеткада эндосперм ядролары өте аз болса да in vitro жағдайында тұқымбүршіктің эмбриогенезі қалыпты түрде жүреді. Тек кейбір есімдіктерде /шие, алша/ эндосперм атқаратын қызметін тұқымбүршіктің басқа ұлпалары атқара алады, сондықтан ұрық эндосперм болмағанның өзіңде де, зиготадан дифференцияланып өседі.
Тұқымбүршікті түйінмен бірге, тіпті зигота кезенінде оқшауланғанның өзінде эмбриогенез қалыпты жағдайда жүреді, себебі іп vitro жағдайында плацентадан келетін морфогенетикалық фактордың әсерінен эндосперм түзіледі. Бұл жерде мына жағдайды атап өту керек, эмбриогенез кезіндегі көптеген гормондық және ұлпа аралық әрекеттесулер жөнінде қрщы деректері, оқшауланған жетілу дәрежелері әртүрлі ұрықтарды, тұқымбүршіктерді, түйіндерді іп vitro өсіру арқылы анықталды. Оқшауланған ұрықты жасанды ортада өсіру эмбриогенездің бірқатар теориялық мәселелерін шешуден басқа тәжірибелік селекцияның маңызды бағыттарының қатарына қосылды. Әріден будандастыру кезіндегі ұрықтардың тіршілікке икемділігі болмауын жеңуден басқа ұрыкты өсіруді селекция процессін тездетуде қолдануға болады. Мысалы, тұқымның тынымдық кезеңін тоқтату өсімдіктердің көбею циклін қысқарту, дәндердегі өздігінен болатын стерильдігін жеңу, тұқымның өнгіштігін тез арада анықтау.
іп vitro жағдайында ұрықтануды өткізу
Тозаңды, тұқымбүршікті және түйінді іп vitro өсіру әдістерінің жетілуінің аркасында, тозаңмен бірге ұрықтанбаған тұқымбүршікті қатар өсіріп прогамдық сәйкессіздікті жеңуге мүмкіндік туды. Осылай тіршілікке икемді томаттың, темекіннің, үрме бұршақтың кауынның, қиярдың» кұлпынайдың дәңдері алынған. Гүлдердің ашылуына бірнеше күн қалғанда айқас тозаңданатыңдардың және өздігінен тозаңданатындардың да гүл кауызын кесіп алады да, зарарсыздандырады, олардың аналығын немесе түйінін, не болмаса тұқым бүршікті бүрбүршікпен бірге бөліп алып, коректік ортаға отырғызады. Қоректік ортаға отырғызардың алдында түйіннің кабығын кесіп, тұқымбүршікті ашады. Қоректік ортаға отырғызғаннан кейін 2-3 күн өткен соң тұқымбүршіктің жанына агары бар ортаға зарарсыздаңдырылған тозаңды отырғызады, тозаң өсе бастайды да, тұкымбүршіктің тозаңтесігі арқылы ұрық қалтасына түседі. Пробиркада ұрықганған ұрықтың дамып жетілуі бір қалыпты өтеді. Бұл істің орындалуын жеңілдетуге болады, ол үшін тұқым бүршікке тозаңды түсіріп, тозандаңған тұқым бүршікті жасанды ортада өсіреді. Өсімдіктердің іп vitro жағдайында тозандануы көкнәр, калампыр, алка тұқымдастарында /темекі, петуния/ жақсы жүредІ, себебі олардың түйінінде сан жағынан өте көп тұқымбүршіктері бар және оларды жасанды ортада өсіру жақсы жолға қойылған. Азық-түлік дақылдары үшін, гулдің мүшелерін және ұрықты жасанды ортада өсіруді катар жүргізіп, өсіру әдістерін әрі карай жетілдіріп, ол дақылдармен жүргізілетін селекция жұмыстарының тиімділігін арттыруға болады.
Дәріс №18
Тозаңқаптарды іn vіtro өсіріп гаплоидтарды алу.
Жоспар:
Гаплоидтар жәнс олардың селекциядағы маңызы
Тозаңқапты және тозаңдарды қоректік ортада өсіріп гаплоидтар алу
Будан ұрыкта хромосомалардыц селективті жойылуы әдісімен гаплоидтарды алу
Сомалық клеткалар ядроларында сыңар хромосомалар жиынтығы / п /, яғни түрдің өзіне тән хромосомаларының толық жиынтығының / 2п / жартысы бар организм гаплоид деп аталады.
ГАПЛОИД - сыңар, дара /гаплоидты/ хромосомалар жиынтығы болатын ядро, клетка, организм; гаметаларда сыңар хромосомалар жиынтығы болады.Гаплоидтар гаметаның генотипін сақтайтын организмдер. Олар репродуктивтік клеткалардан апогамия / ұрықтың синергидадан немесе антиподадан түзілуі /, немесе андрогенез / ұрықтың аталық гаметадан тузілуі / құбылысы нәтижесінде пайда болады.
Селекцияның дағдылы әдістері арқылы гаплоидтарды тәжірибеде алу жолдары /тұраралық және туысаралық тозаңдандыру, рентген сөулесімен өсер ету т.б./ тиімсіз және уақытты көп талап етеді. Жаңа әдістерді қолданып, мысалы, аталық гаметофитті / тозаңды / және аналық гаметофитті / ұрық қалтасы / іп vitro өсіру гаплоидтарды алуды бірнеше рет тездетеді және селекция процессін жеңілдетеді (10 сурет).
2. Бірінші С.Гуха және С.Махешвари 1964 жылы Индияда меңдуана тозаңқаптарын қоректік ортада өсіріп, гаплоидтық өсімдіктерді алғашқы рет алған. Одан кейін, бұл тәжірибелерді темекі өсімдігімен Францияда К.Нич 1967 жылы қайталап жасады. Сол уақыттан бері осы әдіспен 200-ден астам түрден гаплоидтық өсімдіктер алынды, соның ішінде: арпа, сұлы, күріш, картоп, рапс т.б. бар. Тозаңқаптарды жасанды ортада өсіру арқылы алынған гаплоидтар аталық гаметаның генотипін ұстайды, бұл процесс андрогенез деп аталады, бұл терминді кейбір ғалымдар келіспейді деп есептейді. Андрогенез тікелей және жанама жолмен өтуі мүмкін. /11 сурет/. Тікелей андрогенез тозаңдық эмбриогенездің аркасында, яғни микроспоралардың бөліну жолымен түзілетін эмбриоидтардан гаплоидтық өсімдіктердің пайда болуы. Гаплоидтық өсімдіктердің микроспоралардың дедифференциялануы нәтижесінде түзілетін каллустардан пайда болуы жанама андрогенез деп аталады.
Каллустан қоректік ортада алынған өсімдіктердің бәрі бірдей гаплоидтық бола бермейді. Сондықтан гаплоидтарды сансыз мөлшерде алу үшін, тозаңдық эмбриогенезді индукциялауға тырысады.
Тұтас тозаңқаптарды қоректік ортада өсіргенде каллус клеткаларының диплоидтық спорогенді тозаңқап клеткаларынан пайда болуы мүмкін екендігін атап өту керек. Осындай каллустардан өскен өсімдіктер диплоидтық немесе полиплоидтық болады. Сонымен қоректік ортада өскен тозаңдар клеткаларында мынадай процесстер журуі мүмкін:
1/ эмбриоидогенез;
2/ дедифференциялану және каллусогенез;
3/ шар тәрізді формалары бар құрылымдар пайда болады;
4/ микроспорогенез және гаметогенез жалғасады;
5/ микроспоралар кері кетеді.
Регенерант өсімдіктер, соның ішінде гаплоидтық өсімдіктер алғашқы екі процесстің арқасында алынған.
іп vitro жағдайында аталық гаметофиттен гаилоидтық спорофиттің пайда болуы өте күрделі және аз зерттелген процесс. Микроспоралардың даму жолдары өте күрделі, бастапқыда проэмбрио, одан кейін эмбриоид пайда болады. Бұл процесстің қалай басталатыны және реттелетіні белгісіз. Н.Сандерленд қызметкерлерімен бірге мендуананың оқшауланған микроспораларын қоректік ортада өсіріп, оның дамуының бастапқы кезеңдерін зерттеп, микроспоралардың қалыпты жағдайда дамуы өзгеше болатынын анықтады.
Микроспоралардың қалыпты in vivo дамуы келесі кезеңдерден тұрады:
1/ екі мейоздың қорытындысында тозаңның аналық клеткасынан микроспоралардың тетрадасы пайда болады
2/ қалыңдаған тетрада кабығынан микросиоралардың босануы;
3/ микроспора дамиды, екі митоз нәтижесінде жетілген тозаң пайда болады.
Iп vitro жағдайда тозаңның қалыпты дамудан ауытқуы микроспораның дамуының кез-келген кезеңінде жүруі мүмкін.
Тозаңқапты қоректік ортада өсіргенде екі вегетативтік ядросы бар микроспора /дамудың В жолы / пайда болуы мүмкін, немесе вегетативтік ядро генеративтік ядромен кұйылып қосылады, диплоидтық клетка түзіледі /дамудың С жолы/. Осындай микроспоралар бөлінгенде пайда болатын проэмбрионың өз ерекшіліктері болады. Әр түрлі эмбриондар іп vitro жағдайында вегетативтік және генеративтік клеткалары бар қалыпты микроспораның пайда болуы мүмкін /дамудың А типі/, өйткені, олардың түзілуіне вегетативтік немесе генеративтік клетка не болмаса екі клетка да катыса алады. Екі клетка қатысқан жағдайда диплоидтық эмбрионд жетіледі . Бұдан басқа даму кезеңінде аномалиялары болған / мейоздың бұзылуы / редукцияланбаған микроспорадан, сонымен қатар эмбриогенездің әр түрлі кезеңдерінде жүрген эндополиплоидия негізінде диплоидтар түзілуі мүмкін. Сөйтіп, проэмбрио түзілуінің әр түрлі цитологиялық жолдары бар және микроспораның даму бағыты көптеген факторлардың қатысуымен анықталады, соның ішінде олардың табиғи полиморфизмімен. Полиморфизм себептері мынада: даму кезіндегі аномалиялар, споралардағы бөліну шүйкесінің орналасуы т. б. Тозаңқапта болатын мыңдаған микроспораның тек бірен-саранынан ғана эмбриоид жетіледі. Эмбриоидогенезге қабілеттілік генетикалық негізделген болуы мүмкін. Стресстік ықпал мысалы, төмен және жоғары температура, иондалған сәулелермен әсер еткенде эмбриогендік микроспорапар санының артатыны тәжірибе жүзінде аныкталған. Тікелей андрогенезге өту үшін, донорлык өсімдіктің физиологиялық жағдайы, тозаңкапты жасанды ортаға отырғызу уақытындағы тозаңның даму кезеңі, қоректік орта кұрамы және жасанды ортада өсіру жағдайларының маңызы өте жоғары. Көптеген өсімдіктер үшін эмбриоид пайда болуда ең қолайлысы микроспораның бір ядролық кезеңі.
Фитогормондардың әсері микроспораның өсу кезеңіне байланысты болады. Мысалы, мейоз кезеңінде. фитогормондардың жоғары концентрациялары каллусогенезді күшейтеді, тетрада кезеңінде микроспораның калыптасуын және бірнеше митоздың өтуін, бір ядролық микроспора кезеңінде эмбриоидогенезді арттырады. Бұл жерде қоректік орта кұрамы туралы қалыптасқан пікір жок. Өсімдіктердің кейбір түрлері; мысалы, астық тұқымдастар сахарозаның жоғары концентрациясын талап етсе /12%-ке дейін/, басқа түрлері күрделі органикалық қосындыларды /казеин гидролизаты/, ашытқы экстракты солод және картоп экстрактылары, кокос сүті/, үшіншілері- темір иондарының белгілі бір ара қатынасын. Эмбриоидтар түзілуін индукциялау үшін қазіргі уакытта алдын-ала гүл кауызын төмен /3-5°С/ және жоғары /ЗО-35°С/ температураларымен өңдеуді кеңінен қолданады. Одан кейін крестгүлділер тозаңқаптарын қоректік ортада 3О°С температурада өсіргенде гаплоидтардың шығуы артқан. Эмбриоидтардан тұтас өсімдік өсіру үшін қоректік орта құрамы да өзгеше болады.
КазМҰУ-ның өсімдіктер физиологиясы және биохимия кафедрасында бидай мен арпа тозаңкаптарын өсіру жұмыстары табысты жүргізілген. Кейбір генотиптер үшін, тозаңқаптарды жасанды ортада өсіргенде, тура және жанама андрогенез алу жолдарын белгілейтін қоректік орта және өсіру жағдайлары іріктеліп алынған, олардың цитоэмбриологаясы зерттелген. Гаплоидтық регенерант өсімдіктер алынды.
Тұтас тозаңқаптарды жасанды ортада өсіргенде сомалық ұлпалардан плоидтылығы әр түрлі өсімдіктер пайда болуы мүмкін, сондықтан оқшауланған гүл тозаңын өсірудің болашағы зор. Бұдан баска, тозаңды ортада өсіргенде тозаңқап ұлпаларында бар, өсуді тежейтін заттардың әсері төмендейді. Тозаңдарды, тозаңқапты кесіп шығарып алады, не болмаса оларды сұйық қоректік ортада өсіреді, бұндай көзде тозаң түйіршіктері өзінен өзі тозаңкаптан ортаға төгіледі. Тозаңқаптары үлкен, тозаң түйірлері ірі және еркін орналасқан өсімдіктер тозаңы механикалық жолмен бөлінеді, мысалы, сасық меңдуана тозаңқаптарын қоректік ортада өсіргенде өнімді мол беретін түр. Көптеген өсімдіктерге, соның ішінде астық тұқымдастарға, бұл әдіс жарамайды, олар үшін қалқыған тозаңқаптар әдісі тиімді. Сонымен қатар бұл кезде тозаңқаптардан жуылып шығатын биологиялық активті заттар есебінен ортаның кұрамы байытылады. Микроспораларды сұйық қоректік ортада өсіргенде тек эмбриоидтар пайда болады, олардан жасыл өсімдіктер өсіп жетіледі. Тозаңдарды қоректік ортада өсіріп алынған регенерант өсімдіктердің ішінде альбиностардың көп болатынын атап өту керек. Олар тозаңның дамуы кезінде болатын бұзылу негізінде пайда болады. Сонымен іп vitro андрогенді гаплоидтар алудың көптеген қиындықтары бар, өйткені бұл мәселенің теориялық зерттелуі жетерліктей деңгейде емес. Біз микроспораның әр түрлі даму кезеңінде морфофизиологиялык процесстердің ішкі және сыртқы факторлармен реттелуінің қалай жүретінін, микроспоралардың тотипотенттілігін іске асыру үшін қандай жағдайлар қажет екендігін тағы сол сияқты сұрақтарға жауабын білмейміз.
Сонымен бірге, қытай зерттеушілерінің бірқатар ауыл шаруашылық дақылдарынан көп мөлшерде гаплоидтық өсімдіктер алуда қол жеткізген табыстарын атау керек. Генотипті, тозаңның даму кезеңін, коректік орта құрамын үйлестіруді, өсіру жағдайларын, микротамшыдағы тозаң тығыздылығын іріктеп алу т.б. ескеріп, олар андрогендік гаплоидтар негізінде күріштің құнды бірнеше сортын, бидайдың, жүгерінің, кара бидайдың, арпаның, темекінің, мақтаның, сояның, тұқымдық капустаның, каучук беретін өсімдіктердің, бұрыш т.б. дақылдар сорттарын шығарды.
3. Арпаның диплоидтық мәдени Hordeum vulgare түрін көп жылдық жабайы пиязшық Hordeum bulbosum түрімен будандастырғанда Hordeum vulgare хромосомалары жиынтығы бар моногаплоидтар шығады. Ұрықтың және эндоспермнің өсуінің бастапқы кезеңінде жабайы түр хромосомалары ұрықтанғаннан кейін 5 күн өткен соң селективті /іріктелген/ жойыла бастайды, яғни элиминациясы басталады. Сөйтіп, Hordeum vulgare хромосомалары толығымен жойылып кетеді, бірақ 15 күннен кейін будан ұрықтың дамуы тоқтап қалады. Оны іп vitro жағдайында өсіріп, будан өсімдікті шығаруға болады.
Тозаңдануға алынған өсімдіктерден будандастырудың екі жағдайында, Hordeum bulbosum аналық және аталық форма ретінде алынғанда да гаплоидтар шығады. Бірінші жағдайда мәдени түрдің жұмыртқа клеткасынан түзілген, яғни аналық белгілері бар гаплоидтар алынады, ал екінші жағдайда мәдени арпаның андрогендік, яғни аталық белгілері бар гаплоидтар пайда болады. Осы әдісті қолданып және будан ұрықтарды іп vitro өсіріп, Одессадағы селекция және генетика институтында дағдылы селекция жұмыстарын жүргізіп жаңа сорт алуға кететін 10-12 жылдың орнына, 4 жылдың ішінде жаздық арпаның жаңа сорттары Исток пен Одесская-115 шығарылған. Канада да осы әдіспен арпаның Минго және Родео сорттары шығарылған. Тозандандырғыш ретінде пайдаланылғанда жабайы арпа бидайда да мысалы, Чайниз Спринг сортында гаплоидтарды алуға жол ашады. Хромосомалардың селективті элиминациясы мен кейін ұрықтарды жасанды ортада өсіруді бірге жүргізгенде, диплоидтық арпадан /2п=14/ тек қана моногаплоидтарды /п=7/ алып қоймай, тетраплоидтық арпадан /2п=28/ дигаплоидтарды /2п=14/ алуға болады. Гаплоидтар ұрықсыз болғандыктан, фертильді өсімдіктер алу үшін, гаплоидтарды міндетті түрде диплойдтық күйге айналдыру керек. Гаплоидтық организмнен алынған дигаплоид өте ерекше гомозигота, таза линия болады.
Пиязшық арпаны будандастыруға пайдаланып және хромосомалар санын екі еселеп, гомозиготалар алуға керек уақытты бірден қыскартады, бұл өте маңызды, өйткені организм гаплоидтық форма күйінде тіршілік ету кезінде рецессивтік гендерден тазарады. Гаплоидтар мутациялық селекция үшін де өте құнды, себебі гаплоидтық деңгейде генетикалық өзгерулерді анықтау жеңіл болады. Хромосомаларды екі еселеу үшін күздік лапыздың алкалоиды-колцихин қолданылады, бірақ ол химиялық мутаген, сондықтан диплоидтану табиғи түрде жүретін болса тіпті жақсы болар еді. Клеткаларды іп vitro өсіру оған қол жеткізудің бірден-бір жолы.
Дәріс №19
Аналық гаметофиттің іn vіtro жағдайында дамуы.
Жоспар:
Аналык гаметафитті өсіріп гаплоидтык өсімдіктерді алу әдісі
Мутагенез және іп vitro жағдайындағы клеткалық селекция
Гаплоидтық хромосомалар жиынтығы микроспорадан басқа тұқым бүршіктің генеративтік клеткасында, яғни жұмыртка клеткасында бар. Тұқым бүршігін өсіріп, гаплоидтық өсімдіктер алу гиногенез деп аталады, бұл апомиксистің /жыныссыз жолмен көбею/ бір түрі.
ГИНОГЕНЕЗ іп уіио - аналық гаметофитті жасанды коректік ортада өсіргенде, аналық хромосомалар жиынтығы бар өсімдіктің пайда болу процессі.
Француз ғалымы Сан Ноум 1976 жылы арпаның ұрықтанбаған түйіндерін жасанды ортада өсіріп, бірінші рет нормалы жасыл гаплоидтық өсімдіктерді алды. Содан бері, әр түрлі жабық тұқымды өсімдіктердің ұрыктанбаған түйіндері мен тұқымбүршіктерін өсіріп гаплоидтық өсімдіктерді шығару төңірегінде көп эксперименттер өткізілді. Солар көрсеткендей, гаплоидтық өсімдіктер аналық гаметофиттің іп vitro аномальды дамуының нәтижесінде пайда болады» оның екі жолы бар: эмбриоидогенез және каллустағы органогенез.
Бұндай гаплоидтық өсімдіктердің құндылығы, олар тек аналық белгілермен тұқым куалайды. Аналық гаметофиттен алынған гаплоидтық өсімдіктердің артықшылығы, олар ешқашан альбинос болмайды. Өсірген түйіндер мен тұқым бүршіктердің цитогенетикалык зерттеулерін өткізгенде, ұрық капшығының ішіндегі клеткалары мен қатар қоршаған сомалық клеткаларының да бөлінуі анықталған. Нуцеллус пен интегументтерден диплоидтық және полиплоидтық өсімдіктер пайда болған.
С.Мұқамбетжанов бидайдың ұрыктанбаған түйіндерін өсіріп, олардың өсуі мен морфогенезін зерттеген. Ол көрсеткендей, ұрық қапшығы клеткалары мен оны қоршаған ұлпаларда мынадай морфогенездік процесстер орын алады: ганогенез /өсімдік жұмыртқа клеткасынан түзіледі/, апогаметия /өсімдік синергидалар мен антиподалардан түзіледі/ және адвентивтік эмбриония /өсімдік нуцеллус пен интегумент клеткаларынан түзіледі/.
Сөйтіп, ұрықтанбаған түйіндер мен тұқым бүршіктерін өсіргенде, каллустардың сомалық диплоидтық клеткаларынан пайда болуы әбден мүмкін. Ал аналық гаметофит өсімдік түйінінде дамитын болғандықтан, оны зақым тигізбей жекелеп бөліп алу өте қиын. Тұқым бүршікті механикалық жолмен не болмаса, қоршап тұрған ұлпаларды пектиназалармен ерітіл фермегатік жолмен бөліп алуы жақсы нәтиже берген жок. Сондықтан аналық қасиеттері бар гаплоидтық өсімдіктерді псевдогамия процессі арқылы алу тиімді. Бұл гаплоидтық партеногенездің өте ерекше түрі, ол үшін тозаңдануды Hordeum bulbosum тозаңымен өткізу керек. Жабайы арпа хромосомаларының селективті элиминациясы салдарынан, регенерант өсімдік аналық клеткадан дамиды және аналықтың барлық белгілерін ұстайды.
2. Жасанды қоректік ортада өскен клеткалардан бастапқы материал алу үшін, жаңа әдіс ретінде табиғи және эксперименттік мутагенезді пайдалану тәжірибелерде кеңінен қолданылуда. Клеткалық селекция -сұрыптаушы қоректік ортаны қолданып, мутант клеткалар мен клеткалардың сомаклондык, вариацияларын бөліп алу әдісі. Клеткалық селекция а/ сомалық клеткалар популяциясының өте жоғары өзгергіштігіне; б/ осы өзгергіштікті түрлі мутагендерді қолданып арттыруына; в/ генетикалық жағынан өзгерген клеткалар клонын аныктайтын және іріктеп алатын селективті жүйелер жасауына негізделген. Өзгерген клеткалардан тотипотенттілік қасиеті арқасында өзгерген өсімдіктер алынады. Клеткалар популяцияларында табиғи мутациялар сирек байқалады, сондықтан мутациялар жиілігін арттыру үшін, индукцияланған мутагенезді қолданады. Өте тиімді мутагендер қатарына у-рентген және ультракүлгін сәулені, метилметансульфонат /ММС/ жатады. Клетка деңгейіндегі сұрыптауды қолданып мутант клеткалар формаларын алу төменде келтірілгендей бірнеше кезеңнен тұрады:
1. клеткалар суспензиясын немесе протопласттарды мутагендермен өңдеу,
2. клеткаларды сұйық коректік ортада өсіру,
3. клеткалар суспензиясын сұрыптау жағдайына ауыстыру,
4. дамып жетіле бастаған колонияларды бөлу,
5. сұрыптау факторына резистенттік /тұрақты/ клондарды іріктеп алу,
6. органогенезді индукциялау,
7. өзгерген өсімдіктер алу.
Жасанды ортада өсірген клеткаларда өзгергіштіктің бірнеше типі болатындығын ескерген жөн, олар: генетикалық, эпигенетикалық, модификациялык, Сұрыптау үшін тек қана тұқым қуалайтын өзгергіштіктің /генетикалық және эпигенетикалық/ маңызы бар екені белгілі.
Антиметаболиттерге, патогендерге немесе стресс факторларға тұрақты мутанттарды іріктеп алу үшін, тура селекция әдісі қолданылады. Мутагенмен өңдегеннен кейін, клеткаларды сұрыптаушы ортада өсіреді. Бұл кезде клеткалардың негізгі бөлігі өледі, тек сол факторға төзімді мутант клеткалар тірі калады.
Кері немесе вегативтік селекция былай жүргізіледі. Жабайы типті клеткалар бөлінеді, ортаға әдейі косылған тимидиннің аналогы ДНҚ құрамына енеді, соның нәтижесінде клеткалар өледі, ал мутант клеткалар көбею қабілетін жояды, бірақ тіршілік қабілетін сақтап қалады. Оларды нормалы қоректік ортаға көшіріп тұрақты линияларын алады.
Клеткалық селекция әдісі арқылы собықтар, сабақ және жапырақ гельмиытоспориозына түракхы жүгері линиялары, фитофторға резистентті картоп линиялары темекі ала мозаикасы вирусына тұракты темекі т.б. өсімдікгер алынған. Қоректік ортада өскен клеткаларға белгілі амин қышкылдарының аналогтарынын, улы концентрациясына сұрыптау жасағанда арнайы аминқышқылдарын мол синтездейтін мутант клеткалар алынған. Сөйтіп бастапқы ата-аналық дақылдармен салыстырғанда бос триптофанды 20-30 есе көп синтездейтін сәбіз және темекі клеткаларының линиялары іріктелініп алынған. Осы әдіс арқылы лизин, метионин, пролин, фенилаланин, глицинді өте көп синтездеуі қабілеті бар картоптың, сәбіздің, жүгерінің, сасық мендуананың т.б. өсімдіктердін линиялары алынған. Жеке амин қышқылдарын көп ұстайтын мутант клеткалардан құрамында ауыстырылмайтын амин қышқылдары мол регенерант өсімдіктер шығуы ғажап емес.
Бұл кұрамында әсіресе ауыстырылмайтын амин қышқылдарының мөлшері көп өсімдіктер алудың бірден-бір жолы. Әр түрлі сұрыптау жүйелерін қолдана отырып, шаруашылықтағы түрлі құнды белгілеріне мысалы, ауруларға, гербицидтерге қарсы тұруға, әр түрлі стресстік әсерлерге /тұздануға, су басуға, төмен және жоғары температураларға/ және басқа төзімділікке бағытталған селекцияны жүргізуге болады.
Әрбір жағдайда мутанттар алу үшін, селекция схемасын жасау және өзгерген клеткалар линияларының генетикалық табиғатын дәлелдеу керек. Алынған өзгерістер барлық уақытта бірдей мутациялармен байланысты емес, модификациялық сипатта болуы және де тұкым куаламауы мүмкін. Мутацияның дәлелдемесі бірнеше белгілер жиынтығы болғандықтан, бұл күрделі жұмыс:
1/ Өзгерген клеткалар жиынтығы өте төмен болуы керек/1*10 - 107 кл/мл /
2/ Мутагендерді колданған кезде өзгерген клеткалар жиілігі әжептеуір жоғарылайды/110~4 -10"3 кл/мл /
3/ Өзгерген клеткалар ұзақ уақыт бойы бір қалыпты өсуге қабілетті болуы керек.
4/ Селективтік қысым болмағанның өзінде өзгерген белгінің түрақтылығы
5/ Өзгерген ген өнімінің білінуі.
Гаплоидтық клеткаларға мутаген әсерінің тиімділігі артады, себебі оларда барлық рецессивтік мутациялар ертеден көрінеді. Сондай-ақ протопласттарды да мутагенмен өңдеу, олар біркелкі болғандықтан тиімді келеді. Сондықтан әр түрлі мутацияларды алудың ерекше жолы ол гаплоидтык өсімдіктердің протопласттарын қолдану.
Мутанттарды іріктеп алу үшін гаплоидтық протопласттарды қолданудың үлгісі ретінде Карлсон жұмысын келтіруге болады. Ол табиғатта темекі ауруын тудыратын токсинге ұқсас әсері бар метионинсульфоксиминге тұрақты клеткаларды іріктеп алу үшін, гаплоидтық темекі өсімдігінің протопластарын пайдаланды. Іріктеп алынған клеткалардан пайда болған өсімдіктер ауруға тұракты болып шықты.
Мутанттарды іріктеп алу үшін, гаплоидтық клеткалардың тағы бір түрі микроспоралар болып табылады.
Дәріс №21
Мутагендердің клеткаларға əсері.
Жоспар:
Клетка деңгейіндегі сұрыптауды қолданып мутант клеткалар формаларын алу
Мутагенез және іп vitro жағдайындағы клеткалық селекция
Клеткалық селекция әдістері
Жасанды қоректік ортада өскен клеткалардан бастапқы материал алу үшін, жаңа әдіс ретінде табиғи және эксперименттік мутагенезді пайдалану тәжірибелерде кеңінен қолданылуда. Клеткалық селекция -сұрыптаушы қоректік ортаны қолданып, мутант клеткалар мен клеткалардың сомаклондык, вариацияларын бөліп алу әдісі. Клеткалық селекция а/ сомалық клеткалар популяциясының өте жоғары өзгергіштігіне; б/ осы өзгергіштікті түрлі мутагендерді қолданып арттыруына; в/ генетикалық жағынан өзгерген клеткалар клонын аныктайтын және іріктеп алатын селективті жүйелер жасауына негізделген. Өзгерген клеткалардан тотипотенттілік қасиеті арқасында өзгерген өсімдіктер алынады. Клеткалар популяцияларында табиғи мутациялар сирек байқалады, сондықтан мутациялар жиілігін арттыру үшін, индукцияланған мутагенезді қолданады. Өте тиімді мутагендер қатарына у-рентген және ультракүлгін сәулені, метилметансульфонат /ММС/ жатады. Клетка деңгейіндегі сұрыптауды қолданып мутант клеткалар формаларын алу төменде келтірілгендей бірнеше кезеңнен тұрады: 1/ клеткалар суспензиясын немесе протопласттарды мутагендермен өңдеу, /клеткаларды сұйық коректік ортада өсіру, 3/ клеткалар суспензиясын сұрыптау жағдайына ауыстыру,4/ дамып жетіле бастаған колонияларды бөлу, 5/ сұрыптау факторына резистенттік /тұрақты/ клондарды іріктеп алу, 6/ органогенезді индукциялау, 7/ өзгерген өсімдіктер алу. Жасанды ортада өсірген клеткаларда өзгергіштіктің бірнеше типі болатындығын ескерген жөн, олар: генетикалық, эпигенетикалық, модификациялык, Сұрыптау үшін тек қана тұқым қуалайтын өзгергіштіктің /генетикалық және эпигенетикалық/ маңызы бар екені белгілі.
Антиметаболиттерге, патогендерге немесе стресс факторларға тұрақты мутанттарды іріктеп алу үшін, тура селекция әдісі қолданылады. Мутагенмен өңдегеннен кейін, клеткаларды сұрыптаушы ортада өсіреді. Бұл кезде клеткалардың негізгі бөлігі өледі, тек сол факторға төзімді мутант клеткалар тірі калады.
Кері немесе вегативтік селекция былай жүргізіледі. Жабайы типті клеткалар бөлінеді, ортаға әдейі косылған тимидиннің аналогы ДНҚ құрамына енеді, соның нәтижесінде клеткалар өледі, ал мутант клеткалар көбею қабілетін жояды, бірақ тіршілік қабілетін сақтап қалады. Оларды нормалы қоректік ортаға көшіріп тұрақты линияларын алады.
Клеткалық селекция әдісі арқылы собықтар, сабақ және жапырақ гельмиытоспориозына түракхы жүгері линиялары, фитофторға резистентті картоп линиялары темекі ала мозаикасы вирусына тұракты темекі т.б. өсімдікгер алынған. Қоректік ортада өскен клеткаларға белгілі амин қышкылдарының аналогтарынын, улы концентрациясына сұрыптау жасағанда арнайы аминқышқылдарын мол синтездейтін мутант клеткалар алынған. Сөйтіп бастапқы ата-аналық дақылдармен салыстырғанда бос триптофанды 20-30 есе көп синтездейтін сәбіз және темекі клеткаларының линиялары іріктелініп алынған. Осы әдіс арқылы лизин, метионин, пролин, фенилаланин, глицинді өте көп синтездеуі қабілеті бар картоптың, сәбіздің, жүгерінің, сасық мендуананың т.б. өсімдіктердін линиялары алынған. Жеке амин қышқылдарын көп ұстайтын мутант клеткалардан құрамында ауыстырылмайтын амин қышқылдары мол регенерант өсімдіктер шығуы ғажап емес.
Бұл кұрамында әсіресе ауыстырылмайтын амин қышқылдарының мөлшері көп өсімдіктер алудың бірден-бір жолы. Әр түрлі сұрыптау жүйелерін қолдана отырып, шаруашылықтағы түрлі құнды белгілеріне мысалы, ауруларға, гербицидтерге қарсы тұруға, әр түрлі стресстік әсерлерге /тұздануға, су басуға, төмен және жоғары температураларға/ және басқа төзімділікке бағытталған селекцияны жүргізуге болады.
Әрбір жағдайда мутанттар алу үшін, селекция схемасын жасау және өзгерген клеткалар линияларының генетикалық табиғатын дәлелдеу керек. Алынған өзгерістер барлық уақытта бірдей мутациялармен байланысты емес, модификациялық сипатта болуы және де тұкым куаламауы мүмкін. Мутацияның дәлелдемесі бірнеше белгілер жиынтығы болғандықтан, бұл күрделі жұмыс:
1/ Өзгерген клеткалар жиынтығы өте төмен болуы керек/1*10 - 107 кл/мл /
2/ Мутагендерді колданған кезде өзгерген клеткалар жиілігі әжептеуір жоғарылайды/110~4 -10"3 кл/мл /
3/ Өзгерген клеткалар ұзақ уақыт бойы бір қалыпты өсуге қабілетті болуы керек.
4/ Селективтік қысым болмағанның өзінде өзгерген белгінің түрақтылығы
5/ Өзгерген ген өнімінің білінуі.
Гаплоидтық клеткаларға мутаген әсерінің тиімділігі артады, себебі оларда барлық рецессивтік мутациялар ертеден көрінеді. Сондай-ақ протопласттарды да мутагенмен өңдеу, олар біркелкі болғандықтан тиімді келеді. Сондықтан әр түрлі мутацияларды алудың ерекше жолы ол гаплоидтык өсімдіктердің протопласттарын қолдану.
Мутанттарды іріктеп алу үшін гаплоидтық протопласттарды қолданудың үлгісі ретінде Карлсон жұмысын келтіруге болады. Ол табиғатта темекі ауруын тудыратын токсинге ұқсас әсері бар метионинсульфоксиминге тұрақты клеткаларды іріктеп алу үшін, гаплоидтық темекі өсімдігінің протопластарын пайдаланды. Іріктеп алынған клеткалардан пайда болған өсімдіктер ауруға тұракты болып шықты.
Мутанттарды іріктеп алу үшін, гаплоидтық клеткалардың тағы бір түрі микроспоралар болып табылады.
Сомалық клеткалар мен жыныстық клеткаларында жасалатын мутагенез және клеткалық селекциясы генетикалық өзгерістері бар формаларын алудың тиімді жолы. Осы жолдар арқылы бидайдың, арпаның, томаттың, қиярдың гербицидтерге жоғары төзімділігімен ерекшеленетін, топырактың тұздылығына және өнеркәсіптік ластағыштар /ауыр металлдар/ әсеріне тұрақты сорттары алынған.
По сравнению с экспериментальным мутагенезом на уровне целых растений метод мутагенеза на уровне клеток имеет ряд преимуществ:
- экономится площадь, так как в одной чашке Петри диаметром 10 см можно культивировать 107 – 108 клеток, а для такого же количества растений необходима площадь свыше тысячи гектаров;
- мутантные признаки на уровне отдельных клеток проявляются довольно быстро;
- возможно получение новых типов мутаций, в том числе и биохимического характера;
- экономится время и трудозатраты на получение нового желаемого признака.
Основным требованием для успешного использования клеточного мутагенеза является хорошо разработанная система регенерации растений. Важным условием является также возможность получения гаплоидов у того или иного вида растений. В дальнейшую селекционную работу включаются только те генотипы, у которых мутации проявляются на уровне целого растения.
Растения с измененными признаками, полученные в результате мутагенеза на клеточном уровне, называются вариантами (термин «мутант» используется тогда, когда мутация подтверждается генетическими или молекулярно-генетическими методами). Рекомендуются следующие обозначения: R0 – растения-регенеранты, полученные из соответствующих клеточных клонов, R, R2 и т.д. – первое и последующее поколения после самоопыления.
Общая схема получения мутантных форм путем селекции
на клеточном уровне состоит из нескольких этапов (рис. 17):

Измененные при мутагенной обработке клетки могут быть выделены в условиях культивирования in vitro путем прямого и непрямого отборов, а также при тестировании отдельных клеточных колоний. Прямой отбор состоит в добавлении к питательным средам отдельных компонентов, к которым обычные, неизмененные клетки не устойчивы. Непрямой отбор (негативная селекция) заключается в создании условий культивирования, при которых рост неизмененных клеток либо задерживается, либо эти клетки погибают (например, культивирование при низких или высоких температурах на средах с недостатком отдельных компонентов и т.д.).
Существует ряд факторов, ограничивающих селекцию in vitro Многие хозяйственно важные признаки, такие, как урожайность, количество зерна, устойчивость к пестицидам и другие трудно или практически невозможно получить при культивировании in vitro поскольку они не проявляются на клеточном уровне. Недостаточно также биохимических и молекулярных маркеров, которые коррелировали бы с этими признаками на уровне целых растений.
Не все селектируемые признаки, проявляющиеся на уровне клеток, сохраняются на уровне растений - регенерантов. Тому несколько причин: некоторая часть изменений не затрагивает генетический аппарат клетки, поэтому не сохраняется у потомков; генетические изменения могут элиминироваться в процессе дифференциации и мейоза; функция мутированного гена может быть ограничена состоянием дифференцируемых и культивируемых клеток; мутация одного гена может сопровождаться активацией различных генов, кодирующих изоферменты; часть генотипов неспособна регенерировать нормальные фертильные растения.
Дәріс №22
Сомаклондық варианттардың алуан түрлілігі.
Жоспар:
Iп vitro өсіргенде генетикалық өзгергіштік
Клеткалық селекцияның әдістері
Сомаклондық варианттардың түрлері
Генетикалық өзгерістері бар каллус клеткаларынан регенерант өсімдіктер шығару процесінде кейбір мутациялар регенеранттарға өтуі мүмкін. Сондықтан көбінесе регенерант өсімдіктердін бастапқы донорлық өсімдіктерден айырмашылықтары болады. Осындай өсімдіктерді сомаклондық варианттар деп атайды. Бұл ауытқулар тіршілік әрекеттерінін қай-қайсысында да болуы мүмкін. Осының нәтижесінде бастапқы өсімдіктен морфологиялық белгілері, онтогенез кезеңдерінің ұзақтығы, өнімділігі, аурулар мен қолайсыз жағдайлар төзімділігі жағынан айырмашылықтары бар өсімдіктер пайда болады. Сомаклондык өзгергіштік құбылысын генетикалық өзгергіштік деп түсінуге болады. Сонымен сомаклондык варианттар деп іп vitro клеткаларды өсіргенде генетикалық өзгергіштік нәтижесінде пайда болатын бастапкы өсімдіктен айныған регенерант өсімдіктерді атайды. Регенерант өсімдік сомаклондық мутант екендігін дәлелдеу үшін жыныстык жолмен көбейетін түрлердің регенеранттарын өздігінен тозандандырып және тиіс" будандастырулар арқылы генетикалық тексеруден өткізу керек. Жыныссыз жолмен көбейетін түрлерде генетикалық өзгерістер мейоз арқылы берілмейді, сондықтан оларды дәлелдейтін жағдайда клондық көбейтудің тым болмаса екі циклінде жана белгіңің сакталуы керек.
Сомаклондык варианттар орнына мына терминдер де пайдаланылады: клеткалык варианттар, варианттық линиялар, фенотиптік варианттар. Протопластардан алынған сомаклондық варианттарды протоклондар деп, ал каллустан алынғанда каллустық клондар деп атайды. Фенотиптік варианттарды бірінші байқаған Д. Шепард еді. Ол картоп протопластарынан мындаған рсгенерант өсімдіктерін шығарды. Олардың ішінде аномальдық ядродағы хромосомалар саны өзгерген тіршілікке икемсіз Өсімдіктермен бірге ол бастапқы хромосомалар саны сақталған, бірақ картоптың солу ауруын қоздыратын саңыраукұлақ токсиніне төзімді өсімдіктерді байқады. Кейінірек Д. Шепард кариотипі нормалы 65 протоклонлониялары да 35 белгілерді (морфология, жапырақтардың, гүлдердің, түйнектердің түсі т.б.) анықтады. Олардың тіпті күрделі генетикалық белгілері де өзгерген, мысалы, түйнектер өнімі. Сомаклондық өзгергіштік әр түрлерге жататын көптеген өсімдіктерде байқалады.
Әсіресе, қызықтыратын астық тұқымдастарының сомаклондық варианттары, себебі олар бағалы генотиптерді шығарудың қайнар көзі. Өсімдіктердің биіктігі, қылтанақтың ұзындығы, дәннің түсі, масақтың формасы, белоктардың электрофорездік спектрі сияқты белгілері өзгерген бидайдың, арпаның, күріштің каллустық клондары алынған. Бидайда сомаклондық өзгергіштік морфология белгілерінен де, биохимиялық белгілерінен де көрінеді, және де жалғыз ген бақылайтын белгілері бойынша да (глиадиндер, дәннін тусі), сондай-ақ көп гендер бақылайтын белгілері бойынша да (өсімдіктің биіктігі, масақтану мерзімі, өнімділігі) көрінеді. М.Карабаев бидайдың РуБФК-нын активтігінде карбоксилазаның активтігі артқан сомаклондарын алған. Бұл өте манызды жағдай, себебі бұл ферменттің карбоксилазалық активтігі мен оксигеназалық активтігінің ара қатысын бұдан бұрын ешкім ешқандай әдісімен өзгерте алмаған. Яғни өсірілетін клеткаларда фотосинтездей күрделі процесті де өзгерту мүмкін екен. Бұл мәселенің маңызы зор, өйткені іп vitro-да өсірілетін клеткаларға сүйеніп, фотосинтез жөнінде мағлұматты тереңдетумен бірге оның генетикалық негізін өзгертуге жол ашылады.
Астық тұқымдылардың түрлі тұқымдастарына жататын өсімдіктердің каллустардан алынған регенеранттарында ұқсас морфологиялыұ өзгерістері байқалған. Кейбір авторлардың деректері бойынша, сол өсімдіктердің ұзындығы, сабақ пен жапырақ саны, масактың (шашақ гүлдің, собықтың) ұзындығы, масақтағы дәннің саны және 1000 дәннің салмағы көбінесе төмендеген. Дегенмен, кейбір сомаклондық варианттардың пайдалы қасиеттері болады. Оларды селекцияда қолдануға болады. Жүгеріде, қант қамысында, томатта, картопта сомаклондық өзгергіштік жан-жақты талданған және солардың арасынан тиімді сомаклондык варианттар іріктеп алынған.
Сомаклондық згергіштің себептері
Өсірілетін клеткалардағы қандай да болсын өзгергіштікті тек хромосомалардың саны өзгеруімен, кейде хромосомалардың құрамындағы өзгерістерімен, нүктелік мутацияларымен, цитоплазмалық гендердің өзгерістерімен байланысты деп сонғы кездерге дейін есептеліп келеді. Бірақ сомаклондық өзгергштік өте күрделі құбылыс, оның тек осы себептер нәтижесінде өтеді деп түсіну жеткіліксіз. Молекулалық генетиканың соңғы мәліметтері бойынша, эукариот клеткасында генетикалық материалдың ұйымдасуы қаншама күрделі болса, іп vitro өсірілген клеткаларда өтетін өзгергіштік процестерді түсіну де соншама қиын.
Сомаклондық өзгергіштікті жан-жақты зерттеген австралиялық ғалым У.Скаукрофт пікірі бойынша, оның себептері кариотиптік кемшілікте, хромосомалық аберрацияларда, гендердің репликациясында немесе редукциясында, жылжымалы ген элементтердін ауыспалылығында, дифференцировкаға байланысты гендер құрамындағы өзгерістерде және кроссинговерде. Хромосомалар құрылысындағы кемшіліктер (аберрациялар) тұқым қуалайтын өзгерістерінің кең (4ІІс кол түрлі класы, ол генетикалык материалдын бір бөлігінің жойылуын (делецияны), екі еселенуін (дупликацияны), тұрақтылығы (транслокацияны), 180° айналуына (инверсия) бір (хромосома ішінде немесе бірнеше хромосомалар арасында өтуін қамтиды.
Өсірілетін ұлпаларда хромосомалық аберрациялар өте жиі кездеседі, сондықтан олардың елеулі фенотиптік өзгерістерге әкеліп соғуы әбден мүмкін. Бірақ регенерант өсімдіктер мен ұрпақтары арасында хромосомалық аберрациялар сирек кездеседі, себебі даму кезінде олар элиминацияға ұшырайды (жойылады). Мысалы, регенеранттарда морфогенезге тиым ічпііі ІІ.ІІІ хромосомалык аберрациялар кездеспейді. Сонымен қатар, сомаклондық варианттардың ұрпақтарында ұрықсыздыққа апаратын хромосомалық аберрациялар да болмайды.
Өсімдіктің іп УІІГО өсірген клеткалары мен солардан шыққан мутант өсімдіктерінде ДНК, сандық және сапалық өзгерістер анықталған. Осының нәтижесінде мынадай қорытынды жасауға болады: ДНК нуклеотидтерінін амплификациясы немесе деамилификациясы сомаклондық өзгергіштіктің себебі бола алмайды. Оның амплификациясы сол ген кодтайтын ерекше затты арттыруы мүмкін.
Жылжымалы гендік элементтер (транспозондар) хромосома бойымен қозғалып, құрылымдық гендерді тежеуі, гендерді реттеу Іиргібім өзгертуі, істемей тұрған гендерді активтеуі және дупликациялар мен делецияларды туғызуы мүмкін. Жылжымалы гендік элементтер өздерінің орнын ауыстыру арқылы генетикалық өзгеріске, мутагенезге және хромосомалардың құрылымының өзгерістеріне әкеліп соғады. Бірақ транспозондар сомаклондык өзгергіштіктің себептері екендігі тәжірибе арқылы дәлелденбеген. Сонда да кейбір деректер осыны құптайды. Мысалы, Д.Шепард картоптың бір сортынан 17 белгісі бойынша айырмашылықтары бар сомаклондық варианттарын алған. Ол зерттеген 65 сомаклондардың арасында әрқайсысы бастапқы сорттан орташа алғанда 7 белгісі бойынша айырмашылығы болған. Мұндай бірегей өзгергіштік тек транспозондардың әсерінен болуы мүмкін деп түсіндіруге болады. Осыған ұқсас бір мезетте көптеген белгілердің сәйкес өзгеруі бидайдың сомаклондарында да байқалған.
Сомаклондық өзгергіштіктің себептерін талдау одан ары күрделенеді, егер оның негізінде генетикалық өзгергіштіктен басқа тағы да эпигенетикалық өзгергіштік жатса, яғни геном құрылымы сақталып, гендер активтілігі ғана тұқым қуалай өзгерсе. Бұл жағдайда ең маңызды мәселе, ол мынаны анықтау: орын алған тқұым қуалайтын өзгерістердің қайсысы мутациялық (генетикалық) окиғалардың нәтижесінде пайда болды, ал қайсысы гендердің экспрессиясы өзгеруі, яғни эпигенетикалық өзгерістер салдарынан пайда болды? Бұл сұраққа тікелей жауап табу өте қиын, өйткені эпигенетикалық өзгерістер мен мутациялардың арасындағы айырмашылықтар әлі белгісіз. Сондықтан тұқым қуалайтын өзгерістері бар барлық өсімдіктерді әзірше клеткалық варианттар, варианттық линиялар, фенотиптік варианттар т.с.с. деп екіұшты терминдермен атайды.
Сомаклондық өзгергіштіккв әсер ететін факторлар
In vitro өсіру кезінде пайда болатын өзгергіштіктің молдығына донорлық өсімдіктің генотипі әсер етеді. Мысалы, арпаның хромосомалық аномалиялары, бидайдың, таңқурайдың, бегонияның морфологиялық өзгерістерінің жиілігі түрлі сорттарында әр килы болған. Күріште өзгерістердің пайда болу жиілігі мен олардың әр түрлілігі өсіру жағдайына емес, сорт табиғатына байланысты болған.
Сомаклондык өзгергіштіктің пайда болуы сондай-ақ қоректік ортанын құрамына да байланысты, әсіресе фитогормондарға. Гормондар құрамының өзгеруі клетка циклінің кинетикасы мен митоздың өзінің де клеткалар мен регенеранттарда өзгеруіне әкеліп соғады. Клеткаларды бүтін өсімдіктен бөліп алып, жасанды ортада өсірудің өзі олардың гормондық балансын
Ү.пняны өсіру мерзімінін ұзақтығы хромосомалық аберра-нниліірды көбейте түседі. Сондықтан каллустан алынған каллустық клондық варианттардын жиілігі каллусты өсіру мерзімі мммигамына қарай арта түседі. Мысалы, арпада цитогенетикалык іИІнмІІІІдык өсімдіктердің пайда болу жиілігі ұлпаларды өсіру Мр|иіміие байланысты болған. Бұл аномалиялар хромосомалардың у ІҺІ УІІ І , жоғалуын, алмастырьшуын және анеуплодияны қамтиды.
Сомаклондық өзгергіштікті зерттеу теория тұрғысынан генетикалық өзгергіштіктің механизмдерін түсіну үшін маңызды. Практикалық жағынан, өсірілетін клеткаларды өсімдік селекциясында кеңінен колдану үшін кажет. Сомаклондык өзгергіштіктін селекция үшін манызы, ол өсімдіктердін жана формаларын будандастыруды қолданбай-ақ генетикалық вріімуаилылыкты молайту мүмкіншілігі. Шаруашылықтық маңызды белгілері бар күріштің, бидайдың, жүгерінің, қант қамысының, жонышқаның, картоптың, рапстың, зығырдың сомаклондық варианттары алынған. Сомаклондық өзгергіштік негізінде апельсин мен шабдалының жаңа сорттары шығарылған.
Қазақстан ғалымдарының зерттеулері нәтижесінде бидай, арпа жүгерінің мыңдаған регенерант өсімдіктері алынып, түрлі географиялық аймақтарда селекциялық және генетикалық зерттеулер жүргізу үшін қолданылады. Егіншілік ғылыми-зерттеу институтында сомаклондармен жұмыс істеліп, 200-ге таяу линиялар алынған. Олар изогендік линияларды жасау үшін шаруашылыққа бағалы белгілердің кайнар көзі ретінде пайдаланылады. Акмола аграрлык университетінде сомаклондык «варианттарын сұрыптау негізінде бидайдың «Кенжеғали» деген сорты шығарылды.
Сонымен, іп vitro жағдайында болатын сомаклондық өзгергіштік- нақты құбылыс, оны пайдалы өзгерістерді алудың көзі ретінде маңызды ауыл шаруашылық дақылдары сорттарын жақсарту үшін тиімді түрде қолдануға болады, бірақ, өкінішке орай оның бір кемшілігі бар, ол өзгергіштікті зерттеушінің бакылай алмайтыны
Тараудың қысқаша мазмұны
In vitro өсірілетін клеткалар морфологиялык, генетикалык, биохимиялык, физиологиялык өзгерістерге ұшырайды. Бұл өзгерістердің кейбіреулері тұқым қуалайды, ал басқалары тұқым қуалай алмайды. Негізгі тұқым қуалайтын өзгерістер, яғни генетикалық өзгерістер, ол мутациялар. Олар гендер, хромосомалар немесе геном деңгейінде жүреді, немесе ядродан тыс орналаскан цитоплазмалық гендерді қамтиды. Бұдан басқа, тұқым қуалайтын өзгерістерге эпигенетикалық өзгерістер де жатады. Бұл өзгерістер геном құрамына емес, тек қана гендер активтігіне байланысты.
Клеткалық селекция деп клеткалардың белгілі бір типінің басымдылықпен көбеюін түсінеді. In vitro жағдайында өткізетін клеткалық селекцияның артыкшылығы, ол сұрыптауға бір мезгілде миллиондаған клеткаларды қатыстыруға мүмкіндік бере алатындығы. Ал әр клеткадан регенерант өсімдік шығаруға болады. Клеткаларды өсіре отырып, патотоксиндерге, амин қышқылдары мен нуклеотидтердің аналогтарына, тұздар мен ауыр металдардың жоғары концентрацияларына төзімді өсімдіктерді сұрыптап алуға болады. Селективтік ортада тірі қалатын төзімді клеткаларды сұрыптау тура селекция деп аталады. Ал егер жабайы клеткалар бөлінуге жағдай жасалып, мутант клеткалар бөлінбей сау калса, оны кері селекция дейді. Бірақ жабайы клеткалар бөліну кезінде өздерінің ДНК. құрамына ортаға қосылған тимидиннің аналогін енгізіп көп кешікпей құриды. Мутант клеткалар басқа ыңғайлы қоректік ортаға көшірілген сон бөлініп, төзімді линияларды береді. Мутанттар алу үшін көзделген мақсатқа сәйкес селекцияның жеке схемасы қажет және де клеткалар линияларының өзгергіштігінің генетикалық табиғатын дәлелдеу керек.
Төзімді клеткалар каллус клеткаларынан, клеткалар суспензиясынан, протопластардан сұрыпталып алынады. Сұрыптау жұмысы бір сатылы (селективтік фактор бір-ақ жоғары концентрацияда) немесе көп сатылы (селективтік фактордың концентрациясын біртіндеп өсіреді) болады. Тұрақты клеткалар линияларын алу үшін соңғы әдісті қолданған жөн.
Төзімділік белгісінің тұрақтылығы клеткалық селекциядағы манызды мәселе. Тұрақты линияны шығару өте ұзак процесс, себебі төзімділікті сақтап қалу үшін клеткаларды селективтік ортада қайта-қайта неше дүркін (4-6 рет) өсіру керек. Кейін 2-3 рет селективтік факторы жоқ ортада, ал кейін тағы да селективтік ортада қайта өсіру кажет. Осындай жағдайда тек кана төзімділігі генетикалық негізде пайда болған клеткалар тірі калады. Бірақ төзімділік механизмдері клетка мен организм денгейінде бірдей болмауы мүмкін, сондықтан төзімді клеткалардан ылғи да төзімді регенеранттар шыға бермейді. Клеткалык селекция әдісімен бидайдың, арпаның, күріштің, томаттың, киярдың гербицидтерге, топырақтың тұздануына және ауыр металдардың әсеріне төзімді сорттар шығарылған. Картоптың, сәбіздің, күріштің, сасық мендуананың бірқатар амин қышқылдарын артық мөлшерде синтездейтін клеткалар линиялары алынған.
Сомаклондык варианттар деген донор өсімдіктерден өзгешелігі бар регенерант өсімдіктер. Олар іп vitro жағдайында клеткалардағы генетикалық өзгергіштіктің нәтижесінде пайда болады. Сомаклондық өзгергіштіктің себептері әр алуан: 1) кариотиптік өзгергіштік; 2) хромосомалардын аберрациялары; 3) гендер амплификациясы немесе редукциясы; 4) транспозондар; 5) дифференциациямен байланысты гендер күрамынын өзгеруі; 6) сомалык кроссинговер.
Сомаклондық өзгергіштікке генотип, қоректік ортаның құрамы, өсіру мерзімінің ұзактығы әсер етеді.Сомаклондық өзгергіштіктің селекцияда практикалық маңызы зор, өйткені ол өсімдіктердің биологиялық алуандылығының көзі бола алады.
1. In vitro өсірілетін клеткаларда қандай өзгерістер болады?
2. Клеткалык селекция деген не, оның артықшылығы неде?
3. Клеткалық селекцияның әдістері.
4. Қажетті белгісі бар клеткаларды қалай сұрыптап алады?
5. Белгілері тұрақтанған клеткалар линияларын қалай шығарады?
6. In vitro жағдайында клеткаларда қандай мутациялар жүреді?
7. Клеткалардың мутагенезін қалай индукциялайды?
8. Сомаклондық варианттар деген не, олар неге іп vitro пайда болады?
9. Сомаклондық өзгергіштікке қандай факторлар әсер етеді?
10. Сомаклондық варианттарды пайдалану жолдары.
Дәріс №23
Тіршілікке қабілетті протопластарды алу және оларды іn vіtro жағдайында өсіру
Жоспар:
1. Протопластарды қосу арқылы будандастыру
2. Протопластарды бөліп алу.
3. Протопластардын тіршілікке икемділігі, оған әсер ететін факторлар
4. Протопластарды іп vitro-да өсіру
5. Протопластардан регенерант өсімдіктер шығару
6. Протопластардың бір-бірімен құйылысып қосылуы
1. Жасушалық инженерия - клеткаларды өсіру, оларды будандастыру және қайта құрастыру арқылы жасушаның мүлдем жаңа типін жасау әдістерінің негізінде қалыптаскан биотехнологияның саласы. Клеткаларды жасанды жолдармен будандастырғанда, сомалық (жыныстық емес) клеткаларды бір-біріне қосқанда будан геном түзіледі. Будандастырудың бұл тәсілінде аталық және аналық клеткалар ретінде жыныстық клеткалар (гаметалар) емес өсімдіктің дене (сомалық) клеткалары қосылады. Алдын ала протопластарын бөліп алады, белгілі жағдайда олар бір-бірімен құйылысады. Пайда болған сомалық будан клеткадан кейін регенерация арқылы будан өсімдіктер өсіп шығады.
Протопластарды қосу арқылы будандастыруды әр түрлі атайды: сомалық будандастыру, парасексуальды будандастыру, жыныстық емес будандастыру. Көбінесе бірінші термин колданылады, ал пайда болған будан сомалык будан деп аталады.
Жасушаны қайта құрастыру (реконструкция) - жасушаның құрамына кіретін ядроны, цитоплазманы, митохондрияларды, хлоропластарды, хромосомаларды бір клеткадан басқа клеткаға көшіру негізінде мүлдем жаңа жасушаны жасау. Осындай әрекеттер нәтижесінде ядролық және цитоплазмалық гендер тіркестігі әдеттегідей емес, тіпті өзгеше клеткалар пайда болуы мүмкін. Одан да артық ғалымдарды қызықтыратыны, ол жеке хромосомаларды тасымалдау арқылы анеуплоидтық линияларды алу мүмкіншшгі. Протопласт бөтен ДНК-ны қабылдай алатын өте ынғайлы жүйе. Сол ДНК клеткаға енгізіп және оның экспрессиясын қамтамасыз ету арқылы генетикалық өзгертілген өсімдіктерді алуға болады. Сөйтіп, протопластарды бөліп алу, өсіру, қосу және оларға клеткалық органоидтарды, жеке хромосомаларды, тіпті ДНК енгізу генетиктер мен селекционерлерге будан өсімдіктердің алуан түрлілігін арттыруға мүмкіншілік туғызады.
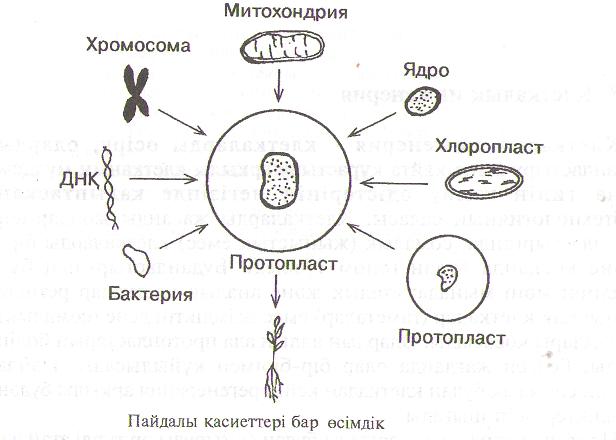
Сурет. Окшауланеан протопластарға негізделген клеткалык инженерия әдісі.
2. Протопласт деген ферментердің әсерімен немесе механикалық әдістермен қабығы түгел жойылған өсімдік клеткасы. Ағылшын ғалымы Э. Кокинг 1960-шы жылдардың басында клетканың ішіндегі протопласты зақымдамай тірі күйінде бөліп алу әдісін жете зерттеп дайындады. Ол томат тамырларының ұштарын, зең саңырауқұлақтар өсірген ортасына бөліп шығарған гидролиздік ферменттерімен өңдеп, протопластарды ферменттік әдісімен бөліп алды.
Әдетте тірі клеткада протопласт жасушаның қабырғасына орталық вакуольдің тургор, яғни кернеулік қысымымен тығыз жанасып тұрады. Клетка қабығы арқылы плазмалеммамен қоршалған цитоплазмалық жінішке жіпшелер өтеді, солар арқылы көршілес клеткалардың протопластары біріне-бірі жалғасып жатады. Сондықтан жасуша қабығын ферментпен еріткен кезде, протопластарға зиян келтірмей клеткаларда плазмолизді жүргізеді. Осмотик ретінде сахароза, маннит, сорбит қолданылады. Осы заттардың гипертониялық ерітінділері әсерінен вакуоль сусызданып жиырылып, протопласт көлемі кішірейіп, соңынан қабықтан алшақтайды. Кейде жасуша сопақ болғанда протопласт плазмолиз кезінде екі бөлініп кетуі мүмкін. Сондай ядросы жоқ субпротопласт цитопласт деп аталады.
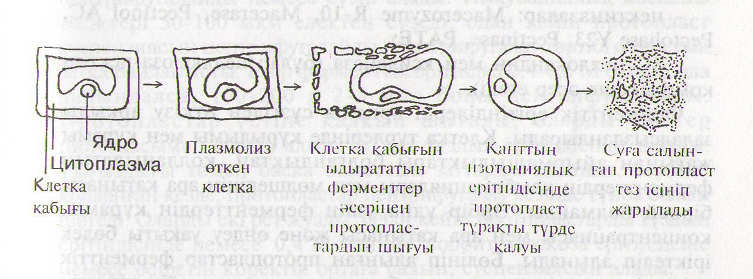
Сурет. Протопластарды бөліп алу.
1968 жылы жапон ғалымы Такебе темекі жапырағынын мезофилл клеткаларынан протопластарды көп мөлшерде алудың тиімді әдісін жете зерттеп дайындады. Алдымен жапырақты 70 %-тік этанолда стерильдейді, кейін 15-20 мин 10 %-тік кальций гипохлоритінде ұстап, дистильденген суда шайып алады. Астыңғы эпидермисті алып тастап, жапырақты майда бөліктерге кесіп, пектиназа ферментінің ерітіндісіне салады. Пектиназа клетка-аралық қабаттың заттарын ерітеді, яғни мацерация өтеді. Одан кейін объект целлюлаза ферментінін ерітіндісімен өнделеді, бұл кезде целлюлозалық клетка қабығы біржолата жойылады. Фермент ерітіндісіне осмостық зат қосылады. Осы әдіспен әр түрлі өсімдіктердің ұлпаларынан протопластар алынады.
Қазіргі уақытта протопластарды бөліп алу үшін ферменттердің коспасын пайдаланады. Бұл қоспаның құрамында ферменттердің үш түрі болады пектиназалар, целлюлазалар және гемицеллюлазалар. Олар клетка қабығының негізгі компоненттерін ыдыратады. Бұл ферменттерді кейбір бактериялар мен саңырауқұлактар өздерін өсірген сұйық ортаға бөліп шығарады, сонымен қатар оларды ұлудың асқорыту сөлінен бөліп алады. Қазіргі уақытта пектиназалық және целлюлазалық әсері бар бірталай стандарттық ферменттер бар. Олардың фирмалық аттары әр түрлі, атап айтқанда мыналар:
- целлюлазалар
- гемицеллюлазалар;
- пектиназалар:;
- целлокандин мен ксиланаза (бұлар целлюлоза-пектин комплексіне әсер етеді).
Ферменттік ерітінділерді арнайы сүзгіден өткізу арқылы залалсыздандырады. Клетка түрлерінде құрылымы мен құрамы жағынан айырмашылықтары болғандықтан, қолданылатын ферменттердің комбинациялары мен мөлшерінің ара қатынасы бірдей болмайды. Әрбір ұлпа үшін ферменттердің құрамы, концентрациясы мен ара қатынасы және өндеу уақыты бөлек іріктеліп алынады. Бөлініп алынған протопластар ферменттік ерітіндіде мейлінше аз уақыт болуы керек, одан кейін ұқыпты түрде жуылуы қажет.
Протопластарды бөлу кезінде осмостық стабилизатор маңызды қызмет атқарады. Протопластар бүтін болу үшін ферменттік ерітінділер изотониялық немесе гипертониялық күйде болу керек. Кейде материалды алдын ала плазмолиздық ертіндісінде біраз ұстайды. Осмостық зат ретінде көбінесе қанттар (глюкоза, сахароза, сорбит, маннит) пайдаланылады, кейде СаС12, Ма2НРО4, КСІ тұздардын ерітіндісі 0,3-0,8 М концентрацияда қолданылады. Осмостық заттың дәл концентрациясы өсімдіктің нақтылы түріне және онын физиологиялық күйіне байланысты жеке іріктеліп алынады. Көбінесе ферменттер кейін протопластарды өсіруге қолданылатын қоректік ортада ерітіліп дайындалады. Ферменттік ерітіндінің рН көрсеткішін бір деңгейде (5,4-6,2) ұстау үшін буфер қосады.
Протопластарды бөлу кезінде аэрацияның маңызы зор. Сондықтан ортаны араластыратын жабдықтар қолданылады немесе ферменттік ерітінді түбіне ғана құйылған Петри табақшасында бөліп шығарады. Протопластарды ала көленкеде немесе қараңғыда бөліп алады. Ферменттік ерітіндіде инкубация уақыты ферменттердің үйлесуіне, рН және температураға байланысты, 1-2 сағаттан 15-16 сағатқа дейін барады. Әрбір нақтылы ұлпа үшін ең тиімді температурамен өндеу уақытын жеке іріктеп алу қажет. Температура әр деңгейде болады, мысалы бидайға 14°С болса, томатқа ең қолайлысы 27°С.
Протопластар бөлініп алынған сон, олар ұлпаның қалдықтары мен ферменттерден тазалануы керек. Ол үшін оларды центрифугалайды немесе сүзіп алады. Инкубациялық қоспаны тесіктері 50-100 мкм електен сүзеді, одан кейін протопласт суспензиясын центрифугалайды. Центрифугалау тәртібі осмостык затқа байланысты. Егер ферменттік ерітіндісі 0,4-0,5 М сахарозада дайындалса, 100-200 § 2-3 мин бойы центрифугалайды. Протопластар үстіне қалқып шығады, оларды Пастер пипеткасымен сорып алып, екі рет тұздың ерітіндісінде шаяды. Тығыздығы төмен басқа осмостық заттарды (маннит, сорбит) қолданған кезде, протопластар центрифугалау кезінде тұнба болып шөгеді. Оларды екі рет жуады. Одан кейін протопластарды тұздың ерітіндісінде немесе 0,4 М маннит, сорбит, глюкоза ерітіндісіне немесе өсіретін қоректік ортаға салып, суспензиясын алады.
3. Протопластарды нәтижелі бөліп алу көптеген факторларға байланысты. Олар атап айтқанда: ұлпаның шығу тегі (жапырақ, тұқымжарнақ, тамыр, тозаң түйірі, каллус ұлпасы, суспензиядағы клеткалар), өсімдіктің түрі мен сорты, өсімдіктің физиологиялық күйі, ферменттердің құрамы, олардың сапасы, ортаның рН және осмостық заттың түрі.
Протопластардың тіршілікке икемділігін, яғни олардын метаболиттік активтігін анықтайтын арнайы әдіс бар. Ол протопластардын флуоресцеиндиацетатпен (ФДА) боялуы. ФДА - бұл флуоресценциясы жоқ қосылыс, протопластар мембранасы арқылы жеңіл өтеді, тірі протопластардың ішінде эстеразалардың әсерімен ыдырайды. Соның нәтижесінде флуоресцеин босайды, оны протопластардың бүтін мембраналары ұстап қалады. Сондықтан метаболиттік активтігі бар (тіршілікке кабілетті) протопластар ультракүлгін сәулесінде көзге көрінеді, себебі ІІІперінде жинақталған флуоресцеин ультракүлгін сәулесімен коздырылып, жасыл сәулені тарата бастайды.
Протопластар суспензиясының сапасы тіршілікке икемді протопластардың санымен (процент мөлшерінде) белгіленеді. Протопластардың саны Фукс-Розенталь камерасында есептеледі. Протопластардың тығыздығы (суспензиянын 1 мл-дегі саны) суспензияның маңызды сипаттамасы. Егер ұлпаның немесе өсірілген клеткалардың ылғалды массасының 1 граммынан 1005 тен ІхІО'1 дейін тіршілікке икемді протопластар шықса, онда протопластар жақсы бөлініп алынды деп есептеледі.
Жоғарыда айтып кеткендей, протопластардың бөлініп алынатын мөлшері және олардың өміршендігі өсімдіктің түріне, жасына және физиологиялық күйіне, яғни генетикалық және эпигенетикалық ерекшеліктеріне байланысты. Протопластарды көп мөлшерде тұрақты алып отыру үшін өсімдіктерді белгілі бір жағдайда өсіру керек және олардың ең қолайлы өсу кезеңін, нақтылы бір мүшесін анықтап таңдап алу қажет.
Іп vitro өскен клеткалар мен ұлпалардан протопластарды бөліп алудың мынадай өз артықшылықтары бар: стерильдік, іп vitro жағдайында өсуге бейімділік. Бірақ клетка қабықшасының химиялық құрамының күрделі болып өзгеруі және онын калыңдауы ферменттік гидролизді қиындатады. Бүтін протопластардың бөлініп алынуы өсірген клеткалардың ішінде меристемалық клеткаларының сан жағынан үлесіне сай болады, ал ол үшін суспензиядағы клеткаларды жиі-жиі (әрбір 2-3 тоулігіпдс) жаңа коректік ортаға көшіріп отыру керек.
Суспензияда өсірген клеткалардан протопластарды алу үшін ең қолайлы мезгіл, ол клеткалардың өсу кезеңінің логарифмдік фазасының соңында. Осы мезгілде клетка қабықшалары ферменттердің әсерімен оңай ыдырап, өміршең протопластарды береді. Протопластардың тіршілікке икемділігі оларды бөліп алу жағдайлары мен тәсілдеріне байланысты. Клетканың плазмолиз кезінде сусыздандырылуы және қабығының бұзылуы оны шок күйіне (күйзеліске) душар етеді. Бұл жағдайда цитоплазманың вакуольденуі артады, көптеген липид тамшылары пайда болады, полисомалардың саны азаяды, ядро мен хлоропластар коюланады.
Фермент препаратының сапасы протопластардың бөліп алынған санына, мөлшеріне ғана емес, олардың кейбір қасиеттеріне де әсер етеді. Пектиндер мен целлюлозаларды гидролиздейтін саудалық фермент препараттарына қоспа ретінде протеазалар, липазалар, нуклеазалар және басқа ферменттер, фенолдық қосылыстар, тұздар кіреді. Олар плазмалемманың қасиеттерін өзгертуі мүмкін. Осы токсикалық заттардан құтылу үшін және протопластардың шығуын арттыру үшін ферменттерді тазалауға болады. Бірақ айта кететін мәселе, өте жақсы тазартылған ферменттер протопластарды көп мөлшерде алуға тиімсіз келеді. Кейде ферменттер ерітіндісіне қорғаушы заттар (протекторлар) қосылады, мысалы декстранның немесе калий сульфатының 0,5 % ерітінділері. Олар протеиндермен әрекеттесіп, ферменттердін зиянды әсерін төмендетеді.
Инкубациялық ортада иондардың әсіресе кальций мен магнийдің болуы, плазмалемманың тұрақтылығын арттырып, оқшауланған протопластардың сапасын жақсартады. Оқшауланған протопластар механикалық және осмостық стреске өте сезімтал болады. Олар тек ішіне сіңіп кіре алмайтын осмостық заттың гипертониялық ерітіндісінде өздерінің осмостық тұрақтылығын сақтай алады.
Ферменттік ерітіндісінен жуылып тазартылып алынған тіршілікке икемді протопластар шок күйінен шығып, біртіндеп өзінің ішкі жүйесіндегі бұзылған құрылымдарын жөніне келтіріп (репарация), қабығын қайта құруға (регенерация) дайындалады. Толық жарамды изотониялық қоректік ортада (протопласт пен ортаның осмостық қысымы тепе-тең) асептикалық жағдайда протопластар ұзак мезгіл тіршілікке икемді болып, бөлінуге қабілетін сақтайды.
4. Протопластарды іп vitro түрлі тәсілдермен өсіруге болады. Өсіру тәсілі тәжірибенің мақсатына байланысты. Алдымен протопластарды қоректік ортада шайқап жуып ферменттерден тазартады. Сонан соң олардың 1 мл ортадағы санын есептеп алады. Жасайтын тәжірибеге сәйкес олардың тығыздығын керек көрсеткішке жеткізеді. Ол үшін протопластарды әр түрлі көлемі бар ортаға салады. Мысалы, протопластардың тығыздығын асыру үшін оларды аз көлемді ортаға салады. Ал, керісінше, протопластардың тығыздығын азайту үшін оларды қоректік орта мол құйылған ыдысқа көшіреді. Сөйтіп, протопластардың 1 мл ортадағы санын оқтын-оқтын есептеу арқылы олардың тығыздығын істейтін тәжірибеге сайма-сай келтіреді.
Протопластарды сұйық ортада өсіргенде жасушаларды өсірген сияқты олардың тығыздығы жоғары болуы керек. Көбінесе бұл көрсеткіш Імл Ю4 - 105 клетка болады. Егер қоректік орта сұйықталып, протопластар саны бұдан аз болса, онда олар жөнді өсе алмайды. Өте сұйық суспензияда протопластардың ішіндегі тіршілікке қажетті кейбір метаболиттер плазмалемма арқылы ортаға шығып кететін көрінеді. Сондықтан протопластардың тіршіліктік қабілеті едәуір кемиді. Осының дәлелі ретінде мынадай мысал келтіруге болады. Әдетте ісік ұлпалардан алынған клеткаларды суспензияда өсіргенде коректік ортаға ауксин мен цитокинин гормондарын қоспайды. Өйткені бұл гормондар осындай ісік клеткаларының өздерінде түзіледі. Сұйық ортада өсіргенде клетка кабығы ол гормондардың клетканың ішінен сыртына шығуын бөгейді де, ондай эндогендік метаболиттерді клетканың өзі пайдалана алады. Ал ісік клеткалардан бөліп алынған протопластарды суспензияда өсіру үшін қоректік ортаға міндетті түрде экзогендік ауксин мен цитокининді қосу керек. Себебі, жоғарыда айтылғандай, олардың өз эндогендік гормондары клетканың қабығы болмағандықтан плазмалеммадан шығып кетеді.
Протопластардьщ өсуіне жаксы жағдай жасау үшін «қоректік кабат» әдісін пайдаланады немесе байытылған ортаны колданады, болмаса олар өсіп жаткан ортаньщ көлемін минимумға дейін азайтады. «Астыңғы қоректік қабат» ретінде рентген немесе гамма-сәулелері әсер еткен протопластар мен клеткалар пайдаланылады. Сол әсерден ондай клеткалар бөліну қабілетінен айырылады, бірақ басқа клеткалардың өсуіне жағдай туғызады. Осы әдістің тағы бір түрі, ол нашар өсетін протопластарды жақсы өсетін протопластармен бірге өсіру. Байытылған орталар өсімдіктердің шамалы түрлері үшін ғана оң әсерін тигізеді.
Протопластарды өсірудін кең таралған әдісі, оларды жоғары ылғалдылықта көлемі 20-40 мкл тамшыларда өсіру. Петри табақшасының қақпағында немесе түбіндегі кішкене тамшыларға протопластар автоматтық пипеткамен салынады. Протопластарды өсіру үшін бұл әдістің тиімділігі - материалдар мен уақытты үнемдеп, қоректік ортаның мыңдаған варианттарын тексеруге мүмкіншілік береді. Бірақ бұл әдістін де кемшілігі бар, ол протопластардың тамшының ортасына жайылуы.
1978 жылы украин ғалымы Ю.Ю. Глеба жеке протопластарды қоректік ортаның көлемі 1 мкл дейін микротамшыларда өсіру әдісін жете зерттеп дайындады және өзінің зерттеу жұмысында осы әдісті нәтижелі қолданды. Осындай көлемдегі микротамшыда бір клетка болса, онда клетка көлемі мен қоректік орта көлемінің ара қатынасы әдеттегі өсіргендей тығыздығы 1 миллилитрде 103 клеткасы бар суспензиямен бірдей болады. Протопластарды алдын ала 1-3 күн тығыздығы жоғары (104-105 клетка) суспензияда өсірсе, кейін сондай суспензиядан алынған жеке протопластарды микротамшыда өсірудің тиімділігі арта түседі.
Протопластарды суспензия ретінде сұйық ортада ғана емес, біраз қоюланған ортада да өсіруге болады. Ол үшін ыдысқа құйылған қоюланған ортаның бетіне жұқа қабат етіп қана протопластарды салады. Бұл әдіс бойынша, сұйық ортамен көлемі тең қоюланған ортада протопластардың концентрациясын екі есе көп етіп өсіруге болады,
Протопластарды агары бар қатты ортада да өсіруге болады. Ол үшін протопластар суспензиясын 1,2 % агары бар жылы (45°С) көлемі бірдей ортамен араластырады. Орта суып қаткан соң оның ішіндегі протопластар бір-бірінен алыстау болып бекітіліп орналасып қалады. Осы агарда орнықтыру әдісі протопластардың әрқайсысының өсуін жеке бақылап отыруға мүмкіндік береді. Агар орнына агароза қолданылса, клеткалардың бөлінуін арттыруға болады екен. Агароза агардың құрамына кіреді, шамасы агар екі полисахаридтің - агароза мен агаропектин - қоспасы. Бұл тәсіл, әсіресе өсу қарқыны бәсең немесе өспей қалған протопластарға қолайлы.
Жасуша қабығы қайта пайда болып, жасушаның алғашқы бөлінуі үшін қоректік заттар орташа мөлшерде қажет болады. Ортаның концентрациясы жоғары болса, протопластардың күй-жағдайы тіпті нашарлауы мумкін. Ал екі-үш рет бөлінгеннен сон жасушалар қоректік заттардың жетіспеушілігінің зардабын шеге бастайды. Егер осы кезде орта байытылмаса, бөлінуі тежеліп, клеткалар тіпті кұрып кетуі де мүмкін. Өсіру кезінде қоректік ортаны байытудың екі жолы бар: жоғары концентрациялы қойылтылған ортаны тамшылап қосып отыру және қатты қоректік қабатты қолдану.
Бірінші жолдын кемшілігі, концентрациясы жоғары ортаны қосқан сайын инфекциялану қауіпі туады. Ал екінші жолы одан тәуірірек, себебі құрамы бай қоректік орта ыдысқа алдын ала қүйылады. Ол қатқан сон үстіне протопластар салынады. Сөйтіп алғашқы күндері протопластар қоректік заттар азырақ ортада өседі, ал кейінірек қаркынды бөлініп келе жаткан жасушаларға астыңғы қатты қабаттан диффузия арқылы қажетті заттар келіп жатады.
Протопластарды да клеткалар мен ұлпаларды өсіретін белгілі қоректік орталарда өсіреді. Протопластарды өсіретін қоректік ортаның негізгі айырмашылығы - кальцийдің концентрациясы 2-4 есе артық және 0,4-0,8 М осмостық заттардың қосылуы. Протопластарды өсіру үшін кеңінен қолданылатын қоректік орталар: өзгертілген Мурасиге-Скуг ортасы (көбінесе ол Нагата және Такебе ортасы деп аталады); Гамборгтың В5 ортасы және Као мен Михайлюктін ортасы (бұл витаминдермен, амин қышкылдарымен және қанттармен, кейде фитогормондардың күрделі құрамымен байытылған Гамборгтын В5 ортасы). Бұнда қанттар (ксилоза, рибоза, целлобиоза, манноза, рамноза) осмотик ретінде ғана емес, клетка қабығынын тез пайда болуына да әсер етеді.
Өсімдіктердің әр түрлерінен бөлініп алынған протопластардың өсуіне қолайлы көптеген қоректік орталар жете зерттеліп ұсынылды. Қоректік орталарды іріктеп алу көбінесе тәжірибеге негізделген. Оның ең лайықты құрамы өсімдіктің түрі тұрмақ, тіпті жеке сорт үшін де таңдалады. Нақтылы әрбір өсімдіктен алынған протопластардың қоректік ортаға реакциясын зерттеу үшін оларды «аспа тамшылар» әдісімен өсіріп, бірнеше факторлары белгілі схема бойынша әр түрлі комбинацияда құралған қоректік орталарында өсіреді. Мысалы, қоректік ортаның екі факторының үш концентрациясының әсерін зерттеу үшін 9 ортаның 9 варианты дайындалады (яғни 9 тамшы), олар диаметрі 5 см Петри табакшасында үш-үштен тор ретінде орналасады. Бұл тәжірибеде ең азы 5 табақша қолданылатын болғандықтан, қосымша факторлардың, мысалы жарық пен температураның әсерінде зерттеуге әбден болады. Протопластарды осіргендегі температура өсімдіктің түріне байланысты 15°С-тан 30°С-қа дейін болады. Әдетте протопластар температураға өте сезімтал. Жарықтың қарқыны 0-ден 2000 люкске дейін болады.
5. Ең бірінші болып 1971 жылы Такебе протопластарды нәтижелі өсіріп, олардан өсімдіктерді шығаруға болатындығын дәлелдеді. Лайықты жағдайда протопластар жасуша қабығын қайта түзіп, кәдімгі нағыз жасушаға айналады. Электрондық микроскоп көрсеткендей, өсімдік протопластарының сыртқы қабатында 10-20 минут өткен сон бірінші целлюлозаның микрофибрильлері пайда болады, ал 20 сағаттан кейін олар қабықтың тығыз торын түзеді. Жасуша қабығының плазмалеммамен байланысының бұзылуы, шамасы, бірден қабықты қайта құру механизмін іске қосады. Ең қызығы, қабығынан айырылмаған плазмолизге ұшыраған протопластың үстінде жаңа қабықтың түзілгені. Қабықтың түзілуінің ерекшеліктері және жылдамдығы бастапқы клетканың түріне және дифференцировкасына байланысты.
Алқа, крестгүлділер, шатыршагүлділер тұқымдастар өсімдіктерінің протопластары жасуша қабығын 24 сағат ішінде түзеді. 24-36 сағаттан кейін клеткалар бірінші рет бөлінеді, ал 3-4 апта өткен сон каллус жасушаларының колониясы түзіледі. Өсіру кезінде біртіндеп (2 аптадан кейін) ортаның осмостық қысымын төмендетеді, соның нәтижесіңде бөліну жылдамдығы өседі. Содан кейін каллустарды регенерация өту үшін қатты ортаға көшіреді. Каллуста морфогенездің (органогенез) басталуы, яғни өркен мен тамырлар түзілуі регенерант өсімдіктер пайда болуына әкеледі.
Талай өсімдіктердін протопластары сомалық эмбриогенез арқылы да регенерант өсімдіктер түзеді. Оқшауланған протопластардан пайда болған жасушалардың бөлінуге және тотипотенттілігін жүзеге асыруға қабілеттері көптеген факторларға тәуелді:
1) бастапқы ұлпаның түр ерекшелігі, физиологиялық күйі және дифференцировкасы, яғни генетикалық және эпигенетикалық сипаттамасы;
2) протопластарды бөліп алу әдістері мен жағдайлары;
3) протопластарды суспензияда өсіргендегі тығыздығы;
4) қоректік ортаның құрамы;
5) протопластарды өсіру жағдайлары.
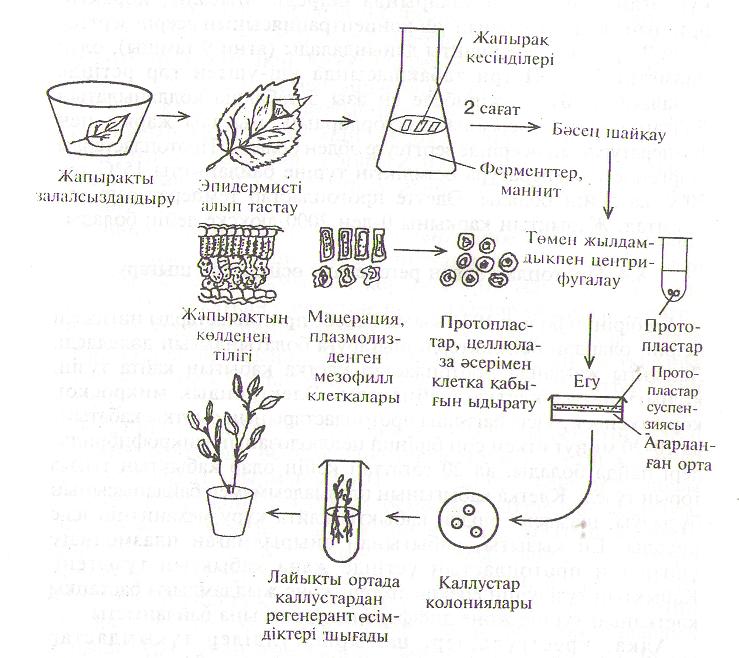
Сурет. Картоптың протопластарын бөліл алу, өсіру және регенерацияны өткізу схемасы.
Көптеген ауыл шаруашылығына маңызы зор өсімдіктердің жақсы өсетін, ақырында регенерант өсімдік беретін протопластары алынған. Бірақ олардың жасушаларының бөлінуін және дифференциялануын реттейтін факторлар туралы мәліметтер әлі жеткіліксіз. Алқа тұқымдастарына жататын темекінің, шырайгүлдің, картоптың, томаттың протопластарынан регенерант өсімдіктер алу оп-онай, ал астық тұқымдастары мен бұршақ тұқымдастары үшін көпке дейін бұл өте қиын мәселе болып келді.
Швед ғалымы Т. Эриксонның пікірінше, мүмкін темекі мен оның тұқымдас түрлері ерекше стрестерге төзімді болғандықтан, олармен онды нәтижеге жетуге болады. Алайда, соңғы жылдардың көптеген жұмыстардың нәтижелерін қорыта келе, ол мынадай ойға келеді. Өсімдік клеткасының биологиясы жөнінде білімнің жетіспеушілігінің салдарынан ғана бұл жұмыстар сәтсіз болып жатыр, ал ғалымдардың күшін біріктіріп болашақта осы мәселені шешуге үміт бар.
И. Васил бидайдан және африка тарысынан бөлініп алынған протопластардан сұйық ортада ұрықтар мен өскіндерді ала алды. Жапон ғалымдары бидайдың, жүгерінің, күріштің протопластарын алды және де күріш пен тарының протопластарын қосып, сомалық буданды шығарды.
Сол сияқты, М. Айткожин атындағы Молекулалык биология мен биохимия институтының ғалымдарының жұмысы үлкен жетістік болып есептеледі. Ж.Жәрдемалиев, М. Карабаев және М. Мұхаметкалиев ұзақ және жігерлі жұмыстың нәтижесінде бидай мен жүгерінің жақсы өсіп, бөлінуте қабілеті бар, кейіннен регенерант өсімдік бере алатын протопластарын алу әдісін жете зерттеп дайындады. Бұл әдіс протопластардан өсімдіктерді алуға (25%-ке дейін) мүмкіндік береді. Протопластар эмбриогендік суспензиялық жасушаларынан бөлініп алынады. Басқа ғалымдар да астық тұқымдастарымен айналысқанда, суспензиядағы эмбриоидогенезге қабілетті клеткалармен жұмыс істеп, жақсы нәтижеге жеткен. Бұл жағдай жасушалардың белгілі морфогенезге детерминациялануының регенерация үшін маңызды екенін, яғни генетикалық күйдің ролін көрсетеді.
6. Өсімдіктердін клеткалык инженериясы деген термин кең мағыналы түсінікті қамтиды. Мұның бір мәні - протопластардың бір-бірімен құйылысып қосылуы негізінде жасалатын биотехнологиялық тәсілдер жүйесі. Протопластар құйылысқанда алдымен олар бір-біріне тоғысып жабысады, оны агглютинация деп атайды. Содан кейін олардың мембраналары да қосылып, екі протопластан үлкен бір протопласт пайда болады. Протопластардың құйылысу механизмі түсініксіз, әсіресе мембраналардың құйылысуы. Протопластардың өзінен-өзі құйылысуы өте сирек құбылыс, ол екі протопласт арасында плазмодесмалардың кездейсоқ қалуынан бола алады.
Протопластардың сыртында теріс электр заряды болады, сондықтан олар суспензияда бір-бірінен оқшауланады. Құйылысу үшін оларды алдымен бір-бірімен жанастыру керек, сондықтан плазмалемма зарядын өзгерту қажет. Протопластардың құйылысуы үшін химиялық және электрлік әдістері пайдаланылады.
Химиялық әдіс протопластардың құйылысуына жағдай жасайтын, плазмалемманың электрлік зарядын өзгертетін заттарды суспензияға қосуға негізделген. Э. Кокинг томат тамырының меристемасынан алынған протопластарды қосу үшін нитраттарды (көбінесе НаМО3) пайдаланған. Бірақ қосылған протопластар аз болған және олар жиі зақымданған. Протопластың сыртында теріс зарядты жою үшін сілтілі ортада (рН=10,5) 50мн СаС12 колданылған. Мезофилдің протопластарын қосу үшін бұл жағдай қолайлы болған, ал каллустық протопластарға жарамаған. Бұдан басқа, протопластарды бір-бірімен жақындату үшін 60 айналым жылдамдықпен 2-3 мин центрифугалаған. Протопластарды жақындатып, тоғыстырудың тағы бір жолы -протопластар суспензиясын капилляр арқылы өткізу.
Осындай көп ізденістің арқасында тиімді фюзоген (протопластардын құйылысуына жағдай жасайтын зат) табылды, бұл полиэтиленгликоль болды. ПЭГ - суда жақсы еритін полимер, суспензияның осмостық қысымын көтереді. Қосылатын протопластардың суспензиясын алдымен ПЭГ-тың қоюланған (20-30 %) ерітіндісімен өңдегенде протопластар бір-біріне жабысады. 10-15 минуттан кейін Са2+ жоғары мөлшерде (100-300 мМ) бар сілтілі (рН 9-11) ерітіндімен ПЭГ-ты суспензиядан шайып шығарады. Сонан соң протопластарды бір-бірімен жабыстырып тұрған мембраналар құйылыса бастайды. Осындай «ПЭГ - сілтілі рН - мөлшері жоғары Са2+» әдістемесі қазір дүние жүзінде көптеген лабораторияларда қолданылады.
Осы әдістемемен 10 %-тен астам (тіпті 50%-ке дейін) протопластарды қосуға болады. ПЭГ-тың әсерімен протопластардың құйылысу механизмдерін түсіндіретін әр түрлі көзқарастар бар.
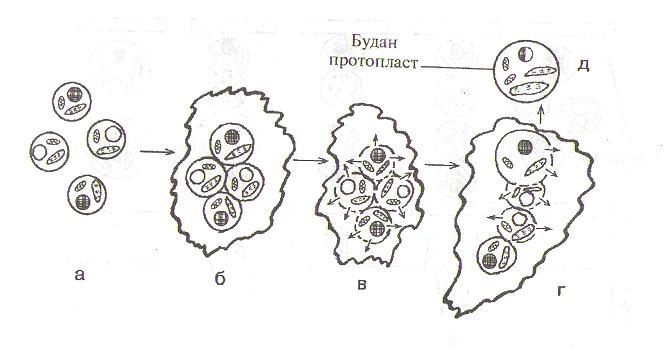
Сурет. Протопластардың ПЭГ-тін әсері мен құйылысуының кезеңдері.
ПЭГ қосылғанда протопластар дегидратация арқасыңда бір-біріне жабысады (б). Суспензиядағы суды ПЭГ өзіне сініреді, сондықтан қос қабатты мембраналардың үстіңгісі зақымданып, астыңғы жалаң қабаты басқа мембранамен оңай құйылысады ( в). Мүмкін ПЭГ су ортасының полярлығын төмендетеді,соның нәтижесінде мембрананың полярлық және гидрофобтық компоненттері қайта бөлініп, липидтік құрылымдары тұрақталады. ПЭГ-тің әсерімен мембрана көп жерден тесіледі. Протопластар бір-бірімен жабысқан кезде, сол тесіктер арқылы олардың ішіндегі заттар ары-бері өтеді. Протопластар қосылғаннан кейін де, ең бастапқы кезеңде мембраналардағы тесіктер бітелмейді. Протопластар әбден толығымен қосылған сон ғана олардын мембраналары құйылысып жалпы ортақ бір толық плазмалемма будан протопласты қоршайды. Ақырында протопластар дөнгеленіп будан протопласт пайда болады (г).
Бұл әдістін өз кемшіліктері бар, ПЭГ-мен өңдеу нәтижесінде протопластардың көбі зақымданып құриды. Егер екеу емес, одан да көп протопластар қосылса, олар тіршілікке икемсіз келеді.
Электрлік құйылысу әдісі биік (20 % және жоғары) жиілігімен өзіне назар аударады. Бұл әдістің негізінде электр өрісі пайдаланады. Протопластар суспензиясы екі электродтың арасында орналасады (а).

40-сурет. Электр өріс әсерімен протопластардың құйылысуының кезеңдері
Айнымалы ток диэлектрофорезді қоздырады, протопластар бір-біріне тақалып бір қатарға тізіледі (б). Бұл тізбектер тек электр өрісі болған кезде туады. Оларға қосымша жеке қатты электр импульсін (600 В/см, 10-20 мкс) бергенде, қатты қысылып тұрған плазмалық мембраналарда тесіктер пайда болады да (в), протопластар бір-біріне құйылып кетеді. Басылып бара жатқан айнымалы электр сигналы цитоплазмалар араласып жатқанда, протопластарды біріктіріп ұстап түрады (г). Электр тогын өшірген соң қосылған протопластар дөнгелектенеді (40). Электр өрісінің әсерінен протопластар бөлме температурасында және рН-тың физиологиялық мөлшерінде нәтижелі косылады. Қысқа қатты импульс мембранаға қысым жасап, протопласт плазмалеммалары қосылып тұрған жерде диэлектрлік бұзылуға себеп болады. Өзгеріліп тұрған электр өрісі мембрана белоктарының латеральдік диффузиясына апарады, соның арқасында белоктары жоқ мембрананың учаскелері пайда болады. Сондай кезде қарама-қарсы тұрған протопластар мембраналары әрекеттесуі мүмкін. Мұнда липид молекулаларымен алмасу, липид көпірлері пайда болуы мүмкін, ақырында мембраналар құйылысады. Электр өрісі көмегімен әр түрлі ұлпалардың және өсімдіктер түрлерінің протопластары қосылады.
X. Борнман әріптестерімен бірге рапс протопластарында химиялық және электрлік әдістерінің салыстырмалы зерттеуін өткізді. Алынған нәтижелері бойынша мынадай қорытындыға келді. Қосу жолының екеуі де мембраналардың гидрофобтық бөлігінін бірдей өзгерістеріне және компоненттерінің бірдей тұрақсыздануына әкеліп соғады. Бірақ ПЭГ-мен өңделген протопластардың өткізгіштігі артық болған. Себебі ПЭГ дегидратациялау әсері арқылы протопластардың барлық бетінде кездейсоқ тесіктерді пайда болғызады. Бірақ кейбір тесіктері тым үлкен болғандықтан мембраналар тез өз қалпына түсе алмайды. Электр әдісі қымбат жабдықты талап етеді, сондықтан ғалымдардың көбі химиялық әдісті қолданады.
Протопластардың қосылуы - бұл кездейсоқ құбылыс, оған көптеген факторлар әсер етеді. Құйылысу жиілігі өсімдіктін түріне емес, клетканың ультра құрылымына байланысты. Мысалы, меристемалық және каллустық протопластар оңай құйылысады, ал вакуолі үлкен және хлоропластары дамыған протопластардың қосылуы қиын. Алайда, түр ерекшелігін есепке алмауға болмайды. Мысалы, сәбіз, картоп, арабидопсис протопластары темекіге қарағанда жақсы құйылысады. Даражарнақты өсімдіктердің протопластары қосжарнақтылармен салыстырғанда оңай құйылысады.
Инженерия деген термин құрастыру деген мағынаны білдіреді. Жасушалық инженерия әдістеріне протопластарды қосып будандастырудан басқа, клеткалардың жеке бөліктерінен оларды қайта құрастыру да (реконструкция) жатады. Жасушаларға оқшауланған басқа клеткалық органеллаларды (ядро, хлоропластар, митохондриялар) енгізу арқылы генетикалық жүйені қайта құру мүмкіндігі ғалымдардың назарын аударады. Себебі осы әдіспен цитоплазмалық геномда жазылған қасиеттерді бір клеткадан басқа жасушаға ендіріп, құнды өсімдік формаларын шығаруға болады. Мысалы, жоғары активті хлоропластарды енгізуі фотосинтездің қарқындылығын арттырып, өсімдіктің өнімділігін көтереді. Гербицидтерге шыдамдылықты, кейбір ауруларға иммунитетті және токсиндерге реакцияның белгілері хлоропластық ДНК-да жазылады. Ал митохондриялық ДНК-да цитоплазмалық аталық стерильдік белгісі жазылады. Протопластарға сондай белгісі бар митохондрияларды енгізу арқылы өсімдікке осы бағалы қасиетті тән етуге болады.
Клеткаларға іn vitro жағдайында органоидтерді тасымалдау - назар аударатын тәсіл, бірақ, өкінішке орай, оның әдістемелік жағы жақсы зерттелмеген. Әдетте ғалымдар протопластарды органоидтар суспензиясымен араластырып, мембраналарға әсер ететін заттарды қосып, центрифугалайды. Бірақ протопластарға органоидтардың бірлі-жарымы ғана енеді.
Дәріс №24
Сомалық будандастырудың генетикалық негіздері
ЖОСПАР:
1. Сомалық будандастырудың негіздері
2. Сомалық будандастырудың генетикалық негіздері
3. Жат текті түрлерді сомалық будандастыру
4. Сомалық будандарды сұрыптап алу әдістері
5. Будан өсімдіктерді талдау әдістері
6. Сомалық будандарды практикада пайдалану
1. Бірінші рет будан клеткалары 1960-шы жылдары клеткаларды іп үііто өсіру әдісі жетілдірілгенде жануар клеткаларынан алынған. Өсімдіктерде бұл мүмкіншілік кешірек, протопластарды бөліп алу және оларды қосу әдістері жете зерттелгенде жүзеге асты.
Жануар сомалық клеткаларын будандастыру әдісі биология мен медицинаның теориялық мәселелерін шешуге пайдаланылады. Будан клеткалар биотехнологияда кеңінен колданылады, мысалы, гибридомаларды пайдаланып моноклондық антиденелерді алу үшін. Гибридома деген ол антидене түзетін клетканың (В-лимфоциттін) ісік клеткамен қосылған будан клеткасы. «Ома» деген жұрнақ, ісік клеткасы ұғымды білдіреді, яғни гибридома ісік клеткасымен басқа клетканы будандастыру арқылы алынған будан клетка. Неліктен гибридома жасау үшін ісік клеткалары қолданылады? Себебі ісік клеткалары тез және үздіксіз бөлінеді. Пайдалы зат түзетін басқа клеткаларды (мысалы лимфоциттер) ісік клеткасымен будандастырғанда алынған гибридомаларды биотехнологиялық әдістермен ферментерларда өсіріп, қажетті пайдалы заттарды мол өндіруге болады. Ісік клеткаларының құрамына енгізілген лимфоциттер организмнен тыс шексіз уақыт өсіп, антиденелерді түзеп, оларды қоректік ортаға мол мөлшерде шығарып жатады. Кейін осы антиденелерді бөліп алып, тазалап, медицинада пайдаланады.
Өсімдіктердің сомалық клеткаларының протопластары құйылысып, будан клетка құрылады, ал одан тотипотенттік қасиетке сүйене регенерация арқылы будан организм шығады. Сондыктан бұл әдіс будан өсімдіктің құрамында нендей қасиеттердің пайда болатынын білу үшін генетикалық талдау жасауға ыңғайлы. Сомалық клеткаларын будандастыру арқылы өсімдіктерді генетика жағынан жақсартуға болады.
Көне заманнан бастап мәдени өсімдіктердің селекциясы жыныстық будандастыруға және соның нәтижесінде шыққан алуан генотиптерді сұрыптап, олардың арасынан ең құндыларын таңдап алуға негізделген. Бірақ жыныстық будандастыру гснетикалық жағынан өте қатаң шектелген будандастыру жүйесі. Бұнда ата-аналық формалары ретінде тек биологаялық бір түрге жататын белгілі организмдер белгілі бір тіркесте пайдаланылады. Жыныстық будандастырудың нәтижесінде белгілі гендер жиынтығы бар ұрпақ пайда болады. Жыныстық жолмен мәдени өсімдікке жабайы түрдің бағалы жеке бір ғана белгісін беру мүмкін емес. Жыныстық процесс симметриялық (аталықпен аналықтан ұрпаққа несие боп берілетін хромосомалар саны тепе-тең) болғандықтан, көздеген мақсат бойынша берілетін пайдалы қасиетпен қатарласып, көптеген тіпті зиянды белгілері де косымша беріледі. Аталық пен аналықтың екеуінің де гаметалары қосылғанда зиготаға өздерінің ядролық генетикалық материалдың гаплоидтық жиынтығын бір мөлшерде қосады. Жабайы түрдің көптеген жарамсыз гендерінен аластау үшін алынған буданды дүркін-дүркін бастапқы мәдени өсімдік формасымен қайтара будандастыра беру қажет. Бұл жұмысқа көп жылдар кетеді, гендері біркелкі таза линия алып, одан сортты шығару үшін он реттен артық қайталап будандастыру өткізу керек.
Жыныстық процесінде хлоропластар мен митохондриялардағы генетикалық информация, яғни ядродан тыс информация аналық жағынан тұқым қуалайды. Жыныстық будандастыру өсімдіктердің физиологиялық жақын түрлерімен ғана шектеледі. Болашақта селекцияның тиімділігін генетикалық базисті үдейі кеңейту жолымен ғана қамтамасыз етуге болады. Екпе өсімдіктердің генетикалық базисын (әр алуандығын) кеңейту жолы, ол түр аралық және туыс аралық будандарды алу. Бірақ ондай таксономиялық алшақтық жыныстық жолмен будандастыруды шектейді. Дегенмен, жабайы өсімдіктердің пайдалы гендерін екпе өсімдіктерге ендіруге түраралық, туысаралық будандастырудың маңызы өте-мөте зор. Сондықтан селекционерлер осындай будандарды алу үшін көп еңбек сіңіреді. Өкінішке орай, жоғарыда айтылғандай, бұл кезде жыныстық жолмен будандастыру көбінесе сәтсіз болады.
Сомалық будандастыру - будандастырудың жаңа әдісі. Оның арқасында будандастыру жыныстық процесс арқылы емес, тіпті басқа жолмен - сомалық клеткалардың құйылысуы арқылы өтеді. Бұндай сомалық будандастыруды таксономиялық алшақтық шектемейді. Түраралық қана емес, туысаралық, тіпті одан да алшақ систематикалық топтарға жататын өсімдіктерді будандастыруға болады.
Сомалық будандастырудың артықшылықтары мынада:
1) әдеттегі жыныстық жолымен будандаспайтын фитогенезде түпкі тектері алыс жатқан өсімдік түрлерін будандастыру;
2) асимметриялық будандарды алу, оларда аналық немесе аталық әйтеуір екі біреуінің гендер жиынтығы толығымен болса, екіншісінің бірнеше хромосомалары (немесе гендері, немесе органоидтары мен цитоплазмасы) болады; 3) үшеу және одан да көп ата-аналық клеткалардың құйылысуы; 4) ата-аналық идиотиптері толығымен болатын будандарды алу; 5) ядродан тыс цитоплазмалык гендері бойынша гомозигогішірлм лну; Г>) ге-неративтік жүйелерінің сыйымсыздығын жеңу; 7) морфоіенеіде гаметогенездегі аномалиялар салдарынан жыныстық процесс өте алмайтын өсімдіктердің будандарын алу; 8) эпигенетикалық, программалары әр түрлі клеткалардың будандарІ.ІІІ ІІлу (Ю.Ю. Глеба, К.М.Сытник, 1982). Сонымен, сомалық Ік-мічч! парасексуальдык будандастыру ядролық және цитоил:гшіілык гендерді тасымалдайтын бірегей әдіс. Оның көмегімен өсімдіктердің жыныстық сыйымсыздық мәселесін шешуге болады.
Екі протопласт қосылғанда, егер олардың ядролары қосылса, нағыз будан клетка (ядролық будан) пайда болады. Ядролары қосылмаған будан клетка гетерокарион деп аталады. Гетерокарионды ата-аналық біреуінің немесе екеуінің субпротопластарын будандастыру үшін пайдалануға болады. Субпротопласт - протопластың бөлігі, цитоплазмалық мембранамен қоршалған құрамында кейбір органоидтары бар; ядросы болса - ол нуклеопласт, ядросы жоқ болса - цитопласт, ядро мен цитоплазманың бөлігі болса - минипротопласт. Хлоропластар мен митохондрияларды бір клеткадан екіншісіне көшіру үшін цитопластарды пайдалануға болады. Ата-ананың біреуінің ядросы бар және цитоплазмалық гендері екеуінен немесе біреуінен болса, онда цитоплазмалық будан (цибрид) деп аталады. Ата-аналық біреуінен цитоплазмалық гендері иеленген будандарды цитоплазмалық гетерозиготалық будан (цитогет) деп атайды. Клеткада цитоплазмалық гендер хлоропластар мен митохондрияларда болғандықтан және кейбір ядролық және цитоплазмалық гендері жойылу (сегрегация) арқасында, сомалық будандастыру нәтижесінде будандардың 27 түріне дейін алуға болады. 41-суретте солардың кейбіреулерін алуының жолдары көрсетілген.
Оқшауланған протопластар қоршаған ортадан макромолекулалар мен клетканың құрамындағы кішігірім бөлшектерді өздеріне сіңіре алады. Шамасы, бұл табиғи эндоцитоз құбылысы немесе олар плазмалемманъщ үзілген жерінен өтеді, жаңадан бөлініп алынған протопластарда мембрананың бұзылған жерлері болып жатады.
Будан клеткаларды өсірсе одан каллус шығады, ал каллуста морфогенез процестері өтсе будан регенерант өсімдігі шығады. Осы жолмен 1972 жылы П. Карлсон әріптестерімен жоғары сатыдағы өсімдіктің бірінші буданын алды, ол темекінің №соІіапа ёіаиса мен N. Іащізсіогйі түраралық буданы еді. Шыққан регенерант өсіп, дамып, гүлдеген кәдімгі өсімдікке айналды. Бұл өсімдіктердің морфологиясы, хромосомалар саны, жыныстық жолмен алынған амфидиплоидтармен (ата-ананың әрқайсысынан хромосо-малардың бір диплоидтық жиынтығы қосылған) бірдей болды.
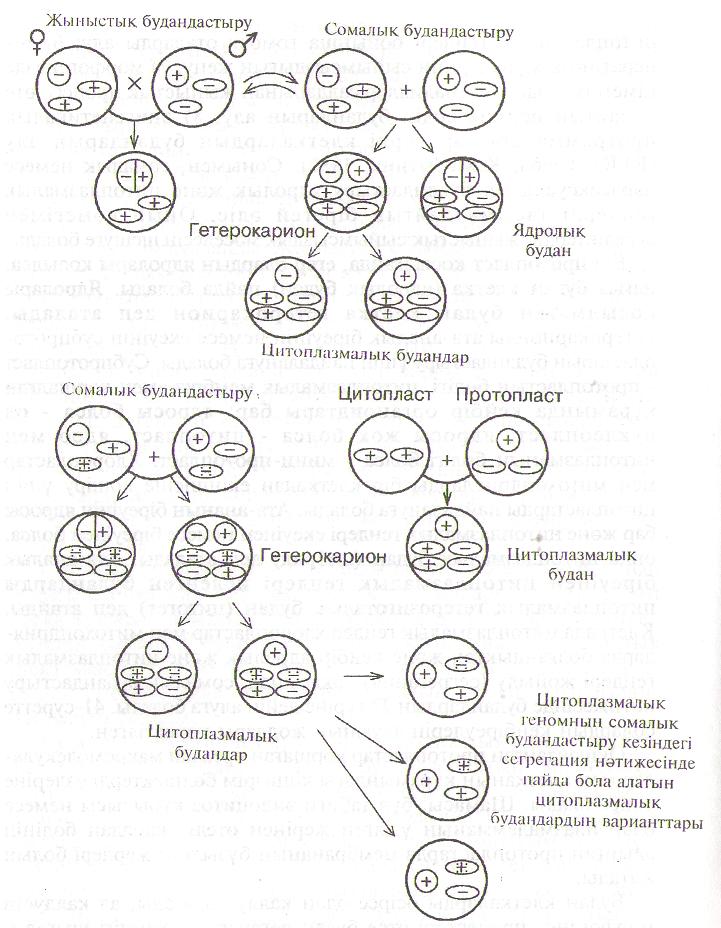
41-сурет Сомалық будандастыру барысында ядролық (дөңгелек) және цитоплазалық (сопақ) белгілерінің тұқым қуалаушылық көрсететін схема.
1974 жылы Г. Мельхерс пен Г. Лабиб темекінің екі сортының гаплоидтық протопластарын құйып қосты. Бұл сорттардың хлоропластарының жарыққа сезімталдық кемістігі бар еді. Будан клеткадан өсіп шыққан будан өсімдіктің хлоропластарыңда ондай ақау болмады, осындай хлоропластар жыныстық жолымен алынған буданда да болды (42-сурет).
1976 жылы Д. Пауэр қызметтестерімен РеШпіа һуЬгісІа мен Р. рагосііі түраралық будан алды, Д. Дудил 1977 жылы сәбіздін Оаіісиз сагоіа мен О. саріШҒоІіиз түраралық сомалық буданын алды. Бұл ғалымдар сомалық будандардың нағыз будан екендігін дәлелдеді және олардың жыныстық будандарымен фенотипі бірдей екендігін көрсетті.
Сөйтіп, протопластарды бөліп алу, өсіру, оларды қосу және оларға жеке клеткалық органоидтарды енгізу, генетиктер мен селекционерлерге алынған будан өсімдіктердің әр алуандығын кеңейтуге мүмкіндік береді.
2. Сомалық будандастыру әдісі табиғи емес, толығымен жасанды болғандықтан, өзіне ғалымдардың назарын аударып, гендердің бірегей тіркестерін алуға үміттендіреді, жыныстық жолмен будандаспайтын өсімдіктерден гендерінің жаңа жиынтығы бар сомалық будандар алуға жол ашады.
Сомалық будандастыру өте күрделі, нәтижесін алдын ала болжауға болмайтын және тікелей басқаруға көнбейтін процесс. Сомалық будандардың генотипі генетикалық өзгерістерге жеткізетін бірқатар уақиғалардың нәтижесі. Екі протопласт құйылысқан кезде, бір-біріне тәуелсіз және әр уақытта ядролар, хлоропластар, митохондриялар өзара қосылып, генетикалық информациямен алмасулары мүмкін. Бірақ уақиға басқаша өтуі де әбден мүмкін: ядролар қосылмайды, органеллалар да қосылмайды, кейбір органоидтар тіпті бұзылып кетеді. Қосылған протопластарды өсірген уақытта митоздың барысында ядро мен органоидтардың сегрегациясы (бөлініп шығарылуы), бірен-сараңдаған хромосомалардың жойылуы (элиминациясы), кейбір органоидтардың ішінара (селективтік) көбеюі мүмкін. Сонымен қатар, бұл жағдайларға, будандастыру процесіне байланысты генетикалық тұрақсыздық пен мутациялық өзгергіштік қосылуы мүмкін. Будан клеткалардың дұрыс түзілуіне бірқатар факторлар кедергі бола алады: 1) қосылатын компоненттерді фюзогенмен өңдеу кезінде пайда болатын тұрақсыздық; 2) қосылатын протопластардың бір түрінде немесе екеуінде де өсіру тығыздығы төмен; 3) ядролардың асинхронды бөлінуі; 4) вакуольдерге бола цитоплазманың толық қосылмауы; 5) бірнеше митоздардан соң хромосомалардың жоғалуы; 6) будан клеткалардың өсіру тығыздығы төмен болғандықтан құруы.
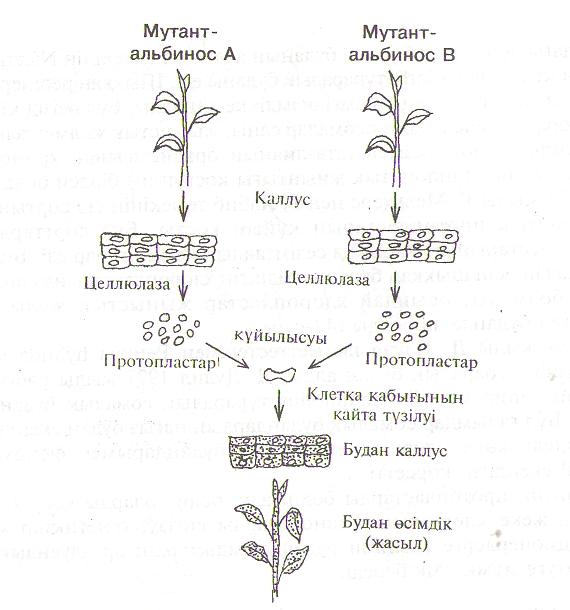
42-сурет. Мутанттық альбинос линияларын будандастыру.
Мутациялар бір-бірін толықтыру нәтижесінде жасыл будан өсімдік пайда болады (23).
Сомалық клеткаларды будандастыру кезінде гендер тағдыры көптеген факторларға байланысты, ол өкінішке орай әлі жақсы зерттелмеген. Өсімдіктердің клеткалық инженериясының дамуына украин ғалымы Ю.Ю. Глеба үлкен үлесін қосты. Ол 25 жылдан астам уақыт онымен айналысып, сомалық будандастырудың генетикалық мәселелерін, әсіресе ата-аналық формаларының ядролық және цитоплазмалық гендерін зерттеп келеді.
Жыныстық жолымен алынған будандардан айнымайтын сомалық буданды гаплоидтық клеткаларды құйылыстырып шығаруға болады. Жоғарыда айтылғандай, бұл тәжірибені өз кезінде Г. Мельхерс пен Г. Лабиб темекінің екі түрінің андрогендік гаплоидтардан бөліп алынған протопластарымен өткізген.
Бірақ эксперименттердің көбінде кәдімгі сомалық клеткалар майдаланылады. Егер протопластар ядролары қосылса, олар амфидиплоидтық болулары керек, яғни екі ядроның диплоидтық хромосомалар жиынтықтары қосылады. Бірақ түрлі өсімдіктердің зерттелген сомалық будандарында амфидиплоидтық хромосомалар жиынтығы болмаған.
Ю.Ю. Глеба әріптестерімен темекінің бір түрінін протопластарында сомалық будандастыру кезінде ядролық гендердің жүріс-тұрысын зерттеген. Олар құйылысқан протопластарды механикалық жолмен бөліп алып, оларды бөлек өсірген. Бұл тәсілдің арқасында жеке клеткаларда өтіп жатқан генетикалық окиғаларды және әрбір клонның көптеген ұрпақтарын зерттеуге болады. Ата-аналық біреуі ретінде олар темекінің Ксанти сортынын ескі каллус линиясын алған. Бүл линия морфогенезге кабілетін жоғалткан және 5-метилтриптофанға шыдамды болған. Екінші ата-ана ретінде темекінің Роза сортының мезофильдік амфигаплоидтық (п=24, әрбір ата-анадан хромосомалардың гаплоидтық жиынтығы бар) және амфидишюидтык, клеткалары алынды. Бұл клеткалар жарыққа сезімтал рецессивтік геннен гомозиготалар болған. Екі тәуелсіз тәжірибеде механикалық әдіспен 13 каллус протопластарымен құйылысқан гагаюидтық мезофилл клеткалары және 12 каллус протопластарымен қосылған диплоидтық мезофилл клеткалары алынды. Бұдан басқа 12 каллус және 6 мезофилл протопластары оқшауланып алынды. Барлық қосылған клеткалар және жеке-жеке алынған ата-ана клеткалары каллус түзеп, кейін бүтін регенерант өсімдіктерін берді. Тек бір де бір протопластар құйылысып пайда болған будан клетканың клоны жөнді өсімдік бермеді. Сонымен қатар, бірінші ата-ана ретінде алынған темекінің (Ксанти сорты) клеткаларынан да регенерант шықпады, себебі ол морфогенезге қабілеттілігінен айырылған. Нәтижесінде пісіп-жетілген 350 өсімдік алынды (әрбір клетка клонынан 5-тен 25-ке дейін). Олар өздерінін қасиеттері бойынша А, Б, В деген үш топқа бөлінді.
А тобындағы өсімдіктер клеткалық клондардын төртеуінен алынған. Оларда ата-ананың екеуінің де белгілері болған. Сондағы каллус клеткар белгілері: жарыққа төзімділік, триптофанның аналогына жарым-жартылай төзімділік, анеуплоидтық және хромосомалық тұрақсыздық. Роза сортының клеткаларының белгілері: нормалы морфогенез және жапырақтардың сағақсыз қондырмалы орналасуы. Бұл өсімдіктердің хромосомалық саны ата-аналарының хромосомалық жиынтығының қосындысына азды-көпті сәйкес келген. Сөйтіп, бұл өсімдіктер нағыз будан өсімдіктер болған, яғни протопластардың қосылуы негізінде олардың ядролары да қосылған.
Б тобындағы өсімдіктер клеткалық клондардың 14-нен алынған. Олар морфология жағынан нормалы болған және барлық белгілері бойынша ата-ананың екеуінің біреуіне ұқсас болған. Күшті жарықта өсіргенде олар түссізденген, яғни жарыққа төзімсіз болған. Клеткаларындағы хромосомалық жиынтығы тек қана гаплоидтық немесе диплоидтық болған. Бұл жәйт будан клеткаларда ата-ананың ядролары қосылмағанын көрсетеді. Регенерант өсімдіктері тек Роза сортының ядроларын иемденген клеткалардан пайда болған, себебі олардың морфогенезге қабілеті болған.
В тобындағы өсімдіктер құйылысқан екі протопластардан пайда болған будан клетканың клондарынан алынған. Бұл клондардан шыққан регенеранттардың ішінде әр түрлілік байқалған, яғни А тобындағы өсімдіктерге ұқсас және Б тобындағы өсімдіктерге ұқсастары болған. Гаплоидтық мезофилдің протопластарынан алынған регенеранттары барлық жағынан алғашқы Роза сортының өсімдіктеріне ұқсаған, тек қана регенеранттардың көбісі диплоидтық болып шыққан.
Ю.Ю. Глеба осы тәжірибелердің нәтижесінде мынадай негізгі қорытындыға келеді. Протпластарды қосып будан өсімдіктерді алғанда , олардың ядролық гендері ата-ананың екеуінен қалай тұқым қуаласа, солай-ақ біреуінен де тұқым қуалай алады. Ақырғысы, сірә, ядролар қосылмай, кейін гетерокариондарда сегрегацияға ұшырауына байланысты шығар. Бұл түр аралық және түр ішіндегі комбинацияларында байқалады. Осындай тұжырымға басқа зерттеушілер де келді.
Г. Мельхерс пен Г. Лабиб ядролары қосылған кездегі хромосомалардың жүріс-тұрысын анықтады. Олар темекі мезофилінен алынған гаплоидтық протопластарының құйылысуынан шыққан будандардың хромосомалық санын зерттеді. Темекі жапырағының мезофилл клеткалары жалпы гомоплоидтық болады, ал гаплоидтық өсімдіктерінде гаплоидтық болады. 55 түрлі будан каллустардан шыққан регенеранттардың ішінде 30-ы диплоидтық, 5-і үшплоидтық, 6-ы тетраплоидтық болған. Бұдан басқа анеуплоидтар да болған. Сонымен, будандардың көбі кәдімгі ұрықты амфидиплоидтар болып шықты. Бұл жағдай клеткалар қосылғанда ядролардың да қосылуын дәлелдейді. Ал анеуплоидтар клеткаларды іп үііто өсіргендегі генетикалық өзгергіштік себебінен пайда болған шығар.
Басқа ғалымдар темекінің, сасықмендуананың жақын туыс арасындағы будандарын зерттеп, ұқсас нәтижелер алды. Демек, жақын туысты түрлерді сомалық будандастырғанда регенерант өсімдіктердің бір бөлігі ата-ананың хромосомалық жиынтығының қосындысы бар нормалы ұрпақты өсімдіктер болған.
Будан клеткадан шыққан регенеранттардың көбінде байқалатын амфидишюидтық көрсеткіштен ауытқуы талай себептерге байланысты. Олар: 1) анеуплоидтық және ата-ананың біреуінің немесе екеуінің де хромосомалық тұрақсыздығы; 2) будан клеткаларды іп үііго өсіргенде жағдайлардың онша лайықты болмауы; 3) будан клеткаларда генетикалық процестердің үйлестірілмеуі (түраралық будандастыру кезінде).
Екі протопласт құйылысқанда олардың цитоплазмалары араласады. Ядродан тыс хлоропластар мен митохондриялардағы гендер онша жақсы зерттеле қойған жоқ, сондықтан екі клетка қосылып кейін бөлінген кездегі цитоплазмада өтетін процестер жөнінде мағлұмат өте аз.
Цитоплазмадағы гендердің жүріс-тұрысын, оларда кодпен жазылған белгілерді зерттеп, анықтайды. Пластомда (клетканың барлық пластидтерінің гендері) атразин деген гербицидке, антибиотиктерге (стрептомицин, линкомицин, тентоксин) төзімділік және рибулозобисфосфаткарбоксилазаның (РуБФК) үлкен бөлшектерінің белоктары, хлоропласт полипептидтерінің құрылымы генетикалық кодпен жазылған. Ал митохондрионда (клетканың барлық митохондриялық гендері) цитоплазмалық аталық ұрықсыздығы, гүлдің морфологиясы, АТФ-синтетаза комплексіндегі полипептидтерінің бір бөлігі, митохондрияның кейбір белоктарының құрылымы генетикалық кодпен жазылған. Ю.Ю. Глеба қызметтестерімен мынадай тәжірибе өткізді. Темекінің Самсун сортының хлорофилден ақауы бар пластомды мутанттарынан (барлық клеткалардағы пластидтердің кемістігі болған) ІІротопластарды бөліп алған. Жабайы (нормалы) пластомы бар және цитоплазмалық аталық ұрықсыздық белгісі бар Дюбек-44 сортының протопластарын, Самсун сортының протопластарымен құйып қосады. Цитоплазмалық аталық ұрықсыздық белгісі фенотипте гүлдердің бір жыныстық (аталық гаметофиттері - тозанқаптары жоқ) болуымен көрінген. Өсімдіктердің екеуінде де РуБФК полипептидтеріне полиакриламид гелінде изоэлектрофокустау арқылы биохимиялық талдау өткізілді. Екі ата-ананың РуБФК-ның үлкен бөлшектеріндегі айырмашылығы, кейін алынған сомалық будандардың биохимиялық талдауының негізі болды. Самсун сортының протопластарынан шыққан регенеранттары аппақ болған, Дюбек-44 сортында - жасыл болған, ал будан клеткалардан пайда болған 6 өсімдіктер - алажапырақ болған. Бұл өсімдіктердің клеткаларында хромосомалар саны есептелді. Сонда төрт өсімдік диплоидтық, біреуі тетраплоидтық (ядролар бойынша нағыз будан), тағы біреуі үшплоидтық болып шықты. Барлық алажапырақты өсімдіктер бір жыныстық болды және оларды цитоплазмалық аталық ұрықсыздық белгісі болды. Алажапырақты өсімдіктердің РуБФК-ның полипептидтерінің биохимиялық талдауы оларда ата-ананың екеуінің де полипептидтерінің бар екенін көрсетті. Алынған нәтижелерді авторлар былай түсіндірді: құйылысқан протопластардан шыққан алажапырақты өсімдіктер хлорофилдінжетіспеушіліі-ін белгілейтін хлоропласт гендері бойынша және РуБФК-ның үлкен бөлігінің құрылымын белгілейтін хлоропласт гендері бойынша гетерозиготалық өсімдіктер болғаны. Бұл гетерозиготалық сомалық будандастырудағы ата-аналардың цитоплазмасы «будандасып» және цитоплазмалық гендері олардың екеуінде тұқым қуалау салдарынан туындайды.
Сонымен қатар, митохондриялық ДНК-да жазылған цитоплазмалық аталық ұрықсыздық белгісі ата-ананың біреуінен тұқым куалаған, яғни гомозиготалық болған. Алты алажапырақты регенерант өсімдіктердің тек біреуі ғана, шамасы, нағыз будан болған, жапырақ құрылымы аралық формалы болған және гүл құрылымы осы сорттардың жыныстық будандарына ұқсас болған. Диплоидтық өсімдіктер морфология жағынан Дюбек-44 сортынын өсімдіктерінен айнымаған, шамамен олар Самсун сортының ядролары жойылып кеткен гетерокарионнан шыққан.
Сонымен, бұл тәжірибелер протопластарды қосып өсімдіктерді будандастыру кезінде ата-аналардың кейбір цитоплазмалық гендері екеуінен де тұқым қуалайтынын анық дәлелдеді. Бұл құбылыс түраралық будандастыруда орын алады екен.
Осы және басқа авторлардың эксперименттері бір мағыналы дәлелдегендей, протопластардың қосылуы арқылы цитоплазмалық гетерозиготалық буданды, яғни ата-ананың екеуінің де цитоплазмалық гендерін иеленген буданды алуға болады. Сөйтіп, сомалық будандастыру әдісі цитоплазмалық гетерозиготаларды алудың жолы. Митоздық көбею кезінде плазмагендердің сегрегациясы орын алады, қорытындыда қайсысы болса да плазмагеннен гомозиготалық ата-ананың таза формасы шығуы тиіс (егер рекомбинация өтпесе). Көптеген будан өсімдіктерінде пластидтерін зерттеген барлық жұмыстарда ата-ананың екеуінің де таза пластидтерінің пайда болуы байқалған. Бұл цитоплазмалық гетерозиготаларда сегрегацияның кездейсоқ өтуін және осы органоид деңгейінде селекция қысымының болмағандығын көрсетеді. Сегрегация процесінде пластидтік ДНК жазылған белгілер (пластидтік хлорофилдің ақауы, стрептомицинге, Іенгоксинге, атразинге төзімділік, РуБФК-ның үлкен бөлшегінің Полипептидтік құрылымы, хлоропластық ДНҚ рестриктік спектрлері) топтасып жойылады. Мүмкін, сомалық будандарда ата-аналардың хлоропластары түсіп қалуына, протопластардың қосылуына, сұрыпталуына және регенерациясына ілеспелі факторлар күшті әсер ететін шығар. Реіипіа рагосііі мезофилл ұлпасының протопластары мен Р. һуЪгісІа, Р. іпЯаІа, Р. рогуійога суспензияда өскен альбинос мутанттарының протопластары қосылып алынған сомалық будандарында рестрикциялық эндонуклеазаларды қолданып, хлоропластық ДНК (хпДНК.) талдауы өткізілген. Бұл талдау көрсеткендей, барлық будандарда хп ДНК бір ғана түрі болған, ол Р. рагосНі хпДНК. Үш буданның біреуінде де хпДНК арасында рекомбинация өтпеген.
Сомалық будандардың митохондриялық ДНК (мхДНҚ) және онда жазылған белгілерін зерттегенде мүлдем басқаны көрсетті. Бұл белгілердің сегрегациясы күрделі өтеді екен, соның нәтижесінде белгілі екі таза ата-ана формаларынан басқа көптеген тұрақты формалар пайда болады. Бұл құбылысты будан клеткаларда өтіп жатқан түрлі оқиғалар арқасында түсінуге болады. Біріншісі, ата-аналардың мхДНҚ арасындағы әрекеттесуі нәтижесінде екеуінің де нуклеотид тізбегі бар рекомбинанттық мхДНК пайда болуы. Екіншісі, жоғары сатыдағы өсімдіктердің мхДНК гетерогендік болғандықтан будан клетка бөлінгенде мхДНК бұрын ата-аналарда білінбеген минорлық фракциясы басым бөлініп, көріне бастайды. Сонымен қатар, түр ішіндегі молекула аралық рекомбинациялар және молекула аралық қайта құрылу өтуі мүмкін.
Місоііапа ІаЬасит цитоплазмалық будандарының мхДНҚ биохимиялық талдау көрсеткендей, митохондриялық геномдарында рекомбинация жүреді екен. Осы және кейінгі тәжірибелер анық дәлелдеген мынадай тұжырымдар туды: 1) сомалық будандарда пластом белгілері толық косегрегацияға ұшырайды; 2) пластомның генетикалық рекомбинациясы өте сирек кездеседі; 3) митохоңдриялық ДНҚ рекомбинанттік түрі өте жиі кездеседі; 4) митохондрионның пластомға тәуелсіз өз бетімен сегрегациясы өте береді. Сонымен, сомалық будандастыруда мхДНК өзгеруі хпДНК елеулі айырмашылығы, яғни жыныстық процесіне қарама-қарсы, мхДНК әжептәуір өзгерістерге тап болады.
Протопластарды ПЭГ-мен өңдегенде екеу тұрмақ үш, одан да көп клеткалар құйылысуы мүмкін. Неше клетка қосылғанын анықтау үшін сомалық будандардың хромосомалық санын есептейді. Мысалы Г. Мельхерс пен Г. Лабиб жоғарыда айтып кеткен темекінің гаплоидтық протопластарымен өткізген тәжірибесінде 63 жасыл регенерант арасында 18 үшплоидтық өсімдікті тапты. Ю.Ю. Глеба темекінің диплоидтық клеткаларын будандастырып, 9 регенерант ішінде біреуі гексаплоидтық болып шыққан. О. Шидер сасықмендуананың түраралық сомалық будандарымен мұқият өткізілген эксперименттерінде үш және одан астам клеткалардың қосылғанын анықтаған. Бірақ мұндай будандар зерттелмеген, сондықтан олардың ядролық және цитоплазмалық гендерінің тағдыры белгісіз.
Сөйтіп, сомалық будандардың жыныстық будандардан айырмашылығы, олардың көп өзгергіштігі. Сомалық будандарда байқалатын фенотиптік өзгергіштік регенерация процесі басталмастан бұрын өтетін генетикалық құбылыстардың нәтижесі. Д. Эванс пен Е. Фликс бойынша, өзгергіштік себебі мынада: 1) ядролық сыйымсыздық; 2) митоздық рекомбинация; 3) органоидтардың белгілерінің ажырауы; 4) сомаклондық өзгергіштік.
Қорытындысында, ерекше көңіл аударатын жағдай, сомалық будандарда өтетін генетикалық процестер өте аз зерттелген. Сондықтан, ол процестердің керек бағытта өтуін қадағалап реттеу әзірше мүмкін емес.
3. Әр қилы тұқымдастар, трибалар (тұқымдас пен туыс аралығындағы жүйелеу бірлігі) және туыстар құрамына кіретін бір-біріне жат түрлер арасында жыныстық жолмен будан алу мүмкін емес. Филогенезде түпкі тектері алшақ жатқан түрлер арасынан тек сомалық буданды, олардың протопластарын қосып алуға болады. Бірақ осы кезге шейін ондай сомалық будандардан құнды ұрпақты өсімдіктер әлі алынған жоқ. Мысалы, ғалымдар мынадай тұқымдасаралық будан клеткалардан линиялар алған: соя мен темекінің әр түрлерінің каллус пен мезофилл протопластарын қосып; бұршақ пен темекінің; ат бұршағы мен темекінің; темекі мен пияздың және т.с.с. Осы тұқымдасаралық клеткалық будандардың клондары зерттелді. Барлығында қысқа мерзімде мезофилл клеткасының хромосомалары жойыла бастаған. Цитогенетикалық талдау мен изоферменттердің құрамын талдау көрсеткендей, хромосомалар толық жойылмаған. Тұқымдасаралық будан клеткалар арасында көп ядролық немесе өте кіші клеткалар, хромосомалық қайта құру, алып хромосомалар көп байқалған. Тек темекі мен ат бұршағы арасындағы будан клеткаларда морфогенез индукциялау арқасында сабаққа ұқсас кемтар құрылымдар пайда болған. Бір тұқымдасқа қарайтын түрлердің будандарын алғанда, яғни трибааралық және туысаралық будандармен өткізген тәжірибелердің нәтижесі жөндірек болған. Бұндай будандар алқа, крестгүлдер және шатыршагүлділер тұқымдастарында алынған.
1978 жылы Ю. Ю. Глеба мен Ф. Хофман арабидопсистың каллус протопластарын турнепстың мезофилл протопластарымен қосып сомалық будан алды. Бұл өсімдіктер крестгүлділер тұқымдасының әр түрлі трибаларына жатады. Будан клеткалар линияларында цитологиялық талдау көрсеткендей, екі түрдің де хромосомалары жойылмаған, дегенмен хромосомаларда қайта құру өткен. Клеткалардың екі линиясында морфогенез жүргізіліп, регенерант өсімдіктері алынған. Олар морфология жағынан арабидопсиске де, турнепске де ұқсас болған. Бірақ бұл нормалы өсімдіктер емес еді, олар гүлдеген жоқ. Цитологиялық, биохимиялық және морфологиялық талдау өткізгенде, будан өсімдіктерде екі түрдің де генетикалық материалы болғаны дәлелденді. Ал арабидопсис пен турнепстің іn vitro жағдайында өсірілген жазушаларынан сабақтар шыққан жоқ. Бұл өте қызық құбылыс. Будан жазушаларында морфогенез бен регенерация өткені морфогенездік қабілетінің қалпына келуін дәлелдейді.
Сомалық будандастыру жолымен сасықмендуана мен итжидек (красавка), итжидек пен қытай темекісі, итжидек пен бежір (сныть), итжидек пен шырайгүлдің (петуния) арасында трибааралық будандар алынған. Бұл жұмыстардың маңызды нәтижесі, олар филогенезде түпкі тектері алыс өсімдіктердің будан клеткаларының морфогенездік активтігін көрсетеді. Сонымен бірге морфогенезге қабілеттілік ата-аналардың біреуінің генетикалық материалының жойылуымен байланыспаған.
Туысаралық сомалық будандар арасында ең қызығы картоп пен томат буданы. Оны 1978 жылы бірінші болып Г. Мельхерс шығарды, кейін басқа ғалымдар да алды. Регенерант өсімдіктерінде (помато, томафель) ядролық, материалы буданды болды, бірақ олар ұрпақсыз еді.
Жапон ғалымдары үлкен табысқа жеткен, олар астық тұқымдастардың әр түрлі туыстарына жататын күріш пен тарының сомалық будандарын алған, онда екі түрдің де белгілері болған. Әсіресе қызықтыратын жағдай, бұл даражарнақтыларға жататын өсімдіктер.
Жоғарыда сипатталған эксперименттерде алынған барлық өсімдіктер аномальды болғандықтан олар тек теориялық тұрғыдан ғана маңызды. Филогенезде түпкі тегі алыс өсімдіктер түрлерін будандастыру тіршілік негізінде жатқан процестерді зерттеуге мүмкіншілік береді. Тек қана сомалық будандастыруды пайдаланып, клетканың бөлінуі, сол кездегі генетикалық материалдың ұйымдасуы және морфогенез жөнінде бірталай мәселелерді эксперимент түрінде шешуге болды. Сонымен бірге, кейбір кезде тұқымдасаралық будандар ата-аналардың біреуінің хромосомалары түсіп қалуы арқасында асимметриялық будан болып шығады. Оларды селекцияда жеке хромосомаларды немесе хромосома бөліктерін алыс туыс түрлер арасында тасымалдау үшін пайдалануға болады.
ПЭГ қайсы клеткалар қосылса да әмбебап фюзоген болғандықтан жануар клеткалары мен өсімдіктер клеткаларын қосу тәжірибелері өткізілген. Олардың құйылысқан клеткалары бірнеше күн тіршілікке икемді болған, тіпті кейде ядролары қосылып, клетка қабығы да түзілген. Мысалы, адамның ісік клеткалары және темекінің мезофилл протопластарымен, сәбіздің, ІІІІІлопаппус протопластарымен қосылған, адамның лимфоциттері темекінің мезофилл протопластарымен, амфибия клеткалары сәбіз протолластарымен құйылысқан.
Сонда осы тәжірибелердің мақсаты қандай? Әрине тек қана пайдалы будан организм алу үшін ғана емес. Бұл эксперименттердің теориялық маңызы зор. Жануарлар мен өсімдіктердің Эукариот клеткаларын толығырақ зерттеуге мүмкіншілік береді, олардың будан клеткалары бөліне алатын жағдайды анықтауға, жануар клеткалардан өсімдік клеткаларына гендерді көшіру мүмкіншілігін және басқа да күрделі мәселелерді зерттеуге көмектеседі.
4. Жеке гетерокариондар мен будан протопластарды көптеген ата-аналық протопластардың арасынан сұрыптап алу киын міндет. Сондықтан алғашында зерттеушілер будандарды регенеранттар пайда болғанда мутациялардың комплементарлығы негізінде іріктеген. Г. Мельхерс пен Г. Лабиб 1974 жылы алынған өсімдіктерінің нағыз сомалық будан екендігін дәлелдеу үшін генетикалық комплементтенуді қолданды. Генетикалық комплементтену - ол будан клеткаларда гендер әрекеттесу негізінде ақауы бар гендердің функциясын қалпына қайтадан келтіруі. Ата-ана ретінде Кісоііапа ІаЪасшп екі сортын қолданды. Олардың жарыққа сезімтал хлоропластары болған. Әрбір сорттың ядросында жарыққа сезімталдықты белгілейтін өзінің рецессивтік гені болған (v мен 8). Сол гендердің салдарынан бұл өсімдіктер жарықта өскен кезде хлорофилл түзілуі кемтар болған. Осы гендер бойынша гомозиготалық өсімдіктер күшті жарықта өсіргенде, жапырақтары түссізденіп, ақырында құрыған. Ал жыныстық будандардың хлоропластары дұрыс түзіліп, жапырақтары жасыл болған, себебі мутацияға ұшыраған ақау гендер жыныстық процесс кезінде комплементтеніп кеткен. Екі сорттың гаплоидтық протопластары қосылғанда да дәл соңдай нәтижеге жеткен. Бұл тәжірибе бірнеше сатыдан тұрған (43-сурет).
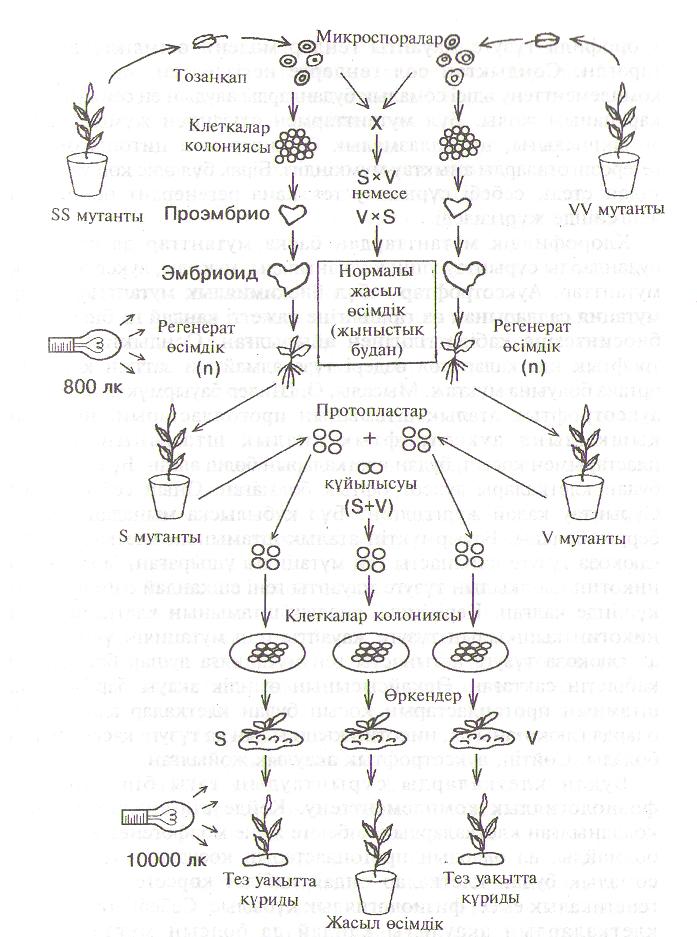
43-сурет. Темекінің жарыққа сезімтал сорттарымен өткізілген тәжірибенің схемасы
Алдымен тозанқаптарды өсіріп гаплоидтық өсімдіктер алынған. Бұл өсімдіктер жарықта емес, көлеңкеде өсірілген. Сондықтан жапырақтары жасыл болған, сәуле түспеген соң олардың мутацияға душар болған гендері өздерінің активтігін көрсете алмаған. Олардың жапырақтарынан протопластар бөлініп алынған. Протопластарды қосып, будан клеткалар жасалған. Ол клеткаларды колониялар және каллустар пайда болғанша өсірген. Каллустарды жаңа ортаға көшіріп, морфогенез процесін жүргізген. Сонда каллустардан сабақтар шыққан. Одан сон жарықта (10000 лк) өсіре бастаған. Бұл жағдайда хлорофилл түзіп жасыл өскіндері болып, тірі қалған тек қана сомалық будан өсімдіктер ғана. Ал будан емес өскіндер ақшыл болған, ақырында құрыған.
Сол сияқты басқа тәжірибелер де өткізілген. Оларда фотосинтездік мутанттардың генетикалық комплементтенуін №соІіапа мен ОаШга будандарын алу үшін пайдаланған. Хлоропласт гендерінің құрамында мутацияға душар болған хлорофилл түзуге жауапты гендер мәдени өсімдіктерде кең тараған. Сондықтан сол гендерге негізделген генетикалық комплементтену әдісі сомалық будандарды алудың ең сенімді және қарапайым жолы. Бұл мутанттармен өткізілген жұмыстардың артықшылығы, цитоплазмалық будандар мен цитоплазмалық гетерозиготаларды анықтау мүмкіңдігі. Бірақ бұл әдіс көп уақытты талап етеді, себебі сұрыптау тек қана регенерант өсімдіктер деңгейінде жүргізіледі.
Хлорофилдік мутанттардан басқа мутанттар да сомалық будандарды сұрыптау үшін қолданылады, мысалы, ауксотрофтық мутанттар. Ауксотрофтар - бұл биохимиялық муташтар. Олар мутация салдарынан өз тіршілігіне қажетті қаңдай да бір заттың биосинтезіне қабілеттілігінен айырылған. Сондықтан ауксотрофтық клеткалар сол өздері түзе алмайтын заттың қоректік ортада болуына мұқтаж. Мысалы, О. Шидер бауырмукті глюкозаға ауксотрофтық аталық штамының протопластарын, никотин қышқылына ауксотрофтық аналық штамының протопластарымен қосып, будан клеткаларын бөліп алған. Бұл сомалық будан клеткалары ауксотрофтық болмаған. Оның себебі неде? Сұрыптау қалай жүргізілген? Бұл құбылысқа мынадай түсінік беруге болады. Бауырмуктің аталық штамының клеткасындағы глюкоза түзуге қатынасты ген мутацияға ұшыраған, бірақ оның никотин қышқылын түзуге жауапты гені ешқандай өзгеріссіз, өз күшінде қалған. Керісінше, аналық штамының клеткасындағы никотин қышқылын түзуге жауапты гені мутацияға ұшыраған, ал глюкоза түзуге қатынасты ген мутацияға душар болмай, өз қабілетін сақтаған. Әрқайсысының өзіндік ақауы бар осы екі штамның протопластарын қосып будан клеткалар алынғанда, оларда глюкозаны да, никотин қышқылын да түзуге қасиет пайда болады. Сөйтіп, ауксотрофтық ақаулық жойылған.
Будан клеткаларды сұрыптаудың тағы бір әдісі, ол физиологиялық комплементтену. Кейде ата-аналық ретінде қолданылған клеткалардың көбеюге және морфогенезге қабілеті болмайды, ал олардың протопластарын қосудан пайда болған сомалық будан клеткалар ондай қабілет көрсете алады. Бұл генетикалық емес, физиологиялық құбылыс. Себебі, ата-аналық клеткалардың ақаулығы қандай да болсын мутацияларға байланысты емес. Будан клеткалардың көбеюге және морфогенезге қабілеттілігінің қалпына келуі олардың сыртқы жағдайға нормалы физиологиялық реакциясы. Бірінші болып 1972 жылы бұл әдісті табысты қолданған П.Карлсон. Ол Кісойапа ціаиса мен ІЧ.1ап§8сіогЯі түраралық сомалық буданын алды. Бұл түрлер арасынан жыныстық будандар бұрын алынған еді және олардың клеткалары іп үһго өсіргенде ауксинді қажет етпеген. Ал, керісінше, ата-аналық ретінде қолданылған бұл екі түрдің клеткалары іп УІІГО жағдайында қоректік ортаға ауксинді қоспаса өсе алмаған. Осы екі түрдің мезофилл протопластарын қосып, нуксині жоқ ортада өсірген. Бұндай қоректік ортада тек қана сомалық будан клеткалар ғана өсе алған.
Э. Кокинг физиологиялық комплементтенуді қолдану үшін мына тәсілді ұсынған. Алдымен ата-аналық ретінде алынған клеткалар іп үігго өсіріліп, олардың біріне қолайлы, ал басқасына қолайсыз қоректік ортаның құрамы анықталады. Олардың протопластарын қосқан соң, клеткаларды кезекпен сол қоректік орталарда өсіреді. Соның нәтижесінде аталық немесе аналық клеткалар өздеріне қолайсыз ортада құриды, ал сомалық будан клеткалар көбейіп, өсе береді.
Физиологиялық комплементтенуді қолдану үшін зерттелу өткізілмеген кезде, генетикалық маркерлері болмағанда, басқа әдісті қолдануға болады. Ол үшін протопластарды құйылысу алдында, метаболизмді тежейтін улы заттармен өңдейді. Екінші өсімдіктің протопластарын басқа улы заттармен өңдейді. Осыңдай протопластар құйылысып, будан клеткалар пайда болғанда олардың метаболизмі жөніне келеді, яғни биохимиялық комплементтену өтеді. Қосу үшін алынған протопластардың активтігін тежеу үшін оларды улы заттармен ғана емес, әр түрлі сәулелермен де (ультракүлгін, гамма, рентген) өңдеуге болады.
Бірақ Э. Кокингтің пікірі бойынша, комплементтену негізіндегі сұрыптау әдістерінің кемшілігі бар. Бұл әдістерді қолданғанда, 1 ск қана амфидишюидтык сомалық будандар тірі қалады. Олардың арасында, мүмкін, құнды асимметриялық будандар (бір ата-ананың толық геномы, екіншісінің - бөлігі) алынбай қалады. Сондықтан, ең тиімдісі олардың әрқайсысын механикалық әдіспен қадағалап көріп отырып, қолмен шеберлікпен іріктеп алу. Ол үшін алдымен будан клеткаларға тән белгіні анықтап алу керек. Мысалы, инверттік микроскоп пен микроманипуляторды қолдана отырып, мезофилл протопластары (пластидтері жасыл, цитоплазмасы аз, вакуолі үлкен) мен каллус протопластары (цитоплазмасы көп, оның ядросы жақсы көрінеді) қосылудан пайда болған клетканы бөліп алуға болады. Бұл әдістің артықшылығы - мутанттарды немесе алдын ала өсіру жағдайларын зерттеуді қажет етпейді.
Протолластарда көзге көрінетін табиғи маркерлары болмаса, оларды қосар алдында флуоресценттік заттармен бояйды. Протопластардың әр түрін флуоресценциясы әр түрлі заттармен бояйды. Бір клеткада екі түсті флуоресценциясы болғаны, оның будандық құрылымына дәлел.
Клеткаларды сұрыптаудың механикалық әдісінің де өз кемшілігі бар, сондықтан ол жиі пайдаланылмайды. Бұл әдіс көбінесе каллус клеткаларының протопластарына қолданылады, өйткені оларды жекелеп өсіру оңайырақ. Будан клеткаларды бөліп алу және кейін микротамшыда өсіру, бір клеткадан тараған ұрпақтар алуға, яғни клетканы клондауға мүмкіндік береді. Клондау будан өсімдіктің белгілі бір жеке протопластан шыққандығына кепіл болады.
Сонымен, будан клеткаларын сұрыптау әдістері біршама, бірақ олардың әрқайсысы әжептәуір еңбекті талап етеді. Сондықтан Коол және Швейгер зерттеп дайындаған әдіс тиімді көрінеді. Алдын ала іріктеп алынған, қосылуға арналған екі протопласты әйнектің үстіне құйылған минералдық майдың тамшысына салады. Электр күшімен қосу үшін электродтарды инверттік микроскоптың конденсорына бекітеді. Конденсорды көтеріп немесе түсіріп жылжыта отырып, электродтарды тамшыға енгізеді немесе одан шығарады. Электр импульсты берген соң, микроскоп арқылы протопластардың қосылуын бақылайды. Сонан соң қосылған клетканы байытылған қоректік ортаның микротам-шысында жеке өсіреді.
Дәріс №25
Сомалық будандарды талдау əдістері.
Сомалық будандарды практикада пайдалану.
ЖОСПАР
1.Будан өсімдіктерді талдау әдістері
2. Сомалык будандарды практикада пайдалану
Протопластардың қосылып будан клетканың пайда болғанын бірнеше әдістермен тексеріп, дәлелдеуге болады. Ол үшін генетикалык және биохимиялық талдаулар өткізеді. Будандастырулық талдау (гибридологический анализ) генетикалық әдістеріне жатады. Ол үшін нақтылы қасиеттерін ескере отырып, арнайы таңдап алынған өсімдік формаларын бір-бірімен будандастыру нәтижесінде тараған ұрпақтардың фенотиптік белгілерінің бастапқы аталық пен аналықтан қаншама ауытқып, өзгеріске ұшырағандығын статистикалық есептеу арқылы біледі. Егер сомалық будандастыру үшін рецессивтік мутанттар қолданылса, онда будан клеткада ол мутациялар жасырын түрінде қалады. Ал алынған будан өсімдік кейін өз тозаңымен өзі ұрықтанса (жыныстық көбею) одан шыққан Ғ, ұрпақ фенотипінде мутациялар қайта жаңғырады. Осылай өткізілген талдау, шыққан өсімдіктердің будандық табиғатын дәлелдейді. Бірақ сомалық будандардың ядролық гендерінің ондай өсімдіктер жыныстық будандастыру жолына түскен кездегі күй-жайы әзірше өте нашар зерттелген.
Көбінесе сомалық будандар цитогенетикалық талдауға түседі, яғни хромосомаларының құрылымы мен саны зерттеледі. Бұл әдіс әсіресе алыс туыстардың (трибааралық, тұқымдасаралық) будандарына қолайлы. Себебі олардың шығу тегіндегі аталық пен аналық өсімдіктердің хромосомалары арасында әжептәуір айырмашылығы бар. Егер будандасқан түрлердің хромосомалары морфология жағынан ұқсас болса, онда оларды дәлірек айқындау үшін дифференциялды бояу әдісі қолданылады. Бұл әдіс хромосомалардың әрбір гомологиялық жұбына тән ерекше сынақтарын анықтайды. Бірақ цитогенетикалық талдау ылғи бірдей сенімді бола бермейді, өйткені іn vitro өскен клеткалардың хромосомалары өте жиі өзгеріске ұшырайды.
Көптеген зерттеушілер биохимиялық талдау әдістерін кеңінен пайдаланады, әсіресе түраралық будандар үшін. Полиакриламид Іслінде электрофорезді жүргізіп, одан кейін белгілі ферменттік активтігі бар белоктарды бояу арқылы изоферменттерді зерттеу -биохимиялық талдау әдістерінің ең қарапайымы және тиімдісі әдетте сомалық будандардың пероксидаза, эстераза, малатлегидрогеназа, глюкозо-6-фосфатдегидрогеназа, алкогольдегидронипза, лактатдегидрогеназа, амилаза т.б. ферменттердің изоферменттік спектрлері зерттеледі.
Парасексуальдық будандарды биохимиялық талдаудың ең бір тиімді және оңай әдісі, ол РуБФК ферментін зерттеу. РуБФК -ги көп тараған және ең жақсы зерттелген өсімдіктер белогы. Ол фотосинтездегі Кальвин циклінің ең маңызды ферменті. Ол 8 үлкен және 8 кіші бөлшектерден тұрады. Үлкен бөлшектердің полипептидтер құрамы хлорогопластық ДНК бойында генетикалық кодпен жазылады, ал кішкенелердікінің - ядролық ДНК бойында. Полиакриламид генінде изоэлектрофокустау әдісімен бөлшектерінің полипептидтік құрамын зерттеу арқылы әр түрлі өсімдіктердің ферментінің полипептидтерінің құрылымындағы айырмашылықтарын анықтауға болады. Осындай талдау буданның шығу тегін зерттеу үшін бірқатар түраралық парасексуальдық будандарда өткізілген. Сонымен бірге РуБФК- ның талдауы ядродан тыс орналасқан гендерді зерттеу үшін де қолданылады.
Осы мақсатпен будандар мен ата-аналарының хлоропластық ДНҚ және митохондриялық ДНК бөлініп алынып зерттеледі. Ол үшін ДНК, нуклеазалармен өнделеді. Ол ферменттер ДНК-ны әр түрлі ерекшежерінен үзеді, ажыратады. Кесілген ДНК фрагменттерін электрофорезбен таңдағанда, түріне тән ерекшелігі айқындалады. Сөйтіп, оны буданның және ата-аналардың органоидтарын зерттеу үшін қолданып, олардың табиғатын анықтауға болады.
Сомалық будандарды талдау үшін нуклеин қышқылдарын молекулалық будандастыру әдісі де пайдаланылады. Бұл әдіс ДНК денатурациялануына негізделген, яғни жоғары температураның әсерімен екі тізбектері ажырап, жеке-жеке күйінде қалып қояды. Буданнан және ата-анадан бөлініп алынған ДНҚ ұқсас бөліктерінің бар-жоғын тексеруге болады. Алдын ала ата-ана өсімдіктеріне құрамында радиоактивтік атомы бар қоректік зат беріледі (мысалы С14, Р32 ). Одан кейін осы өсімдіктерден және будан өсімдіктерінен ДНҚ бөлініп алынған, шағын фрагменттерге арнаулы ферменттермен үзіп, оларды жеке тізбектерге денатурациялайды. Будан өсімдіктердің тізбектерін арнайы матрицаға түгелдей бекітеді. Сол матрица арқылы кейін әлгі радиоактивтік тізбектерді өткізеді. Егер будан ДНК, фрагменттері мен ата-анасының фрагменттері толық ұқсас болса, радиоактивтік бөлшектер матрицада қалып қояды. Әр түрлі организмдерден алынған ұқсас ДНК бөлшектерінің бір-бірімен қос тізбек құруын молекулалық будандастыру деп атайды. Молекулалық будандастыру белгісі филогенезде типтері алыс түрлердің будандарын және асимметриялық будандарды зерттеу үшін өте маңызды.
Сонымен, атап өткен талдау әдістерінің барлығы протопластарды қосу нәтижесінде алынған нағыз будан клеткалар (немесе будан өсімдіктер) екендігін, олардың фенотипі буданға ұқсас мутант емес екендігін дәлелдеу үшін қолданылады.
