
- •Мазмұны
- •2. Өсімдіктердің мүшелерін және жекелеген бөліктерін өсіруді алғаш рет хіх-хх ғасырда неміс ғалымдары бастаған.
- •4. Биотехнологиядағы жекелеген жасушаларды және ұлпаларды өсіру үш бағытта қолданылады.
- •5. Өсімдік шаруашылығында биотехнологияны қолдану негізгі екі бағытта жүргізіледі:
- •1. Клетки, иммобилизованные в или на инертном субстрате, образуют биомассу гораздо медленнее, чем растущие в жидких суспензионных культурах.
- •2. Кроме медленного роста иммобилизация клеток позволяет им расти в тесном физическом контакте друг другом, что благоприятно отражается и на химических контактах.
- •2. Клондық микрокөбейтудің әдістері.
- •3. Қолтық бүршіктердің меристемасының дамуын индумиялау
- •6. Сомалық будандастыру цитология, генетика, молекулалық биология, физиология салаларында теориялық мәселелерді зерттеу үшін, сондай-ақ практикалық селекцияда қолданылады.
- •Гендерді тасымалдайтын векторлар
- •10.3. Гендерді өсімдіктерге тасымалдау әдістері
- •Гендік инженерияның мүмкіндіктері мен даму болашағы
1. Клетки, иммобилизованные в или на инертном субстрате, образуют биомассу гораздо медленнее, чем растущие в жидких суспензионных культурах.
Какова же связь между ростом и метаболизмом? При чем здесь клеточная организация и дифференцировка? Предполагают, что эта взаимосвязь обусловлена двумя типами механизмов. Первый механизм основан на том, что рост определяет степень агрегации клеток, оказывая косвенное влияние на синтез вторичных метаболитов. Организация в данном случае является результатом агрегации клеток, а достаточная степень агрегации может быть получена только в медленно растущих культурах. Второй механизм связан с кинетикой скорости роста и предполагает, что «первичный» и «вторичный» пути метаболизма по-разному конкурируют за предшественники в быстро и медленно растущих клетках. Если условия среды благоприятны для быстрого роста, то в первую очередь синтезируются первичные метаболиты. Если быстрый рост блокирован, то начинается синтез вторичных метаболитов. Таким образом, низкая скорость роста иммобилизованных клеток способствует высокому выходу метаболитов.
2. Кроме медленного роста иммобилизация клеток позволяет им расти в тесном физическом контакте друг другом, что благоприятно отражается и на химических контактах.
В растении любая клетка окружена другими клетками, но ее положение меняется в ходе онтогенеза в результате деления как этой, так и окружающих клеток. От положения клетки в растении зависит степень и тип дифференциации этой клетки. Следовательно, физическое окружение клетки влияет на ее метаболизм. Каким образом? Регуляция синтеза вторичных метаболитов находится как под генетическим, так и под эпигенетическим (внеядерным) контролем, то есть любые изменения в цитоплазме могут привести к количественным и качественным изменениям в образовании вторичных метаболитов. В свою очередь, цитоплазма представляет собой динамическую систему, находящуюся под влиянием окружающей среды.
Из внешних условий на метаболизм существенное влияние оказывают 2 важных фактора: концентрация кислорода и углекислого газа, а также уровень освещения. Свет играет роль и в процессе фотосинтеза, и в таких физиологических процессах, как деление клеток, ориентация микрофибрилл, активация ферментов. Интенсивность и длина световой волны определяется положением клетки в массе других клеток, то есть зависят от степени организованности ткани. В организованной структуре существуют центробежные градиенты концентрации О2 и СО2, которые играют исключительно важную роль в процессе дифференциации.
Таким образом, вторичный метаболизм в крупных агрегатах клеток с небольшим отношением площади к объему (S/V) отличается от такового изолированных клеток и мелких групп клеток в результате действия градиентов концентрации газов. Аналогично действуют градиенты регуляторов роста, питательных веществ, механического давления. Условия окружения у диспергированных клеток и клеток в виде агрегатов различны, поэтому пути метаболизма у них также различаются.
3. Регулировать выход вторичных метаболитов можно также, изменяя химический состав окружающей среды.
Изменение состава среды для каллусной и суспензионной культуры сопровождается определенными физическим манипуляциями с клетками, что может привести к повреждению или загрязнению культур. Эти трудности можно преодолеть, используя циркуляцию больших объемов питательной среды вокруг физически неподвижных клеток, что позволяет осуществлять последовательные химические воздействия.
4. В некоторых случаях возникают проблемы с выделением идиолитов.
При использовании иммобилизованных клеток относительно легко осуществляется обработка их химическим веществами, индуцирующими высвобождение требуемых продуктов. Это также снижает ингибирование по типу обратной связи, которое ограничивает синтез веществ вследствие накопления их внутри клетки. Культивируемые клетки некоторых растений, например, Capsicum frutescens выделяют вторичные метаболиты в окружающую среду, а система иммобилизованных клеток позволяет отбирать продукты без повреждения культур. Таким образом, иммобилизация клеток способствует легкой изоляции идиолитов.
Существует 2 типа систем культивирования иммобилизованных клеток:
1. Система культуры с плоской основой, клетки выращиваются в горизонтально расположенном сосуде.
2. Система колоночной культуры, где клетки выращиваются в вертикальном сосуде.
В обеих системах жидкая среда циркулирует вокруг физически неподвижных клеток.
Система культуры с плоской основой (рис. 13)
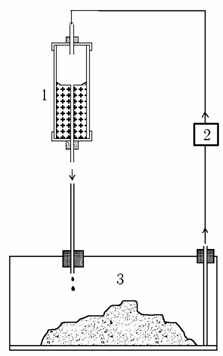
Рис. 13. Система культуры с плоской основой
Питательная среда капает под действием силы тяжести из цилиндрического сосуда объемом 70 мл (1) в стеклянный сосуд для культивирования (3) объемом 350 мл, где находятся клетки (40 – 50 г сырой массы), посаженные на субстрат – подстилку из нетоксичной полипропиленовой ткани. Питательная среда проникает сквозь ткань под действием капиллярных сил, снабжая клетки. После этого использованная питательная среда откачивается из сосуда для культивирования с помощью перистальтического насоса (2) обратно в резервуар и используется повторно.
Исследования, проведенные с этой системой, показали, что клетки Solanum niger, культивируемые на плоской основе (среда Мурасиге-Скуга с добавлением 2,4-Д и кинетина) способны потреблять питательные вещества и быстро реагируют на недостаток ортофосфата. Увеличение сырой массы идет гораздо медленнее, чем в суспензионных культурах. Количество жизнеспособных клеток такое же и достигает 70 – 80%. Количество алкалоидов через 7 суток культивирования достигает 12 мг/г сухой массы, в суспензии же через 18 дней культивирования оно составляет 10 мг/г сухой массы. В местах, где питательная среда капает прямо на клетки, через 3 – 4 дня культивируемая ткань становится темной и отличается от остальной, которая у S. niger окрашена в светло-бежевый цвет. Клетки в зонах капания часто бывают более компактны, содержат больше алкалоидов. Если клетки изолировать из зон капания и поместить в чашки Петри с агаром, содержание алкалоидов падает, при возвращении в прежние условия культивирования вновь аккумулируются высокие количества метаболитов.
Кроме того, в клетки вводились предшественники вторичных метаболитов. Отмечено, что синтез капсацина клетками Capsicum frutencens увеличивается в тысячи раз при добавлении в среду 5 мл изокаприновой кислоты. При этом капсацин не накапливается внутри клеток, а секретируется в питательную среду. Установлено, что клетки, иммобилизованные на плоской основе, способны потреблять питательные вещества из среды, в том числе и кислород, имеют низкую скорость роста, каллусоподобное расположение, способны к тесному межклеточному контакту. В целом, они имеют более высокий уровень синтеза вторичных метаболитов.
Несмотря на эти преимущества, промышленное культивирование имеет существенный недостаток: горизонтальная конструкция аппарата создает неудобства при работе и требует большой площади. Эти недостатки устраняются в другой системе. Система колоночной культуры (рис. 14)

Рис. 14. Система культуры в колонке
В такой системе возрастает число клеток, на которые капает среда, что увеличивает “зону капания”, где происходит накопление больших количеств вторичных метаболитов.
Сосуд для культивирования из горизонтального превращается в вертикальный. В сосуде с питательной средой (1) 50 мл жидкой среды, которая под действием силы тяжести капает в вертикальную стеклянную колонку, содержащую иммобилизованные клетки (3). Среду собирают со дна колонки и вновь используют в цикле, перекачивая с помощью перистальтического насоса в резервуар со средой.
Как разместить клетки внутри колонки, чтобы капающая среда не спрессовала их в плотную массу на дне колонки? Закрепить в нейлоновую сеть, корзиночки, используя инертный, проницаемый и стабильный гель. Между корзиночками образуется воздушное пространство, сеточка структурирует гель, а клетки могут прорастать через корзиночки, контактируя друг с другом.
Подходящим материалом для размещения клеток оказались нейлоновые мочалки. Материал нетоксичен, легко режется, выдерживает автоклавирование. В качестве субстратов для погружения клеток используют агар и альгинат кальция.
Агар традиционно используется в работе с культурами клеток и тканей. 2% (масса к объему) раствор агара в дистиллированной воде автоклавируют при 1 атмосфере в течение 20 минут и охлаждают на водяной бане до 35 – 40оС. Клетки суспензионной культуры в стационарной фазе роста пропускают через сито с диаметром пор 1 мм и смешивают в пропорции 1:1 (V:V) с незастывшим агаром. Стерильные кусочки мочалки 2-3 * 1 * 1 см с помощью стерильного пинцета опускают в смесь клеток с агаром, а когда агар начинает застывать, помещают в стерильные колонки с внутренним диаметром 15 * 2,5 см. В каждую колонку помещают примерно 10 сеточек, таким образом, на колонку приходится 5 – 7 г сырой массы клеток.
Аналогично иммобилизуют клетки с использованием альгината кальция. В этом инертном субстрате, например, успешно были иммобилизованы А. Альферманном с сотрудниками клетки наперстянки шерстистой (Digitalis lanata). 2% раствор альгината натрия автоклавируют, охлаждают до комнатной температуры, смешивают с клетками и переносят в стерильный раствор 0,05 М CaCl2 в дистиллированной воде на 10 минут, чтобы образовывающийся альгинат кальция затвердел внутри и вокруг кусочков мочалки, обволакивая клетки. Молекулы альгината поперечно сшиваются катионами кальция, при этом происходит его стабилизация. Затвердевший материал трижды промывают в стерильной дистиллированной воде и вносят в стеклянные колонки.
Как показали дальнейшие исследования, рост клеток в альгинате был лучшим, чем в агаре, что связано, вероятно, с негативным действием расплавленного агара, температура которого составляет около 40оС, на клетки в процессе иммобилизации. Поэтому эксперименты по изменению условий окружающей среды проводились в колонках, где клетки Datura innoxia и Capsicum frutencens были иммобилизованы в альгинате кальция.
Скорость потребления ортофосфата, нитратов, аммония и сахарозы в клетках колоночной культуры ниже, чем в горизонтальной системе. Жизнеспособность клеток, по сравнению с суспензионными культурами, заметно не снижается (60 – 65%), содержание алкалоидов через 8 – 10 суток составляет 12 – 13 мг/г сухой массы клеток, алкалоиды в питательную среду не выделяются, а рН среды после 8 суток культивирования снижается на 0,4 единицы, до 5,4. Определение скорости потребления кислорода показывает предположительную нехватку его на 4 – 8 сутки культивирования.
Культуры, освещаемые люминесцентными лампами, потребляют питательные вещества интенсивнее, рост клеток лучше также в освещенных культурах. В светокультуре повышается жизнеспособность клеток и содержание алкалоидов. Так как клетки не зеленеют, для поддержания нормального клеточного метаболизма необходимы и другие световые эффекты.
Добавление предшественников не всегда однозначно влияет на рост, потребление питательных веществ и синтез метаболитов. Например, действие орнитина на клетки Datura innoxia скорее отрицательно, а изокаприновой кислоты на клетки Capsicum frutencens – скорее положительно, так как сырая масса увеличивается, но выход капсомицина остается прежним. В обоих случаях синтез метаболитов не ингибируется альгинатным гелем.
Полученные результаты свидетельствуют о сохранении жизнеспособности клеток многих видов растений при иммобилизации. Иммобилизованные клетки, полученные из рыхлых, быстро растущих суспензионных культур, замедляют рост и приобретают сходство с клетками каллусной культуры. Эти клетки более взаимосвязаны, чем в жидкой культуре, что ведет к возникновению определенного физического и химического градиентов.
Иммобилизованные клетки аккумулируют больше алкалоидов, чем в жидкой культуре, что ведет к возникновению определенных физических и химических градиентов. Это способствует переходу клеток в стационарную фазу, что приводит к ускорению образования алкалоидов и других веществ вторичного происхождения.
Общие рекомендации к культивированию клеток на основе полученных результатов.
1. Клетки должны выращиваться физически стационарно, в тесном контакте друг с другом, чтобы стимулировалось развитие физических и химических градиентов и обеспечивалась частичная дифференцировка культуры. Некоторые виды растений необходимо культивировать при освещении и индуцировать образование хлоропластов, чтобы обеспечить уровень метаболизма, близкий к происходящему в клетках интактного растения.
2. Состав питательной среды и уровень кислорода необходимо регулировать для замедления роста культуры. Рекомендуется использовать регуляторы роста для имитации процессов дифференциации, происходящих in vivo.
3. Клетки необходимо снабжать предшественниками, но в низких концентрациях. Предшественники должны быть максимально близки в цепочке превращений к исходному продукту.
4. Желательно использовать клетки, которые секретируют необходимые метаболиты в питательную среду или клетки, у которых такую секрецию можно индуцировать.
Дәріс № 19,20
Клеткалық биомассаны алу жəне оны бағалаудың техникалық регламентін жасау
Жоспар:
Экономикалык жағынан тиімді өсімдікті таңдап алу
Алынған биомассаның сандық және сапалық құрамын химиялық әдістер арқылы зерттеу
Үйлесімді қоректік орта мен өсіру жағдайларын іріктеу
4. Клеткалардың өнімді штаммдарын алу.
5. Ең жақсы өнімді штаммдарды сұйық қоректік ортада өсіру.
6. Клеткалық биомассаны алу және оны бағалаудың техникалық регламентін (іс тәртібін) жасау.
1. Экономикалык жағынан тиімді өсімдікті таңдап алу жасанды қоректік ортада өсіру үшін таңдап алынған өсімдіктердің құрамында айтарлықтай мөлшерде құнды, экономика жағынан тиімді қосымша заттар болу керек. Бұл келтірілген қағиданың әсіресе сирек немесе жойылып бара жатқан өсімдіктерге қатысы бар.
Ұлпаларды жасанды қоректік ортада өсіруге алғаш рет енгізу. Бұл максат үшін, құрамында ең көп мөлшерде ізделіп отырған заты бар жеке өсімдіктер таңдалынып алынады. Осының мысалы ретінде өз қызметкерлерімен бірге Ценк жасаған жұмысты келтіруге болады. Олар құрамында индол тектес алкалоидтар серпентин мен аймалициңді көп мөлшерде ұстайтын қызғылт қабыр шөпті /Саіһагапіиз гозеиз - барвишок розовый/ жасанды қоректік ортада өсіру үшін әр түрлі аймактарда өскен өсімдіктерден 184 тұқым үлгісін жинаған. Осы жиналып тұқымдардан өсіп шықкан өскіндерден тек кейбіреулері, құрамы жағынан алкалоидтарға байлары / кұрғак салмакка шаққанда 0,7 % кем емес/ ғана іріктелініп алынған, олардан каллус ұлпалары өсіріліп алынған. Әдетте, бастапқы каллус ұлпаларын қатты қоректік ортада өсіріп алады.
2. Алынған биомассаның сандық және сапалық құрамын химиялық әдістер арқылы зерттеу. Өсімдіктердің ретсіз өсіп көбейетін каллустық клеткалары косымша түзілетін қосылыстарды тек бір ерекше жағдайда болмаса, тұтас өсімдіктердің кор жинайтын мүшелеріне қарағанда кем ұстайды. Бұндай жағдай бүтін организмде қосымша түзілетін заттардың синтезі цитодифференцировканың бакылауында болатындығын көрсетеді. іп vitro өсетін клеткалардың дифференциялануының басынуы олардағы қосымша заттардың биосинтезделу мүмкіндігін төмендетеді. Клеткалардың генетикалық мүмкіндіктерін толық жүзеге асыра алмауы басқа себептерге байланысты болуы мүмкін. Мысалы, қоректенудің гетеротрофтык типіне кезінде, автотрофтық қоректенудің бұзылуынан. Бұдан басқа да факторлардың әсерінен өнімнің сапалық құрамы өзгеруі мүмкін. Кейбір өсімдіктерде қосымша заттардың биосинтезі олардағы өсу процессі бәсеңдегенде басталады, сондықтан оларды екі сатылы коректік ортада өсіру тәртібі қолданылады, бастапқы кезінде клетка массасының карқынды түрде өсуіне, одан кейін қосымша заттардың биосинтезделуіне жағдай жасалады.
3. Үйлесімді қоректік орта мен өсіру жағдайларын іріктеу.Қосымша заттар алмасуына қатысы бар генетикалық информацияларды толық жүзеге асыру үшін, арнайы жағдайлар жасалуы керек. Пайдаланылатын коректік орталар клеткаларға үйлесімді екеніне толық сенім болмағандықтан, әрбір нақты жағдайда коректік ортаны т.и. факторларды басқа зерттеушілердің тәжірибелеріне сүйене отырып таңдап алады. Бұл жұмыс іп vitro өскен клеткаларды сұйык ортаға ауыстырғанда бұрынғыдан да күрделене түседі, оның себебі сұйык, ортада аэрациялау және шайқап араластыру т.б. факторлардың әсерін ескеру керек.
Қоректік ортаның құрамына кіретін косындылардың ішінде қосымша метаболизмге әсер ететін негізгілері фитогормондарға жүктеледі. Бірақ фитогормондардың әсер етуі олардың түрше, түзетін заттың табиғатына, штаммға т.б. тәуелді, сондықтан фитогормондарды қолдану үшін дайын ереже болмайды. Фитогормондардың әсері жанама тілде клеткалардың дифференциялануы арқылы жүруі мүмкін, дегенмен іп vitro жағдайында өсу процесстері мен қосымша заттар түзілуінде арасында кандай да бір байланыстың болуы барлық уақытта байқала бермейді. Трофикалық факторлары ішінде қосымша түзілетін заттар биосинтезіне анық әсер ететін сахароза және сол қосылыстардың биосинтез жолындағы кейбір алғы заттары. Ұлпаларды ұзақ уақыт қоректік ортаның шектелген бір көлемінде өсіргенде, клеткалардың органикалық заттар синтездеу қабілеті томендейді, сол уакытта қоректік ортаға қосымша синтезделетін қосылыстардың алғы заттарын қосса, олар қосымша заттардың биосинтезіне әсер етеді деп, болжауға болады. Алғы заттар ретінде амин қышкылдарын / глутамин, фенилаланин, лейцин, орнитин т.б. / жеке органикалық қышқылдарды /ацетат, сукцинат, шиюім т.б./ қолданcа болады, Бірақ, каллустық ұлпалар олардың бәрін әр уақытта өз қажетіне жарата бермейді. Кейбір жағдайда қоректік ортаға алғы заттарды қосканмен одан жақсы нәтиже алына бермейді. Оны мынадай себептермен түсіндіруге болады: оларды клеткалар сіңірмейді, себебі, клеткалардың өзі синтездеуі мүмкін немесе қоректік ортаны дайындау, зарарсыздандыру барысында ыдырап кетуі, болмаса физиологиялық активтілігі жойып басқа формаға айналуы әбден мүмкін.
Әдебиеттерде қоректік ортаның минералды кошюненттеріпін және орта рН- ның кейбір жеке қосымша түзілетін өнімдердің мөлшеріне әсер ететіні туралы деректер бар. Физикалық факторлардың ішінен жарыкты, температураны, оттегінің, көмірқышқыл газының парциялдық қысымын келтіруге болады. Жарық әсерінің түрге ерекшелігі бар. Жасанды ортада өскен ұлпалардың кейбіреуінде бірқатар қосымша заттардын /алкалоидтар, гликозидтер, эфир майлары, флавоноидтар/ синтезі жарыкта ұлғайса, ал кейбіреулерінде төмендейді. Сонымен қатар, жарық соңғы өнімнің сапалық кұрамын да өзгерте алады. Жарықта және температурада қосымша түзілетін метаболиттердің кейбір ферменттеріне әсер ететін болу керек.
Жасанды ортада өскен ұлпаларда қосымша қосылыстардың синтезделу карқындылығын арттыру үшін, қолайсыз факторлардың әсерін қолдануға болады, Мысалы, аноксия, жоғары температура, ультракүлгін сәулесі т.б. Стресс факторлармен әсер етіп, косымша заттардың синтезделуінің реттелу механизмі жете зерттелмесе де, тәжірибе жүзінде қолданғанда іп vitro өскен клеткалардан алынатын өнімдердің мөлшерін арттыруға болады. Оіозкогеа йеішісіеа клеткаларын қалыпты жағдайда өсіргенде 22-26 күнде 70-80 мг/л сапогеншілер түзеді. Стресстік фактор /аноксия/ қолданғанда сапониндердің сондай мөлшері жасанды ортада өскен ұлпаларда 15-16 күнде пайда болды. Бүтін өсімдіктерде қосымша метаболизмнің реттелуі туралы іргелі білім болмағандықтан, іп vitro жағдайында қосымша түзілетін заттардың алмасуын реттеу қиын екені белгілі.
Rauvolfia serpentina мутант клеткалары және сапогенин қатарынан диасгенинді беретін Dioskorea deltoidea мутантты клеткалар линиясы фармацевтік өндіріс үшін өте құнды қосылыс диасгенинді мөлшері жағынан түтас өсімдіктің тамырындай шығарған.
4. Клеткалардың өнімді штаммдарын алу. Құрамыңда қосымша заттардың қандай болса да біреуі мол біркелкі клеткалар популяциясын шығару қиын және күрделі міндет, Себебі, клеткалар популяциясын ұзақ уақыт жасанды ортада өсіргенде, генетикалық өзгергіштікке ұшырайды, тіпті басында жалғыз жоғары өнімді клетканы клондау арқылы алынған болса да біраз уақыттан кейін, жеке клеткалар құнды қосылыстар синтездеу кабілетін жоюы да мүмкін. Клеткалардың түріне тән ерекше биосинтездерге қабілетін жоғары деңгейде ұстап тұру үшін, клеткаларды жасанды ортада өсіру жағдайларын үйлесімді жағдайға жеткізумен қатар, тағы баска жашна да күш салу керек, мысалы, генетикалық әрекеттер мен клеткалық сұрыптау жұмыстарын жүргізу керек. іп vitro өскен клеткаларды мутагендермен немесе кері метаболиттермен өңдегенде, биохимиялық мутанттар алыну мүмкіндігі бар. Мутагенезді және клеткалық деңгейдегі сұрыптауды колданып, Ресейдің өсімдіктер физиологиясы институтының ұлпаларды жасанды ортада өсіру және морфогенез лабораториясында кұрамында аритмияға қарсы қолданылатын алкалоид аймалинды 10 есе көп ұстайтын Каи^оі/Іа ьегрепііпа мутантты клеткалары және сапогенин қатарынан диасгенинді беретін Оіозсогеа йеііоійеа мутантты клеткалар линиясы іріктелініп алынған. Диоскорея клеткалары фармаценттік өндіріс үшін өте кұнды қосылыс диасгенинді мөлшері жағынан тұтас өсімдіктің тамырындай шығарған. Осы жұмыстарын әрі қарай жалғастырып, тәжірибелік мутагенезді және клондау әдістерін колданғанда, диоскореяның штаммы бұрынғыдан да өнімді көп беретін мутант клеткалар линияларын берген.
Қоректік ортада өскен клеткаларды метаболизмге зиянды заттармен, яғни антиметаболиттермен өндегенде, мысалы, ароматтық амин қышкылдарымен, клеткалардың көп бөлігі тіршілігін жояды. Осындай жағдайда тіршілігін сақтап қалған аз ғана клеткалар, метаболиттердің артық мөлшерін синтездеуге қабілетті болады. Осы жолмен сәбіз және картоп клеткаларының триптофанды өте көп мөлшерде синтездеуге қабілетті клондары, ал ақ үйеңкі /клеи белый/ клеткаларының фенилаланин мен тирозин өнімі көп беретін клондары алынған.
Іп vitro жағдайында өсірген клеткаларының неганде рентабельді кең масштабтары өндірісті ұйымдастыру үшін, гормондарға прототрофтық /қажет етпейтін/, қоректік орталарға талғамсыз, сонымен катар осмостық және механикалық стресстерге түраклы мутанттар қажет. Қазір клеткаларды жасанды орталарда өсіріп, мутанттар және олардың варианттарын алу кеңінен таралуда. Дегенмен өнімділігі мол штаммдар алудың ең тиімді жолы, клеткалық және гендік инженерия әдістерін қолданып жасанды түрде клеткаларды қолдан кұрастыру, оның болашағы өте зор.
5. Ең жақсы өнімді штаммдарды сұйық қоректік ортада өсіру. Бастапқыда қатты қоректік ортада алынған каллустық клеткалар сұйық қоректік ортаға ауыстырылады. Клеткаларды өсіру тәсілінің өзгеруі, штаммдардың ерекше қасиеттерінің өзгеруіне әкелмеу керек, яғни штаммдар жасанды орталарда өсіру кезінде болатын стресстерге тұракты болуы керек. Әсіресе бұл мәселеге, кішкене колбаларда лабораториялық тәжірибеде өсірген клеткаларды көлемі үлкен ферменттер ауыстырған кезде, ерекше көңіл аударған жөн.
Биомассаға тиімді химиялық бақылау жасау үшін, клеткалардың жағдайын бақылайтын экспресс әдістер қажет.
Өнімді және тұрақты штаммдарды өндіріс жағдайында ферментерлардың көлемін біртіндеп үлкейте отырып өсіру.
Егер, осындай жартылай өндіріс жағдайында өсірілетін клеткалар жоғары деңгейдегі өсу жылдамдығын дәне ізделіп отырған затты биосинтездеу қабілетін сақтап, оны жинақтап және қоршаған ортаға көп мөлшерде бөлетін болса, онда бұндай штамм ірі масштабта өндіріс ұйымдастыру үшін жарамды болады. Одан басқа, штаммның сапалығының маңызды көрсеткіштерінің бірі болып генетикалық тұрақтылығы саналады.
6. Клеткалық биомассаны алу және оны бағалаудың техникалық регламентін (іс тәртібін) жасау. Ол үшін аппаратура қажет, ондай аппаратура Жапония т.б. мемлекеттерде бар. Мысалы, Жапонияда ірі масштабта торғайшөптің клеткаларын жасанды ортада өсіріп , одан шиконин өндіру жолға қойылған. 20000 литрлік ферменттерде убихинон - 10 өнімін беретін темекі клеткалары ортаның үзілмейтін ағында 3 ай бойы өсірілген. Убихинон - 10-ның бір күндік өнімділігі 1 л. суспензияға шақканда 5,582 г. болған.
Қазіргі уақытта дүние жүзінің әр түрлі елдерінде экономика жағынан маңызды заттар өндіруге бағытталған биосинтездік өнеркәсібінде елуден астам өсімдіктер түрлерінің клеткалары қолдануда, олардың ішінде жень-шень, рауволъфия, оймак, гүл және дельта тәрізді диоскорея, торғайшөп, итжедек, алка, сасық мендуана, меруерттүл, агава, апиын т.б.
Бақылау сұрақтары
Экономикалык жағынан тиімді өсімдікті таңдап алу
Алынған биомассаның сандық және сапалық құрамын химиялық әдістер арқылы зерттеу
Үйлесімді қоректік орта мен өсіру жағдайларын іріктеу
4. Клеткалардың өнімді штаммдарын алу.
5. Ең жақсы өнімді штаммдарды сұйық қоректік ортада өсіру.
6. Клеткалық биомассаны алу және оны бағалаудың техникалық регламентін (іс тәртібін) жасау.
Дәріс №21,22
Өсімдіктерді клондық микрокөбейтудің əдістері
Жоспар:
Өсімдіктерді клоңдық микрокөбейту және оның артықшылығы
Клондық микрокөбейтудің әдістері.
Қолтық бүршіктердің меристемасының дамуын индумиялау
Тікелей эксплант клеткаларынан косалқы өркендердің және мүшелердің түзлуі
Стерильдік жағдайда қоректік ортаға отырғызылған әртүрлі маманданған ұлпалардың тірі клеткалары көбейуге қабілетті және қолайлы жағдай жасалса өзінің тотипотенттілігін толық жүзеге асырып, жаңа өсімдікке бастама бола алады. Жеке клеткалардың бастапқы өсімдіктердін барлық белгілері бар, тұтас организм жасауға қабілеті клондық көбейтуде табысты түрде пайдаланылуда.
Клондық микрокөбейту бұл ұлпалар мен клеткаларды жасанды ортада өсіріп, жыныссыз жолмен көп мөлшерде көбейту. Бұндай жағдайда пайда болған өсімдіктер генетикалық жағынан бастапқы өсімдікпен бірдей өсімдіктерді клон аркылы микрокобейтудің жетістіктері мен туындалған мәселелері, сонымен қатар осы сұракқа арналған ғылыми шолу Н.В. Катаева мен Р.Г.Бутенконың кітабында толық берілген. Авторлар өсімдіктерді көбейтудің дағдылы вегетативтік әдістерімен салыстырғанда клондық микрокобейтудің артықшылығын келтірген. 1/ Өсу коэффициентінің жоғарылығы. Бір гербери өсімдігінен дағдылы әдістерді қолдану арқылы жылына 50-100 өсімдік өсірілсе,ал ұлпаларды қоректік ортада көбейту арқылы 1 млн. өсімдік алуға болады; алманың бір жоғарғы бүршігінен 8 айдың ішінде 60 мың өскін алуға болады. 2/ Өсімдіктерді жыл бойы өсіруге болады: 3/ Әдіс өте тиімді және үнемді. іп vitro жағдайында кішірек лаборатория көлемінде мыңдаған өсімдік өсіруге болады. 4/ Өсімдіктерді көбейтумен қатар оларды вирустар мен патогендік микроорганизмдерден сауықтыру бірге жүретіндігі. 5/ Ұлпаларды іп уііго өсіру арқылы вегетативтік жолмен өте қиын немесе тіпті көбеймейтін өсімдіктерді, мысалы, пальманы көбейтуге болатындығы.
Осы келтірілген артықшылықтарына байланысты клондық микрокөбейту әдісін өсімдік өсіруде және селекцияда мынандай мақсаттарға қол жеткізу үшін пайдалануға болады: 1/ ауыл шаруашылығы дақылдарының белгілі сорттарын тез және нәтижелі түрде көбейту; 2/ көбею коэффициенті төмен құнды екпе және жабайы ағаштар тұқымдары дәндері арқылы көбейгенде ұрпактары белгілері бойынша ажырап кететін, ал дағдылы әдістер мен вегетативтік түрде көбейюі өте жай немесе тіпті көбейтілін өсімдіктерді көбейту; 3/ гетерозистік будан тұқым өндірісі үшін линияларды нәтижелі түрде алу және көбейту; 4/ вирустардан және патогендік микроорганизмдерден тазартылған, шаруашылык әсемдік дақылдардан көшет материалды алу және оларды аурулардан сақтау; 5/ кұнды таңдаулы өсімдіктерден генетикалық жағынан бірдей ұрпақ алу мақсатында көбейту, мысалы, гаплоидтық өсімдіктерді, клеткалық және гендік инженерия әдістері арқылы кұрастырылған бірлі-жарым өсімдіктерді көбейту; 6/ көп мөлшерде жасанды тұқым алу. Жасанды тұқым деп, даму кезеңдері бірдей жасанды қабықшалармен қапталған, эмбриоидтарды атайды. Қабықшалар эмбриондарды қолайсыз жағдайлардан берік қорғайды және ұзақ уақыт аралығында тіршілік қабілетін сақтауын камтамасыз етеді. Әзірше бұндай "тұқымдарды" лаборатория жағдайында аз мөлшерде алып, тек ғылыми- зерттеу және селекциялык жұмыстарда қолдануда. Биотехнология бұл "тұқымдардың" өте көп мөлшерде алынуын қамтамасыз етуі керек.
