
- •Часть III. Задачи по общей химии
- •Химическая термодинамика. Термохимия
- •Рассчитайте стандартную энтальпию реакции
- •В соответствии со следствием закона Гесса рассчитаем значение (реакции):
- •Химическая кинетика. Химическое равновесие
- •Напишите кинетические уравнения следующих реакций:
- •Установите, как изменится скорость химической реакции
- •Объясните, как влияет повышение температуры, давления и концентрации исходных веществ на экзотермическую реакцию синтеза аммиака из простых веществ.
- •В биологическом полимере (белке) имеет место следующее превращение:
- •Растворы
- •Раствор содержит 20 г глюкозы в 100 г воды.
- •Водный раствор одноатомного спирта, содержащий 0,874 г вещества в 100 мл воды, замерзает при температуре -0,354 оС.
- •Осмотическое давление раствора объемом 250 мл, в котором содержится 20 г гемоглобина, равно 2855 Па (при 4 оСили 277 к).
- •Водный раствор NaOh кипит при температуре 102,65 оС. Кажущаяся степень ионизации электролита равна 70%.
- •Раствор, содержащий 2,1 г кон в 250 мл воды, замерзает при -0,514 оС.
- •Осмотическое давление 0,5 м раствора карбоната калия равно 2726 кПа при 0 оС.
- •Буферные системы
- •В состав крови входит буферная система, состоящая из двух анионов.
- •Аммиачная буферная система состоит из двух составных частей.
- •В 200 мл фосфатного буферного раствора содержится 0,8 моль кислотного компонента (н2ро4- ) и 1,6 моль солевого компонента (нро42–).
Аммиачная буферная система состоит из двух составных частей.
Классифицируйте её по составу и природе компонентов.
Укажите интервал значений рН, внутри которого эта система обладает буферной емкостью.
Напишите уравнения реакций, отражающих механизм её действия (ионная форма).
Объясните, почему аммиачная буферная система не входит в состав крови.
Решение
1.Состав и природа компонентов:
А)NН4ОН (NН3 х Н2О)-гидроксид аммония, слабый электролит
Б) NН4С1 – соль, хлорид аммония, сильный электролит.
Гидроксид аммония - слабый электролит, в растворе частично диссоциирует на ионы:
NН4ОН <=> NН4+ + ОН-
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы:
NН4С1 > NН4+ + С1-
и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции.
Интервал значений рН, внутри которого рассматриваемая система обладает буферной емкостью,рассчитывается по формуле:
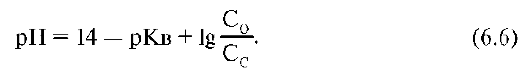 ,
,
где Кв – константа диссоциации NН4ОН=1,8*10-5, С0-концентрация основания, Сс-концентрация соли.
рН=14-4,74+lg(C0/Cc)=9,26+lg(C0/Cc). В зависимости от соотношения C0/Cc интервал значений рН составляет 8,26-10,26.
Способность аммиачного буфера поддерживать практически постоянное значение рН раствора основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При добавлении к аммиачной буферной смеси сильной кислоты, ионы Н+ будут связываться молекулами или гидроксида аммония, а не увеличивать концентрацию ионов Н+ и уменьшать рН раствора:
NH4OH+H+=NH4++H2O
При добавлении щелочи ионы ОН - будут связывать ионы NН4+, образуя при этом малодиссоциированное соединение, а не увеличивать рН раствора:
NH4++ОН-= NH4OH
Аммиачная буферная система не входит в состав крови, поскольку интервал значений рН, внутри которого она будет обладать буферной емкостью, находится в щелочной области (рН больше 8). Нормальное значение рН плазмы крови составляет 7,40 ± 0,05, т.е ниже области буферирования.
В 200 мл фосфатного буферного раствора содержится 0,8 моль кислотного компонента (н2ро4- ) и 1,6 моль солевого компонента (нро42–).
Установите рН буферного раствора.
Объясните, входит ли рассчитанное значение рН в ЗБД (рН: 6,2 – 8,2).
Ки (Н2РО4-) = 6,210-8 моль/л; lg 2 = 0,3; lg 6,2 = 0,79.
Классифицируйте буферную систему по составу и природе компонентов.
Решение.
Подставим данные задачи в формулу для расчета рН фосфатного буфера:
 =-lg(6,210-8)
+lg(1,6/0,8)=7,51
=-lg(6,210-8)
+lg(1,6/0,8)=7,51
Рассчитанное значение рН входит в зону буферного действия( ЗБД) рН: 6,2 – 8,2
Фосфатная буферная система является кислотно-основной буферной системой, образованной анионами двух кислых солей
