
- •Часть III. Задачи по общей химии
- •Химическая термодинамика. Термохимия
- •Рассчитайте стандартную энтальпию реакции
- •В соответствии со следствием закона Гесса рассчитаем значение (реакции):
- •Химическая кинетика. Химическое равновесие
- •Напишите кинетические уравнения следующих реакций:
- •Установите, как изменится скорость химической реакции
- •Объясните, как влияет повышение температуры, давления и концентрации исходных веществ на экзотермическую реакцию синтеза аммиака из простых веществ.
- •В биологическом полимере (белке) имеет место следующее превращение:
- •Растворы
- •Раствор содержит 20 г глюкозы в 100 г воды.
- •Водный раствор одноатомного спирта, содержащий 0,874 г вещества в 100 мл воды, замерзает при температуре -0,354 оС.
- •Осмотическое давление раствора объемом 250 мл, в котором содержится 20 г гемоглобина, равно 2855 Па (при 4 оСили 277 к).
- •Водный раствор NaOh кипит при температуре 102,65 оС. Кажущаяся степень ионизации электролита равна 70%.
- •Раствор, содержащий 2,1 г кон в 250 мл воды, замерзает при -0,514 оС.
- •Осмотическое давление 0,5 м раствора карбоната калия равно 2726 кПа при 0 оС.
- •Буферные системы
- •В состав крови входит буферная система, состоящая из двух анионов.
- •Аммиачная буферная система состоит из двух составных частей.
- •В 200 мл фосфатного буферного раствора содержится 0,8 моль кислотного компонента (н2ро4- ) и 1,6 моль солевого компонента (нро42–).
Растворы
Раствор содержит 20 г глюкозы в 100 г воды.
Вычислите давление насыщенного пара растворителя над раствором при температуре 15 оС, если давление пара чистой воды при этой же температуре равно 23,75 мм рт. ст.
Рассчитайте молярную долю растворителя.
Решение
Рассчитаем молярные доли растворенного вещества и растворителя:
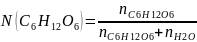 ,
,
Где
 -количество
вещества глюкозы, рассчитывается по
формуле:
-количество
вещества глюкозы, рассчитывается по
формуле:
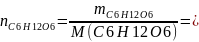 20/180=0,11
моль
20/180=0,11
моль
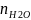 -
количество вещества воды, рассчитывается
по формуле
-
количество вещества воды, рассчитывается
по формуле
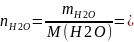 100/18=5,56
моль.
100/18=5,56
моль.
Тогда =0,11/(0,11+5,56)=0,02.
1.2.Молярную
долю растворителя,
 ,
рассчитаем на основании соотношения:
,
рассчитаем на основании соотношения:
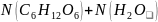 =1,
=1,
тогда
=1-
Согласно закону Рауля, давление насыщенного пара растворителя над раствором пропорционально молярной доле растворителя:
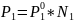 ,
,
где
 -
давление пара чистого растворителя
(воды),
-
давление пара чистого растворителя
(воды),
 - мольная доля чистого растворителя
(воды). Подставляя данные задачи и
расчетов, получаем:
- мольная доля чистого растворителя
(воды). Подставляя данные задачи и
расчетов, получаем:
 =23,75*0,98=23,275
мм рт.ст.
=23,75*0,98=23,275
мм рт.ст.
Водный раствор одноатомного спирта, содержащий 0,874 г вещества в 100 мл воды, замерзает при температуре -0,354 оС.
Рассчитайте относительную молекулярную массу спирта и установите его формулу.
Решение.
Согласно закону Рауля понижение температуры кристаллизации раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества:
ΔТзам.= Тзам (растворителя)- Тзам (раствора)=KСm (1)
где Сm– моляльная концентрация раствора; К – криоскопическая постоянная. Для воды К=1,86° .
В соответствии с условием задачи ΔТзам.=0 оС-(-0,354 оС)=0,354 оС.
Из выражения (1) найдем моляльную концентрацию растворенного вещества:
Сm= ΔТзам/К=0,354/1,86=0,19 моль/кг
3.Согласно определению для моляльной концентрации:
 ,
,
Отсюда
 =0,874/(0,19*0,1)=46
г/моль
=0,874/(0,19*0,1)=46
г/моль
Общая формула предельных одноатомных спиртов –СnH2n+1OH. ., тогда молярную массу спирта можно выразить следующим образом:
М(R-OH)=14n+18=46, 14n=28, n =2. Следовательно, формула спирта – С2H5OH- этанол.
Осмотическое давление раствора объемом 250 мл, в котором содержится 20 г гемоглобина, равно 2855 Па (при 4 оСили 277 к).
Установите молярную массу гемоглобина.
Решение.
Согласно закону Вант-Гоффа осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества:
Росм=1000*R*T*См, па (1).
Из выражения (1) найдем величину См:
См= Росм/(1000*R*T)=2855/(1000*8,314*277)=0,00124 моль/л
Согласно определению молярная концентрация находится по формуле(2):

,
отсюда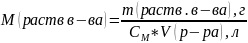 =20/(0,00124*0,25)=64516
г/моль.
=20/(0,00124*0,25)=64516
г/моль.
Водный раствор NaOh кипит при температуре 102,65 оС. Кажущаяся степень ионизации электролита равна 70%.
Определите массу NaOH, растворённую в 100 г воды.
Решение
Согласно закону Рауля повышение температуры кипения раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества. Для растворов электролитов закон Рауля выглядит следующим образом (1):
ΔТкип. = i*Кэ*Сm, ( 1)
где i – поправочный изотонический коэффициент, Кэ – эбуллиоскопическая постоянная растворителя; для воды Кэ =0,52°; Сm –моляльная концентрация раствора; ΔТкип. = Ткип р-ра – Ткип.р-рителя. Согласно условию задачи ΔТкип=2,65°
Найдем величину i:
i=1+α(n-1),
где α- кажущаяся степень ионизации электролита, согласно условию равна 0,7
n – количество ионов, на которые распадается в растворе 1 молекула электролита:
NaOH=Na++OH-
Т.О., для гидроксида натрия n=2. Тогда :
i=1+α(n-1)=1+0,7*(2-1)=1,7
Из выражения (1) найдем величину Сm :
Сm= ΔТкип/( i*Кэ)=2,65/(1,7*0,52)=3 моль/кг
Масса NaOH, растворённая в 100 г воды, определяется по формуле (2):
m(NaOH)= Сm*M(NaOH)*100/1000 (2),
где M(NaOH)=40 г/моль.
Подставляя результаты расчетов в формулу (2), получаем:
m(NaOH)=3*40*100/1000=12 г

