
- •Часть III. Задачи по общей химии
- •Химическая термодинамика. Термохимия
- •Рассчитайте стандартную энтальпию реакции
- •В соответствии со следствием закона Гесса рассчитаем значение (реакции):
- •Химическая кинетика. Химическое равновесие
- •Напишите кинетические уравнения следующих реакций:
- •Установите, как изменится скорость химической реакции
- •Объясните, как влияет повышение температуры, давления и концентрации исходных веществ на экзотермическую реакцию синтеза аммиака из простых веществ.
- •В биологическом полимере (белке) имеет место следующее превращение:
- •Растворы
- •Раствор содержит 20 г глюкозы в 100 г воды.
- •Водный раствор одноатомного спирта, содержащий 0,874 г вещества в 100 мл воды, замерзает при температуре -0,354 оС.
- •Осмотическое давление раствора объемом 250 мл, в котором содержится 20 г гемоглобина, равно 2855 Па (при 4 оСили 277 к).
- •Водный раствор NaOh кипит при температуре 102,65 оС. Кажущаяся степень ионизации электролита равна 70%.
- •Раствор, содержащий 2,1 г кон в 250 мл воды, замерзает при -0,514 оС.
- •Осмотическое давление 0,5 м раствора карбоната калия равно 2726 кПа при 0 оС.
- •Буферные системы
- •В состав крови входит буферная система, состоящая из двух анионов.
- •Аммиачная буферная система состоит из двух составных частей.
- •В 200 мл фосфатного буферного раствора содержится 0,8 моль кислотного компонента (н2ро4- ) и 1,6 моль солевого компонента (нро42–).
Часть III. Задачи по общей химии
Химическая термодинамика. Термохимия
Рассчитайте стандартную энтальпию реакции
2AgNO3(т) → 2Ag(т) + 2NO2(г) + О2(г), если
Нообр(AgNO3) = -124 кДж/моль;
Нообр(NO2) = +33 кДж/моль.
Классифицируйте реакцию по знаку теплового эффекта.
Решение.
1.В
соответствии со следствием закона Гесса
рассчитаем значение
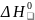 (реакции):
(реакции):
(реакции)=( =(2*0+2*33)-2*(-124)=314
кДж
=(2*0+2*33)-2*(-124)=314
кДж
.2. Так как (реакции)>0, данная реакция является эндотермической, протекает с поглощением тепла.
Рассчитайте S процесса 2N2(г) + O2(г) = 2N2O(г), если
Sо (N2,г) = 200 Дж/моль·К;
Sо (O2,г) = 205 Дж/моль·К;
Sо (N2O,г) = 219,9 Дж/моль·К.
Предскажите знак Sо процесса путём анализа уравнения химической реакции.
Решение.
В соответствии со следствием закона Гесса рассчитаем значение (реакции):
(реакции)= =
=
=2*219,9-(2*200+1*205)=-165,2дж/К
Согласно стехиометрии уравнения синтеза оксида азота(I) реакция протекает с уменьшением объема системы. Если в реакцию вступало три моля газов, то получено только два моля. Уменьшение объема системы всегда сопровождается уменьшением энтропии системы, что и показывают расчеты: (реакции)<0.
Определите Gо298 реакции Fe3O4 + 4CO = 3Fe + 4CO2, если:
Gо298 (Fe3O4) = -1014 кДж/моль,
Gо298 (CO) = - 137,2 кДж/моль,
Gо298 (CO2) = -394 кДж/моль.
Установите возможность самопроизвольного протекания процесса в стандартных условиях.
Решение.
1.В
соответствии со следствием закона Гесса
рассчитаем изменение изобарно-изотермического
потенциала
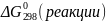
 (реакции)=(
(реакции)=( =(3*0+4*(-394))-(1*(-1014)+4*(-137,2))=-13,2
кДж
=(3*0+4*(-394))-(1*(-1014)+4*(-137,2))=-13,2
кДж
2.Так как значение <0, рассматриваемый процесс может протекать самопроизвольно в стандартных условиях.
Химическая кинетика. Химическое равновесие
Напишите кинетические уравнения следующих реакций:
а) С + О2 = СО2
б) 2NOCl(г) = 2NO(г) + Cl2(г)
в) C12H22O11 + H2O = 2C6H12O6
г) 2NO + H2 = N2O + H2O.
Объясните причину несовпадения молекулярности и порядка реакции.
Решение.
Кинетические уравнения отражают взаимосвязь между концентрациями исходных веществ, находящихся в одной фазе, и скоростью реакции. Теоретической основой для написания кинетических уравнений является закон действующих масс (ЗДМ), согласно которому скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, в степенях, равных их стехиометрическим коэффициентам. В соответствии с ЗДМ кинетические уравнения рассматриваемых реакций выглядят следующим образом:
А) С + О2 = СО2
V=k*C(O2), где V – скорость реакции, k – константа скорости реакции, C(O2) – концентрация кислорода, моль/л
Б) 2NOCl(г) = 2NO(г) + Cl2(г)
V=k*C(NOCl)2, где V – скорость реакции, k – константа скорости реакции, C(NOCl) – концентрация NOCl, моль/л
В) C12H22O11 + H2O = 2C6H12O6
V=k*C(C12H22O11)*C(H2O), где V – скорость реакции, k – константа скорости гидролиза сахарозы C12H22O11, C(C12H22O11) – концентрация сахарозы в водном растворе ,моль/л, С (Н2О) –концентрация воды, моль/л.
Г) 2NO + H2 = N2O + H2O.
V=k*C(NO)2*C(H2), где V – скорость реакции, k – константа скорости, C(NO) – концентрацияNO,моль/л, С (Н2) –концентрация водорода, моль/л.
Причина несовпадения молекулярности и порядка реакции
Молекулярность реакции определяется числом частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) реакции и превращающихся в продукты.
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Основными причинами несовпадения молекулярности и порядка реакции могут являться: простое несовпадение ( поскольку молекулярность- характеризует механизм, а порядок - кинетику реакции), наличие избытка одного из исходных веществ, гетерогенность реакции, ее ступенчатый характер.
