
- •Концентрация ионов водорода в крови больного равняется 2,46∙10-8 моль/л.
- •Определите заряд комплексообразователя и его координационное число в комплексном ионе [Fe(c2o4)2(oh)2]3-.
- •Напишите формулу комплексного соединения, имеющего название: хлорид гексаамминхрома (III).
- •Выражение константы нестойкости:
- •4. Выражение константы нестойкости:
- •Напишите коллоидно-химические формулы мицелл золей полученных по реакциям:
- •Имеются 3 коллоидных раствора: гидроксида железа (III), полученного гидролизом FeCl3, иодида серебра, полученного в избытке кi, и иодида серебра, полученного в избытке AgNo3.
- •Пороговая концентрация коллоидного раствора гидроксида алюминия равняется 0,63 ммоль/л.
- •Иэт альбумина плазмы крови равна 4,64.
- •Часть IV. Упражнения по биоорганической химии
- •Сопряжение. Ароматичность. Электронные эффекты заместителей
- •Объясните, в каком соединении – хлорбензоле или бензилхлориде (фенилхлорметане) – галоген является частью сопряженной системы.
- •Решение
- •Укажите вид и знак электронных эффектов в этиламине (этанамине) и п-аминобензойной (4-аминобензойной) кислоте.
- •Кислотность и основность органических соединений
- •Расположите в порядке уменьшения кислотности этанол, этиленгликоль (этандиол-1,2), глицерин (пропантриол-1, 2, 3).
- •Расположите в порядке уменьшения основности анилин, этанамин (этиламин), 3-аминофенол.
- •Реакции электрофильного характера
- •Напишите схему реакции гидратации пропена (пропилена).
- •Напишите схему реакции бромирования анилина.
- •Напишите схему реакции бромирования бензойной кислоты (катализатор FеBr3).
- •Напишите схемы реакций алкилирования бензола третичным изобутанолом и пропеном в кислой среде.
- •Реакции нуклеофильного характера
- •Напишите схему реакции взаимодействия 1-бромпропана с этилатом натрия.
Концентрация ионов водорода в крови больного равняется 2,46∙10-8 моль/л.
Рассчитайте рН крови (lg 2,46 = 0,39).
Назовите состояние, возникающее при данном нарушении КОС.
Укажите, чем характеризуется это состояние с точки зрения протолитического гомеостаза.
Решение
рН =-lg(CH+)=-lg(2,46∙10-8)=7,61
При данном нарушении КОС (рН> 7,4) возникает алкалоз
Под протолитическим гомеостазом принято понимать относительное постоянство соотношения кислота-основание внутренней среды живого организма. С точки зрения протолитического гомеостаза алкалоз - увеличение рН в крови (и других тканях организма) за счёт накопления щелочных веществ. Алкалоз может возникать вследствие гипервентиляции лёгких, приводящей к избыточному выведению СО2 из организма, вследствие больших потерь кислого желудочного сока при желудочных свищах, при длительном приёме диуретиков, при избыточном введении бикарбоната натрия с целью коррекции метаболического ацидоза или нейтрализации повышенной кислотности желудочного сока. При алкалозе уменьшается мозговой и коронарный кровоток, снижаются артериальное давление и минутный объем крови. Возрастает нервно-мышечная возбудимость, возникает мышечный гипертонус вплоть до развития судорог и тетании. Нередко наблюдается угнетение моторики кишечника и развитие запоров; снижается активность дыхательного центра. Для алкалоза характерно снижение умственной работоспособности, головокружение, могут возникать обморочные состояния.
Комплексные соединения
Определите заряд комплексообразователя и его координационное число в комплексном ионе [Fe(c2o4)2(oh)2]3-.
Изобразите графически его структурную формулу.
Классифицируйте этот ион по природе лигандов.
Напишите выражение константы нестойкости.
Решение
Пусть заряд иона-комплексообразователя Fe =(Х+). Заряды лигандов равны: (C2O4)2-, (OH)-. Составим уравнение баланса зарядов:
1* (+Х) +2*(-2) +2*(-1) =-3.
Х-4-2+3=0, х=+3
Т.О. заряд комплексообразователя: Fe+3
Координационное число -число связей, образованных комплексообразователем, с лигандами. В данном ионе к.ч. железа равно 6, т.к. 4 связи железо образует с двумя двухвалентными группами C2O4 и две связи – с двумя одновалентными группами ОН)
Структурная формула комплексного иона:
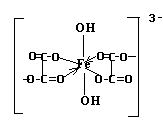
Данный ион содержит различные по природе лиганды: оксалат – ион и нидроксид – ион. Т.о. комплексный ион является ацидокомплексом (за счет оксалатов – кислотных остатков щавелевой кислоты) и гидроксокомплексом ( за счет гидроксильных групп).
Выражение константы нестойкости:
[Fe(C2O4)2(OH)2]3- ↔ Fe3+ + 2 C2O42- + 2 OH -
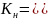
Напишите формулу комплексного соединения, имеющего название: хлорид гексаамминхрома (III).
Изобразите графически структурную формулу внутренней сферы.
Классифицируйте соединение по заряду комплексной частицы, по электропроводности, по природе ионов внешней сферы и по природе лигандов.
Рассчитайте координационное число комплексообразователя.
Напишите выражение константы нестойкости.
Решение
Хлорид гексаамминхрома (III) имеет молекулярную формулу:
[Cr(NH3)6]Cl3
Cтруктурная формула внутренней сферы:
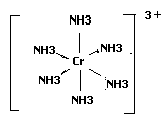
По заряду комплексной частицы хлорид гексаамминхрома является катионным комплексом; по электропроводности –сильным электролитом, по природе ионов внешней сферы-хлоридом, по природе лигандов –аммиакатом
Координационное число комплексообразователя равно 6
