
- •Тканевое дыхание. Атф как макроэргическое соединение. Цикл атф-адф. Виды фосфорилирования как реакции образования атф.
- •Окис-е фосф-е: сущноть процесса, обобщённая схема. Строение митохондрий и локализация в них компонентов окислительного фосфорилирования.
- •Убихинол-дегидрогеназа (цитохром с-редуктаза). Цитохром с-оксидаза. Особенности состава, строения, функций. Компоненты дыхательной цепи митохондрий.
- •Трансмембранный электрохимический потенциал как промежуточная форма энергии при окислительном фосфорилировании. Н- атф- синтаза: биологическая роль, локализация, строение, механизм синтеза атф.
- •Окислительное декарбоксилирование пировиноградной кислоты: биологическое значение, последовательность реакций. Механизмы регуляции скорости.
- •Пируватдегидрогеназный комплекс животных. Строение, коферменты активных центров, тонкий механизм катаболизма.
- •Анаболитическая функция общего пути катаболизма.
- •Энергетическая функция опк. Гипоэнергетические состояния. Причины развития гипоксии.
- •Углеводы. Определение. Особенности химического состава и строения углеводов. Классификация углеводов по химической структуре.
- •Биологические функции углеводов. Соответствие химической структуры этих соединений выполняемым функциям
- •Переваривание и всасывание углеводов в желудочно-кишечном тракте человека. Ферменты, принимающие участие в этих процессах.
- •Аллостерическая регуляция гликолиза и глюконеогеза в печени. Субстратные циклы.
- •Гормональная регуляция гликолиза, глюконеогенеза и обмена гликогена. Взаимосвязь с ритмом питания.
- •Пути образования и утилизации лактата в печени и мышцах. Лактатдегидрогеназа. Цикл Кори.
- •Пентозофосфатный путь превращения глюкозы. Биологическая функция. Схема процесса лимитирующая реакция. Окислительный и неокислительный этапы, Обратимость неокислительной стадии.
- •Нарушение углеводного обмена. Гипо- и гепергликемия. Инсулин и углеводный обмен, сахарный диабет.
Окислительное декарбоксилирование пировиноградной кислоты: биологическое значение, последовательность реакций. Механизмы регуляции скорости.
Стадия I. пируват соединяется с ТДФ в составе Е1 и подвергается декарбоксилированию.
Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2
Стадия II. Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты (рис. 6-21).
Стадия III. На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2 (рис. 6-23).
Стадия IV. На стадии IV дигидролипоилде-гидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD - простетическую группу фермента Е3.
Стадия V . На стадии V восстановленный FADH2 передаёт водород на NAD+ с образованием NADH.
Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции.
Окислительное декарбоксилирование пирувата сопровождается образованием NADH, поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфорилирования.
Так как отношения ДДФ/АТФ и NADH/NAD+ в клетке относительно постоянны, ускорение утилизации АТФ приводит к повышению концентрации АДФ и ускорению окисления NADH в дыхательной цепи. Повышение концентрации NAD+, в свою очередь, стимулирует окислительное декарбоксилирование пирувата.
Пируватдегидрогеназный комплекс животных. Строение, коферменты активных центров, тонкий механизм катаболизма.
Образование ацетил-КоА из пирувата - необратимый ключевой этап метаболизма. Животные не способны к превращению ацетил-КоА в глюкозу. Активность регулируется:
Ковалентная модификация ПДК осуществляется фосфорилированием и дефосфорилированием. В состав ПДК входят 2 регуляторных субъединицы. Киназа ПДК, фосфорилирует ПДК. Фосфатаза, дефосфорилирует фермент, превращая его в активную форму.
При повышении концентрации АДФ ПДК находится в нефосфорилированной активной форме. Этот эффект усиливается в некоторых клетках при повышении концентрации внутриклеточного Са2+, который активирует фосфатазу ПДК.
Продукты пируватдегидрогеназной реакции (ацетил-КоА и NADH) аллостерически активируют киназу ПДК. Активированная киназа фос-форилирует и инактивирует ПДК.
Пируват аллостерически активирует нефосфорилированную форму ПДК, действуя согласованно с другими субстратами - NAD+ и КоА. Активация ПДК происходит также под влиянием инсулина. В клетках миокарда ПДК активируется адреналином, однако это влияние адреналина не связано с изменением концентрации цАМФ.
Цикл Лимонной кислоты: биологическая роль, последовательность реакций, характеристика ферментов.
Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК) - заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил- КоА окисляется до 2 молекул СО2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ.
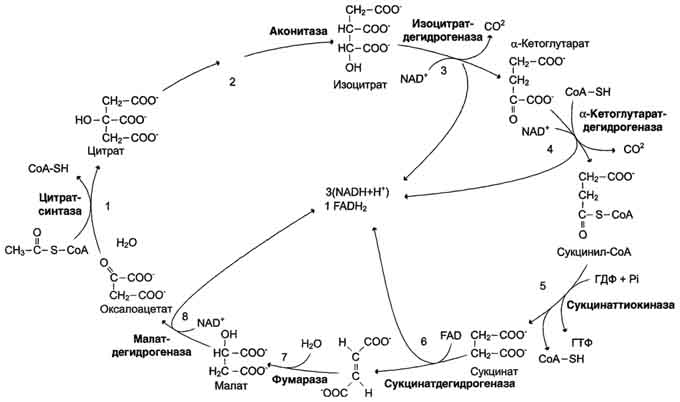
2.Превращение цитрата в изоцитрат
Обратимая. Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции. Однако это соединение не обнаруживается в свободном виде, так как не отделяется от активного центра фермента до завершения реакции.
3.Окислительное декарбоксилирование изоцитрата
Эту реакцию катализирует изоцитратдегидрогеназа. Существуют 2 формы изоцитратдегидрогеназы: одна содержит в качестве коферментa NAD+, вторая - NADP+. NAD-зависимый фермент. Самая медленная реакция цитратного цикла. АДФ - аллостерический активатор фермента.
4. α-кетоглутаратдегидрогеназный комплекс, он состоит из 3 ферментов: α-кетоглутаратдекарбоксилазы, дигидролипоилтранссукцинилазы и дигидролипоилдегидрогеназы. Кроме того, в этот ферментный комплекс входят 5 коферментов: тиаминдифосфат, кофермент А, липоевая кислота, NAD+ и FAD.
5. Превращение сукцинил-КоА в сукцинат
Сукцинил-КоА - высокоэнергетическое соединение ΔG0'= -35,7 кДж/моль. сопряжён с реакцией фосфорилирования гуанозиндифосфата (ГДФ) до гуанозинтрифосфата (ГТФ).
ГТФ + АДФ ↔ ГДФ + АТФ.
6. Дегидрирование сукцината
Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железо-серные центры; одна - Fe2S2, a другая - Fe4S4. В железо-серных центрах атомы железа меняют свою валентность, участвуя в транспорте электронов.
7.Образование малата из фумарата
Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только транс-формы фумарата.
8.Дегидрирование малата
В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоа-цетата Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий.
Ключевые реакции лимонной кислоты. Механизмы регуляции скорости цикла лимонной кислоты.
Образованием оксалоацетата завершается один оборот цитратного цикла. В одном обороте цикла лимонной кислоты в 2 реакциях декарбоксилирования (превращение изоцитрата в а-кетоглутарат и ос-кетоглутарата в сукцинил-КоА) происходит образование 2 молекул СО2. В 4 реакциях цитратного цикла происходит дегидрирование с образованием восстановленных коферментов: 3 молекул NADH+H+ и 1 молекулы FADH2. B составе сукцинатдегидрогеназы.
Наконец, на один оборот цикла затрачивается 2 молекулы воды: одна - на стадии образования цитрата, вторая - на стадии гидратации фумарата.
В ЦТК важнейшая регуляторная реакция - образование цитрата из оксалоацетата и ацетил-КоА, катализируемая цитратсинтазой. ускоряется при повышении концентрации оксалоацетата - и тормозится продуктом реакции - цитратом. Когда отношение NADH/NAD+ снижается, скорость окисления маната в оксалоацетат возрастает. Повышение концентрации оксалоацетата ускоряет цитратсинтазную реакцию. Скорость реакции снижается при повышении концентрации АТФ, сукцинил-КоА и длинноцепочечных жирных кислот.
Изоцитратдегидрогеназа, присоединение изоцитрата увеличивая скорость присоединения субстрата. Увеличение активности изоцитратдегидрогеназы снижает концентрацию цитрата, что, в свою очередь, уменьшает ингибирование цитратсинтазы продуктом реакции. При повышении концентрации NADH активность фермента снижается.
α-Кетоглутаратдегидрогеназный комплекс, не имеет в своём составе регуляторных субъединиц. Главный механизм - ингибирование реакции NADH и сукцинил-КоА.
α-Кетоглутаратдегидрогеназный комплекс, как и Изоцитратдегидрогеназа, активируется Са2+, а при повышении концентрации АТФ скорости обеих реакций снижаются.
