
- •Причины фракционирования стабильных изотопов. Типы изотопных эффектов. Основные факторы опрелеляющие величину фракционирования изотопов.
- •Методы выражения изотопных эффектов.
- •Принципы изотопной термометрии.
- •Фракционирование изотопов кислорода и водорода. Глобальная система вода-водяной пар – лед.
- •Закономерности фракционирования изотопов водорода и кислорода в воде в поверхностных и грунтовых водах. Исследование изменений глобальной температуры по образцам ледников.
- •Основные факторы фракционирования изотопов углерода, азота и серы во внешней оболочке Земли
- •Изотопный состав углерода и кислорода в мантии Земли.
- •Изотопный состав азота, серы и лития в различных природных объектах.
- •Роль геохимии стабильных изотопов химических элементов при реконструкции протовещества Земли по имеющейся коллекции метеоритов.
- •Причины разработки локальных методов u-Pb датирования. Основные принципы и стандарты для реализации методов sims и la-icpms, сравнение методик.
- •Цирконометрия как подраздел геохронологии. Методы изучения внутреннего строения минералов. Основные типы зональности в цирконах.
- •Определение генезиса циркона по величине концентрации урана и отношению Th/u. Типичные спектры рзэ в различных спектрах цирконов.
Геохимия стабильных изотопов.
Причины фракционирования стабильных изотопов. Типы изотопных эффектов. Основные факторы опрелеляющие величину фракционирования изотопов.
Изотопы–это атомы химическихэлементов, отличающиеся количеством нейтронов в ядре.
Стабильные изотопы химических элементов могут существовать сколь угодно долго, они не испытывают радиоактивного распада. Стабильными являются те изотопы химического элемента, у которых примерно равное количество протонов и нейтронов в ядре. Например, у углерода известно всего15 изотопов, из них13 радиоактивных изотопов углерода (от 8C до 22C), и 2 стабильных изотопа: 12C (98,93%) и 13C (1,07 %). Процесс разделения изотопов называется изотопным фракционированием
Поскольку стабильные изотопы химического элемента отличаются только массой, то закономерности изменения изотопного состава определяются следующими факторами:
Должно быть по меньшей мере две фазы, содержащие конкретный химический элемент, между которыми и может осуществляться изотопный обмен, что приводит к разному изотопному составу данного химического элемента в разных фазах . Например жидкая и газообразная вода: в жидкой фазе молекулы воды обогащены тяжелыми изотопами водорода и кислорода по сравнению с сосуществующим водяным паром.
Эффекты изотопного фракционирования зависят от относительной разницы масс изотопов, она наибольшая у водорода –50%, у кислорода–11.5%. у умеренно тяжелых металлов (Fe, Cu, Ni и др.), -менее1%.Поэтому, при прочих равных условиях эффекты фракционирования изотопов для легких химических элементов сильнее, чем для тяжелых.
Типы изотопных эффектов
Кинетический-процесс зависит от времени
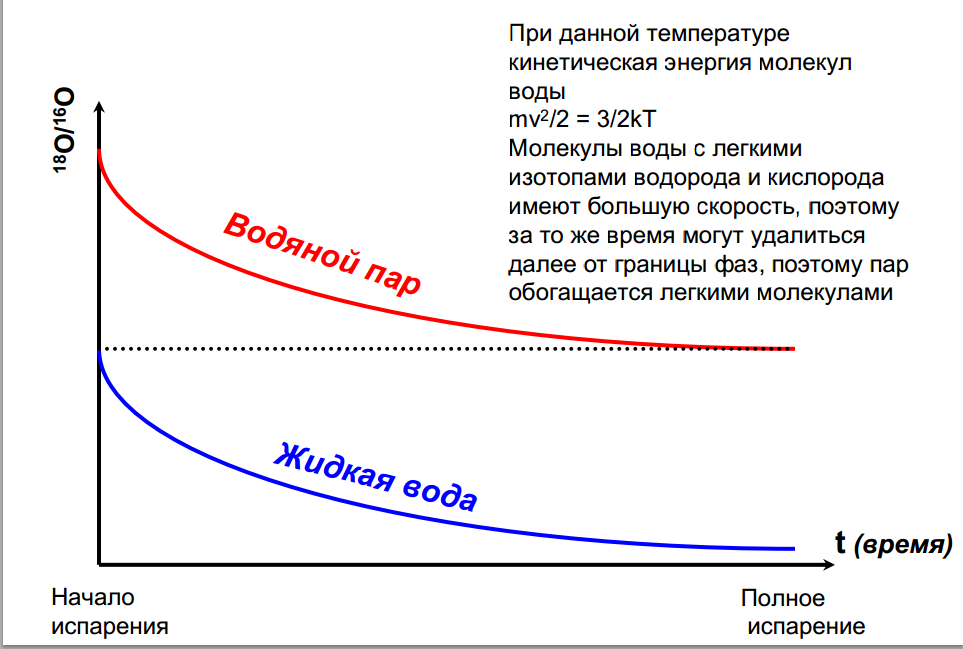
Термодинамический –зависит от температуры ( определяет колебательную энергию атомов) и молекулярной энергии связи химического элемента. Соединения с большей энергией связи обогащаются более тяжелыми изотопами. В равновесных условиях всегда наблюдается фракционирование изотопов между сосуществующими фазами, эффект тем более, чем ниже температура среды. Эффект практически не зависит от давления и химических параметров среды (состава магмы или флюида ).


Изотопное фракционирование в природе определяется температурой окружающей среды, при повышенных температурах коэффициент разделения обычно близок к единице.
Методы выражения изотопных эффектов.

Стандарты для стабильных изотопов.

Взаимосвязь коэффициента разделения изотопов и изотопных сдвигов относительно стандартов в фазах.

Принципы изотопной термометрии.

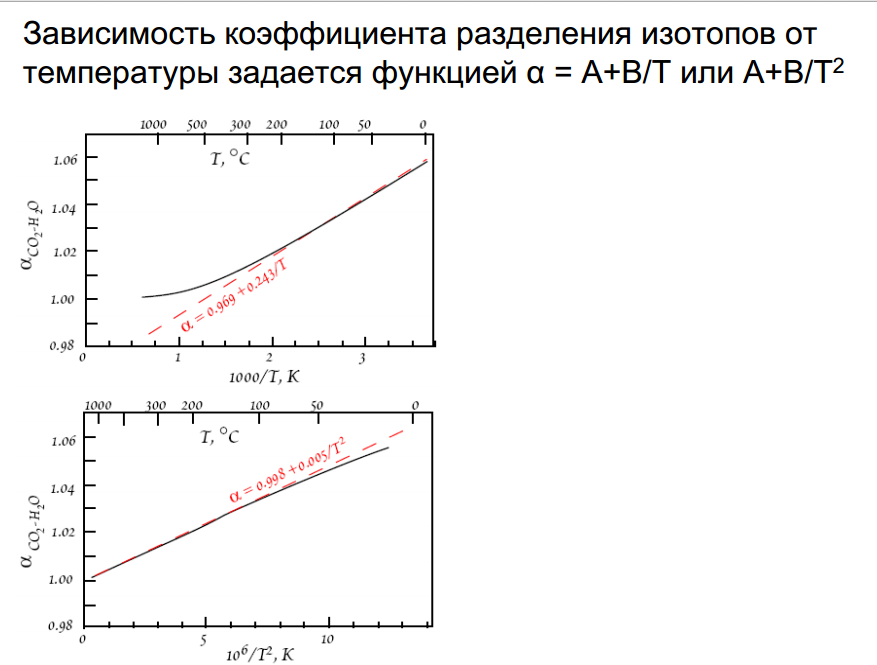
Термометры: 1)изотопно-кислородный ( для магматических и метаморфических пород до Т=850-900 град); 2)изотопно-серный- определение температуры кристаллизации сульфидных руд по сосуществующим сульфидам (надежен до Т=400-450).
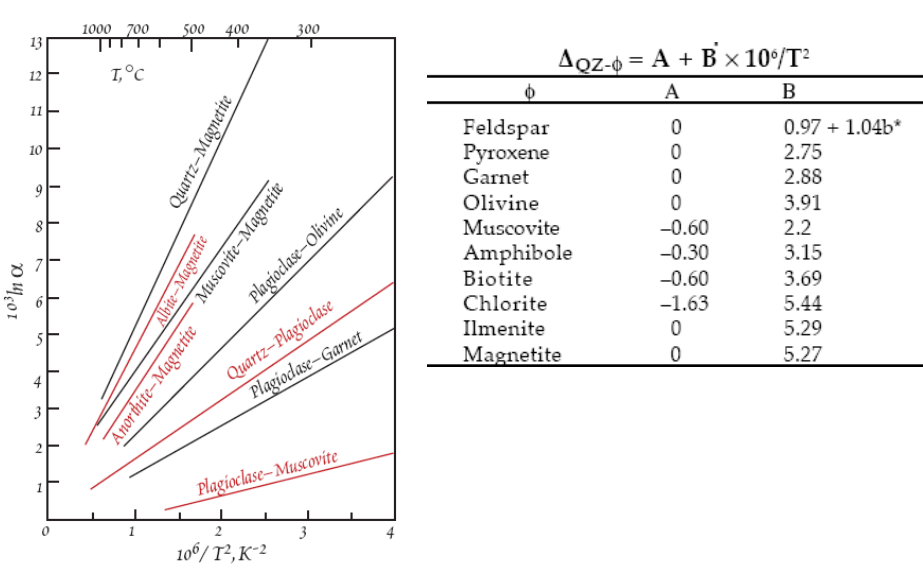
1)
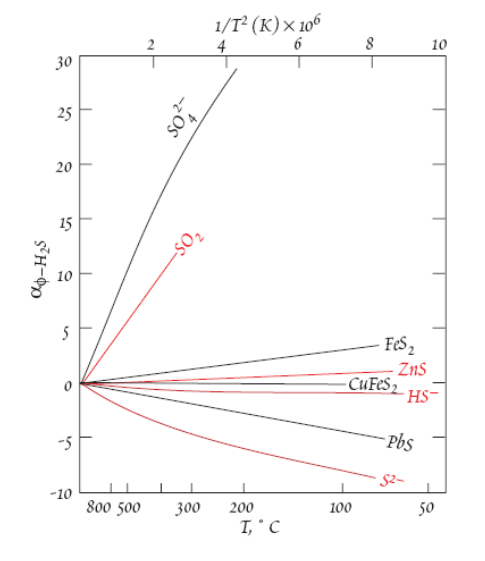
2)
Фракционирование изотопов кислорода и водорода. Глобальная система вода-водяной пар – лед.
Кислород
имеет три стабильных изотопа 16О (
распространен на 99, 63%), 17О и 18О , у водорода
два-1Н и 2Н- имеют наибольшую разницу
масс, следовательно, наибольшие вариации
изотопного состава). Для воды существует
9 различных конфигураций
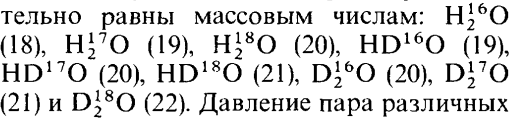 (в
скобках массы).Давление пара молекул
воды обратно пропорционально их массам
, сл-но у первой Н2О намного выше чем у
последней D2О. По этой
причине водяной пар обогащен 16О и Н, а
остающаяся вода 18О и D.
(16О и Н фракционируют в фазу пара, а 18О
и D концентрируются в
жидкой фазе). Изотопный состав водорода
и кислорода характеризуют величиной
(в
скобках массы).Давление пара молекул
воды обратно пропорционально их массам
, сл-но у первой Н2О намного выше чем у
последней D2О. По этой
причине водяной пар обогащен 16О и Н, а
остающаяся вода 18О и D.
(16О и Н фракционируют в фазу пара, а 18О
и D концентрируются в
жидкой фазе). Изотопный состав водорода
и кислорода характеризуют величиной
![]() которая
равна разности между значениями отношений
18О/16О (или D/Н) в образце и
в стандарте SMOW(стандартная
среднеокеаническая вода), выражается
в промилях. Положительные значения
-
обогащение образца тяжелыми изотопами,
отрицательные-обеднение. При испарении
воды с поверхности океанов водяной пар
обогащается 16О и Н, сл-но
18О
и
D
в атмосфере над океанами имеют –
значения.При образовании в облаках
дождевых капель в рез-те конденсации
водяного пара жидкая фаза обогащается
18О и D, так что изотопный
состав О и Н в первых дождевых каплях
подобен изотопному составу океанической
воды. Продолжающееся удаление из
воздушных масс 18О и D
приводит к обогащению оставшегося пара
16О и Н. Поэтому значения дельта 18О и
дельта D в атмосферном
паре по мере выпадения осадков уменьшаются,
в твердых и жидких осадках также
становятся отрицательными в рез-те
обеднения пара 18О и D.
Пресная вода осадков обеднена 18О и D
по сравнению с морской.
которая
равна разности между значениями отношений
18О/16О (или D/Н) в образце и
в стандарте SMOW(стандартная
среднеокеаническая вода), выражается
в промилях. Положительные значения
-
обогащение образца тяжелыми изотопами,
отрицательные-обеднение. При испарении
воды с поверхности океанов водяной пар
обогащается 16О и Н, сл-но
18О
и
D
в атмосфере над океанами имеют –
значения.При образовании в облаках
дождевых капель в рез-те конденсации
водяного пара жидкая фаза обогащается
18О и D, так что изотопный
состав О и Н в первых дождевых каплях
подобен изотопному составу океанической
воды. Продолжающееся удаление из
воздушных масс 18О и D
приводит к обогащению оставшегося пара
16О и Н. Поэтому значения дельта 18О и
дельта D в атмосферном
паре по мере выпадения осадков уменьшаются,
в твердых и жидких осадках также
становятся отрицательными в рез-те
обеднения пара 18О и D.
Пресная вода осадков обеднена 18О и D
по сравнению с морской.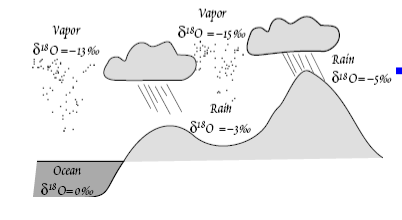
Линия
Крейга –зависимость величины дельта
18О от дельта D имеет
линейный характер.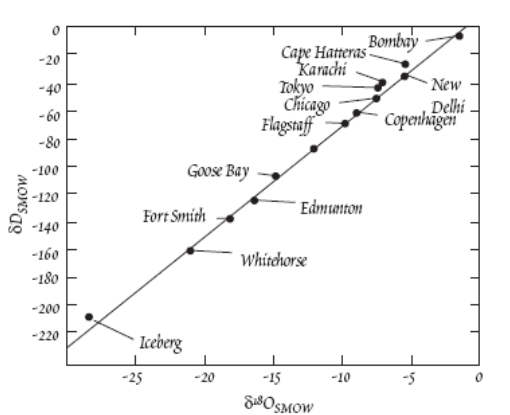
Самые низкие значения дельта 18О и дельта D свойственны снегу, выпадающему в высоких широтах и(или) на значительной высоте относительно уровня моря при низких температурах, то есть изотопный состав водорода и кислорода облегчается при понижении средней температуры на конкретной широте.
