
- •Лекція 2
- •План лекції
- •Зміст лекції:
- •Складові частини атома - ядро (протони, нейтрони), електрони, їх заряд та маса. Ізотопи.
- •2. Основні положення квантової механіки. Поняття про електронні хмарини і атомні орбіталі. Характеристика енергетичного стану електрона квантовими числами.
- •3. Структура періодичної системи: періоди; групи та підгрупи. S -, p -, d -, f –елементи.
- •1. Голубєв а.В., Лисін в.І., Коваленко, Тарасенко г.В, Хімія. - к.: Кондор, 2013 стр. 40-68
- •2. Цвєткова л.Б. Неорганічна хімія: теорії і задачі. Львів: «Магнолія», 2013. § 1.1;3.1-3.4.
- •3. Романова н.В. Загальна та неорганічна хімія. - к.:Ірпінь, 2004 § 1.1; 2.1-2.2.
Лекція 2
Тема. Будова атомів та періодична система хімічних елементів.
План лекції
Складові частини атома - ядро (протони, нейтрони), електрони, їх заряд та маса. Ізотопи.
Основні положення квантової механіки. Поняття про електронні хмарини і атомні орбіталі. Характеристика енергетичного стану електрона квантовими числами.
Структура періодичної системи: періоди; групи та підгрупи. s -, p -, d -, f –елементи.
Література
1. Голубєв А.В., Лисін В.І., Коваленко, Тарасенко Г.В, Хімія. - К.: Кондор, 2013 стр. 40-68
2. Цвєткова Л.Б. Неорганічна хімія: теорії і задачі. Львів: «Магнолія», 2013. § 1.1;3.1-3.4.
3. Романова Н.В. Загальна та неорганічна хімія. - К.:Ірпінь, 2004 § 1.1; 2.1-2.2.
Зміст лекції:
Складові частини атома - ядро (протони, нейтрони), електрони, їх заряд та маса. Ізотопи.
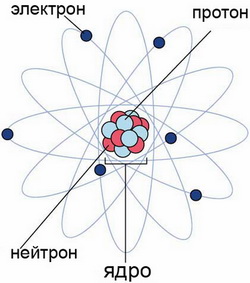
Поняття " атом" виникло ще в античному світі для позначення частинок речовини. У перекладі з грецької " атом " означає " неподільний". А.М. Бутлеров писав: " Атоми НЕ неподільні за своєю природою, а неподільні тільки доступними нам нині засобами ...". Дйсно, на той період не могли розділити атом, лише після досягнень видатних вчених, фізиків і хіміків було встановлено, що все ж таки атом є ділимою частиною. Склад атома можна зобразити наступним чином:
![]()
Ядро за сучасним уявленням має вигляд сферичної кулі, яка складається з частинок протонів і нейтронів, і навкруги ядра рухаються електрони, які несуть негативний заряд. Виявляється , ядро атома теж складається з частинок. Це протони , що мають заряд +1 і масу рівну одиниці ( масі атома водню) - р + і нейтрони , які нейтральні, тобто заряду не має , але їх маса дорівнює масі протона – no. У природі поки не знайдено зарядів менших , ніж заряд протона або електрона , тому їх заряд умовно приймають за одиничний (відповідно +1 і -1 )
![]()
 Існування
ядра атома було відкрито Резерфордом
у 1911 р. в дослідах по розсіюванню
а-частинок при проходженні їх крізь
речовину. У 1921 р. американський фізик
У.Харкінс встановив, що ядра складаються
з протонів і нейтронів; він ввів термін
«нейтрон» для позначення гіпотетичної
частинки з масою, що дорівнює масі
протону і не має електричного заряду.
Аналогічна пропозиція в тому ж році
була запропонована Е Резерфордом, він
же ввів термін «протон». Склад ядер був
з’ясований після відкриття Дж.Чедвіком
у 1932 р нейтрона. В тому ж році російські
вчені Д.Д. Іваненко і Є.Н. Гапон запропонували
протонно-нейтронну теорію будови ядер
атомів. Одночасно згадану теорію детально
розробив і німецький фізик Гейзенберг.
Згідно цієї теорії ядро атома складається
з протонів і нейтронів, названих нуклонами
(лат.
писlеиs-
ядро).
Існування
ядра атома було відкрито Резерфордом
у 1911 р. в дослідах по розсіюванню
а-частинок при проходженні їх крізь
речовину. У 1921 р. американський фізик
У.Харкінс встановив, що ядра складаються
з протонів і нейтронів; він ввів термін
«нейтрон» для позначення гіпотетичної
частинки з масою, що дорівнює масі
протону і не має електричного заряду.
Аналогічна пропозиція в тому ж році
була запропонована Е Резерфордом, він
же ввів термін «протон». Склад ядер був
з’ясований після відкриття Дж.Чедвіком
у 1932 р нейтрона. В тому ж році російські
вчені Д.Д. Іваненко і Є.Н. Гапон запропонували
протонно-нейтронну теорію будови ядер
атомів. Одночасно згадану теорію детально
розробив і німецький фізик Гейзенберг.
Згідно цієї теорії ядро атома складається
з протонів і нейтронів, названих нуклонами
(лат.
писlеиs-
ядро).
Протон (р) - стабільна елементарна частинка з масою спокою 1,673 10 24 г, відносною атомною масою 1,00727 а.о.м. з позитивним зарядом +1, спіном 14 (в одиницях сталої Планка) та магнітним моментом, що дорівнює 2,79 ядерного магнетона.
Нейтрон (no) - стабільна електронейтральна елементарна частинка з масою спокою 1,675 10~24 г, відносною атомною масою 1,008665 а.о.м. без електричного заряду, спіном 14 (в одиницях сталої Планка) та магнітним моментом, що дорівнює 1,91 ядерного магнетона.
Протони і нейтрони утримуються в ядрі специфічними ядерними силами, що значно перевищують кулонівське відштовхування однойменно заряджених протонів. На відміну від електростатичних та гравітаційних ядерні сили короткодіючі (радіус дії ~ 10-13 см).
Якщо збільшити атом в тисячу мільярдів разів, то при цьому ядро його збільшиться до розмірів шпилькової голівки, а електрони будуть рухатись на застані сотень метрів від ядра. В дуже малому об’ємі ядра зосереджена дуже велика маса, що свідчить про її величезну густину, яка складає приблизно 1014 г/см3. Якби виявилось можливим наповнити 1 см3 речовиною подібної густини, то маса його складала б приблизно 120 мільйонів тон
Електрони
– крихітні частинки, заряд яких прийнятий
«-1», а маса, рівна ![]() маси атома гідрогену. Фізично маса
електронну рівна 0.
маси атома гідрогену. Фізично маса
електронну рівна 0.
В цілому при оперуванні поняттями про будову атома слід пам’ятати:
1. Ядро атома має позитивний заряд , дорівнює числу протонів . 2. Маса атома дорівнює сумі протонів і нейтронів ( цю суму назвали масовим числом) . Масою електрона прийнято нехтувати внаслідок її надзвичайно малої величини . 3. Число протонів дорівнює числу електронів , тому що атом - електронейтральна ( яка не має заряду) частка.
Подальші дослідження будови атомів показали , що кількість елементарних частинок можна обчислити , виходячи з положення хімічного елемента в періодичній системі таким чином:
1. заряд ядра = числу протонів = порядковому номеру хімічного елемента в періодичній системі;
число електронів = числу протонів;
число нейтронів = масове число - число протонів.
Ізотонією називається явище існування різновидів атомів одного й того ж елемента, ядра яких мають різну атомну масу (масове число), але однаковий заряд.
Різновидності елемента, які характеризуються різною атомною масою, але однаковим зарядом ядер і тому однаковими хімічними властивостями, називаються ізотопами. Ізотоп елемента з певним числом протонів і нейтронів називається нуклідом.
Фізичні властивості ізотопів можуть бути різними. В перекладі з грецької «ізотоп» означає «рівномісний» (ізоз - рівний, однаковий + їороз - місце), тобто в періодичній системі ізотопам належить одне й те ж місце, одна і та ж клітинка. Всі ізотопи даного елемента зберігають його назву і мають ті ж позначення (символи), наприклад:
Ізотопи Оксигену
Цей колоядерний простір називають атомною орбіталлю АО. Займаючи ту чи іншу атомну орбіталь, електрон утворює електронну хмару, яка у електронів одного й того ж атома може мати різну форму. Форми електронних хмар аналогічні АО, тому їх також називають електронними або атомними орбіталями. 5
Д. Менделєєв виявив спільне, що характеризує всі хімічні елементи. Це дало змогу знайти логічний зв’язок між усіма хімічними елементами, сформулювати періодичний закон та створити періодичну систему (ПС), як табличний вираз періодичного закону: 7
“Властивості простих речовин, а також форми та властивості сполук хімічних елементів знаходяться у періодичній залежності від величини атомної маси елементів”. 7
У незмінному вигляді періодичний закон проіснував до 1913 р., коли видатний англійський вчений Мозлі на основі аналізу рентгенівських спектрів атомів виявив, що порядковий номер хімічного елемента у ПС дорівнює заряду його ядра. Стало зрозумілим, що заряд ядра атома є більш фундаментальною характеристикою ніж атомна маса. Після цього відкриття формулювання періодичного закону уточнили: “Властивості простих речовин, а також форми та властивості сполук хімічних елементів знаходяться у періодичній залежності від заряду ядра атома”. 7
Таким чином, можна вважати, що ПС – є діюча модель існування саме такої взаємодії між частинками мікросвіту, яка передбачається квантовою механікою. Це є також ілюстрацією тісного переплетіння фізичних закономірностей з хімічними властивостями елементів. Велика кількість варіантів періодичної системи – це спроба виявити нові зв’язки між елементами та їх властивостями, які ще не відкриті. 7
Структура періодичної системи 7
Період – це горизонтальний ряд (або ряди) хімічних елементів, що починається ns1-елементом, а закінчується ns2nр6-елементом. 7
Усього періодів сім. Із них перші три — малі періоди, бо кожний складається з одного ряду хімічних елементів. Починаючи з четвертого, ідуть великі періоди (кожний складається з двох рядів). Усього рядів десять. Кожний період містить певне число хімічних елементів: 7
1- й період (малий) — 2 елементи; 2- й період (малий) — 8 елементів; 3- й період (малий) — 8 елементів; 4- й період (великий) — 18 елементів; 5- й період (великий) — 18 елементів; 6- й період (великий) — 32 елементи; 7- й період (великий) — досі ще не завершений, містить поки що 24 елементи 7
Група – вертикальний ряд елементів, який поділяється на дві підгрупи, що складаються із елементів, які є атоманалогами. Атоманалоги – елементи, які мають однакову будову зовнішнього електронного шару. Таке визначення для групи характерно для короткоперіодного варіанту ПС, їх 8. У довгоперіодному варіанті групи складаються лише з атомів аналогів. . Кожна з них поділяється на дві підгрупи: А — головну, до складу якої входять елементи малих періодів (типові) і Б — побічну, яка складається тільки з елементів великих періодів, вони є неповними аналогами типових елементів і навіть можуть дуже відрізнятися від них за властивостями. Так, сьома група складається з головної підгрупи — Флуор, Хлор (типові елементи) та їх аналоги — Бром, Йод, Астат, і побічної, до складу якої входять елементи тільки великих періодів — Манган, Технецій, Реній. Елементи головної підгрупи — активні неметали, а елементи побічної — метали. 7
У підгрупах, в цілому, зверху вниз радіус атома збільшується, тому що збільшується кількість електронних шарів. У s- та р-елементів зміна радіуса атома більш різко, ніж у d- та f-елементів. 8
s-елементи: заповняються електронами зовнішнього енергетичного рівня s-підрівня. До них належать перші два елементи кожного періоду. 8
р-елементи: це 6 елементів кожного періоду, крім 1 та 7. 8
d-елементи: заповняються електронами d-підрівень другого ззовні рівня, а на зовнішньому рівні залишається один або два електрони (у Паладія нуль). Вони розміщенні у великих періодах між s-елементи та р-елементами (перехідні). 8
f-елементи: заповняються електронами f-підрівень третього ззовні рівня, а на зовнішньому рівні залишаються два електрони. Це – актиноїди та лантаноїди. Ці елементи винесені окремо. До р-елементів відносять елементи головних підгруп третьої-восьмої груп. До f-елементів відносять усі елементи побічних підгруп. 8
Таким чином: 8
1. Періодичність зумовлена обмеженою кількістю електронів у шарі, при цьому відбувається повторення будови валентного електронного шару та обумовлених нею хімічних властивостей елементів. Або періодичність зумовлена повторенням електронних конфігурацій атомів. 8
2. Властивості елементів та їх сполук закономірно змінюються як по горизонталі (у межах періодів), так і по вертикалі (у межах груп і підгруп). Крім того, спостерігається ще й діагональна подібність елементів (Li-Mg, Na-Ca, Be-Al). 8
3. Порядковий номер елемента вказує на заряд ядра Z (протонне число) і кількість електронів в атомі. 8
4. Номер періоду дорівнює кількості електронних шарів в електронній оболонці атома. 8
5. Номер групи, як правило, вказує на найвищу можливу ступінь окиснення. 8
6. Всі s-, d-, f-елементи є металами. Лише р-елементи поділяються (в короткоперіодичному варіанті ПС) діагоналлю від Be до At на метали – зліва внизу та неметали – з права вверху. 8
7. Металічні властивості зменшуються зліва направо по періоду. 8
8. Металічні властивості зростають зверху вниз по групі. 8
9. Приблизно по діагоналі (Be – At) розміщені елементи, які виявляють амфотерні властивості (Be, Al, Cr, As, Sn, Pb та ін.). 8
10. Найсильніший метал – Францій, а найсильніший неметал – Флуор. 8
Тільки два елементи: Гідроген (2 = 1) і радон (2 = 86) складають виключення, їх ізотопи мають інші назви і позначення.
Деякі елементи мають загальне число ізотопів, яке наближається до 20. Так, у Плюмбуму всього 19 ізотопів (195РЬ - 214РЬ), з них 4 стабільних, що знаходяться в природі (204РЬ, 206РЬ, 207РЬ, 208РЬ), і 15 радіоактивних.
Різновидності елементів, які характеризуються однаковим масовим числом, але різним зарядом ядер і тому різними властивостями, називаються ізобарами (грецьк. Ьагоз - вага), наприклад, 124 50Sn, 124 52Те , 124 54Хе та ін. Наявність ізобарів показує, що основною характеристикою елемента є заряд ядра атома, а не атомна маса (А).
Ядра атомів елементів, які мають різне число протонів та однакове число нейтронів, називаються ізотонами 1354 Хе (54р, 82n); 138 56Ва(56р, 82n);139 57 Lа (54р, 82n).
Останнім часом вивчено склад ізотопів багатьох природних хімічних елементів. Встановлено, що майже кожний елемент складається з кількох ізотопів. Саме цим пояснюється суттєве відхилення атомних мас багатьох елементів від цілочисельних значень.
З відкриттям ізотопів елементів було по-новому сформульоване поняття «хімічний елемент»: хімічним елементом називається вид атомів, що характеризується однаковим зарядом ядра.
