- •25. Закон Архимеда. Остойчивость плавающего тела.
- •19. Приборы для измерения гидростатического давления.
- •20. Гидравлические машины. Назначение, устройство и принцип
- •21. Понятие термодинамики как науки. Первый закон термодинамики
- •22. Второй закон термодинамики. Цикл Карно
- •23. Передача теплоты через твёрдую стенку.
- •24. Назначение и диаграмма работы четырёхтактного двс
- •25. Закон Архимеда. Остойчивость плавающего тела.
21. Понятие термодинамики как науки. Первый закон термодинамики
Исторически термодинамика возникла в XIX веке в связи с необходимостью изучения закономерностей процессов протекающих в паровых машинах. В настоящее время под технической термодинамикой понимается наука, изучающая процессы взаимного превращения теплоты и работы, а так же физические свойства тел, участвующих в этих преобразования [1].
Основными рабочими телами являются газообразные вещества - газы и пары, которые способны изменять свой объём в зависимости от изменения внешних условий. Рабочее тело в тепловой машине получает или отдаёт теплоту, взаимодействуя с более нагретым или более холодным внешними телами, которые называются источниками теплоты. Источник, который отдаёт теплоту рабочему телу и не изменяет свою температуру, называется верхним источником теплоты (ВИТ), а источник, получающий теплоту от рабочего тела и не изменяющий свою температуру, называется нижним источником теплоты (НИТ).
В зависимости от внешних условий один и тот же газ может находиться в различных состояниях, причём каждое из таких состояний характеризуется конкретными значениями ряда микроскопических величин, называемых термодинамическими параметрами. Это означает, что каждому состоянию газа соответствует одно и только одно значение каждого из термодинамических параметров.
Чтобы однозначно характеризовать состояние газа, необходимо и достаточно задать значения трёх любых его параметров таких, которые имеют конкретный физических смысл и достаточно просто измеряются техническими средствами. Такими термическими параметрами являются абсолютное давление, абсолютная температура и удельный объём. Если эти параметры имеют одинаковые значения по всему объёму рабочего тела, то они называются равновесными.
В основе термодинамики как науки лежат её первый и второй законы, устанавливающие качественные и количественные взаимосвязи между теплотой и механической работой [2].
Первый закон термодинамики устанавливает количественную связь между теплотой и механической энергиями и представляет собой балансовое уравнение изменения энергии в термодинамической системе:
u2 - u1 = q – l+ a, (2.1.)
где (u2 – u1) - изменение удельной внутренней энергии;
q – удельная теплота c которой тело обменивается энергией с окру
жающей средой;
l – удельная работа по изменению объёма;
a – работа немеханического характера.
К работе немеханического характера можно отнести работу по переносу электрического заряда, работу (теплоту) химического взаимодействия и др.
Если считать, что a = 0, то u2 – u1= q – l. В математическом выражении первого закона термодинамики принято подводимую к телу теплоту выражать как функцию внутренней энергии и работы:
q
=u2
-
u1
+
l,
![]() (2.2)
(2.2)
Тогда первый закон термодинамики с учётом (2.2.) формулируется следующим образом: вся подводимая к телу теплота идёт на изменение внутренней энергии и на совершение работы.
Отметим, что первый закон термодинамики, описывающий эквивалентное превращение теплоты и механической энергии, является частным случаем закона сохранения и превращения энергии, открытого М.В. Ломоносовым.
Из молекулярно-кинетической теории следует, что внутренняя энергия тела пропорциональна его температуре, тогда её изменение будет пропорционально разности температур, т.е.
U2 – U1 = cv (T2 – T1) (2.3)
Удельная работа расширения l в уравнении (2.2.) совершается против внешних сил, например расширение газа в цилиндре при постоянном давлении, и аналитически выражается следующим образом:
l = p (v2 – v1), (2.4)
где p – полное (абсолютное) давление газа, м3/кг.
С учётом уравнений (2.3) и (2.4) первый закон термодинамики можно представить в развёрнутом виде:
q = cv (T2 – T1)+ p (v2 – v1), (2.5)
Уравнение (2.5) часто используется при описании работы теплоэнергетических машин и установок, а так же для анализа типовых термодинамических процессов в газах, которые являются частными случаями первого закона термодинамики.
Теоретически измененные состояния газа полностью характеризуются тремя параметрами p, v и T, при этом теплота либо подводится к газу, либо отводится от него. Такие процессы называются политропными*. Наибольший практический интерес представляют такие процессы, в которых один из основных параметров остаётся постоянным, или процесс осуществляется без теплообмена с окружающей средой. Таких процессов в природе существует четыре:
- изохорный (v = const);
- изобарный (p = const);
- изотермический (T = const);
- адиабатный (dq = 0)
Все процессы при этом рассматриваются как равновесные и обратимые, а их исследование осуществляется на основе уравнения состояния идеального газа и первого закона термодинамики.
Изохорный процесс – это равновесный процесс, протекающий при постоянном объёме (v=const). Такой процесс осуществляется, например, при нагревании или охлаждении газа в замкнутом объёме. Так как в изохорном процессе не происходит изменение объёма, то уравнение первого закона термодинамики (2.5) при (v2 – v1) =0 будет иметь следующий вид:
q = cv (T2 – T1), , (2.6)
т.е. в изохорном процессе вся подводимая к телу теплота идёт на изменение его внутренней энергии.
Уравнение (2.6) определяет внутреннюю энергию 1кг газа в изохорном процессе, а его полная внутренняя энергия (m, кг) определяется по уравнению(2.7): Q = cv m (T2 – T1), Дж (2.7)
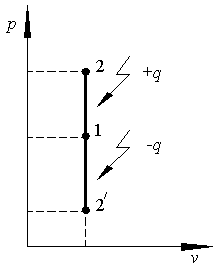
В p – v координатах изохорный процесс изображается вертикальным отрезком (рис.2.1).
|
На рис. 2.1 процесс изохорного нагревания 1–2, а изохорного охлаждения 1-21. Площадь под линией изохорного процесса равна нулю, что свидетельствует об отсутствии работы. Для построения графика изохорного процесса в T–s координатах используется выражение для энтропии: |
Рис. 2.1
ds=cv![]() ,
(2.8)
,
(2.8)
где dq = cvdT, тогда после интегрировани(2.8) в пределах температур
от T1 до T2 получим:
 (2.9)
(2.9)
Как следует из выражения (2.9), линия изохорного процесса в T–S координатах являются логарифмической кривой (рис 2.2).