
- •1.Общая характеристика железных руд
- •2. Коксохимическое производство
- •3. Подготовка железных руд к доменной плавке
- •4. Обогащение и окускование железорудного сырья.
- •5. Производство чугуна и устройство доменной печи.
- •6. Физико-химические основы доменного процесса
- •7. Образование в домне чугуна и шлака. Науглераживание железа
- •Образование шлака
- •8. Производство стали
- •9. Физико-химические основы сталеплавильных процессов
- •10. Производство стали в кислородных конверторах
- •11. Технология кислородно-конверторной плавки
- •12. Выплавка стали в электрических печах
- •13. Технология плавки стали в дуговой электросталеплавильной печи
- •14. Процесс плавки стали в индукционных печах
- •15. Разливка стали и кристаллизация стального слитка
- •16. Разливка стали в изложницы
- •17. Непрерывная разливка стали
- •18. Общие основы внепечного рафинирования. Внепечная обработка стали.
- •19. Получение ферросплавов.
- •20. Производство ферросплавов в рафинировочных печах
- •21. Производство ферромарганца
- •22. Производство ферросилиция
- •23. Медные руды. Их характеристика, способы получения. (надо дополнить)
- •24. Гидро- и пирометаллургические способы получения меди
- •25. Производство глинозёма
- •26. Производство криолита
- •27. Технология получения медного штейна
- •28. Рафинирование медного штейна
- •29. Производство медных сплавов.
- •30. Основное сырье для получения алюминия
- •31. Электролитическое получение алюминия
- •32. Рафинирование алюминия
- •33. Производство алюминиевых сплавов
- •34. Технология производства магния
- •35. Углетермический способ получения магния
- •36. Электролитическое получение магния
- •37. Технология производства титана
- •38. Получение титановых слитков
- •39. Титан и его сплавы
- •40. Технология получения вольфрама
35. Углетермический способ получения магния
Магний можно получить углетермическим способом из брикетов состящих из порошкообразного магнезита и нефтяного кокса. Процесс осуществляется в герметизированной дуговой печи в атмосфере водорода.
Термические способы получения магния основаны на восстановлении его из оксидов или других соединений более активным металлом. В качестве восстановителя можно использовать алюминий, металлический кремний, силикоалюминий, карбиды металлов и др. Возможно получение металлического магния путем его восстановления углеродом по реакции, так называемый метод углетермического восстановления:
MgO + С = Mg пар + СО
Реакция идет при температуре свыше 2000°С и магний сублимируется. Для его получения необходимо резкое охлаждение, вызываемое жидким водородом. Также применяется силикотермический метод восстановления оксида магния неуглеродистыми восстановителями. Из оксида магния можно получить магний по следующей реакции:
2MgOтв + Siтв = SiО2тв + 2 Mgпap.
Данный процесс протекает при 2300°С, но при понижении давления идет при 1500°С, а в присутствии СаО этот процесс происходит при температуре 1200-1400°С. В качестве сырья можно применять закальцованные магнезиты или доломиты. Для магнезитов с высоким содержанием кальция и доломитов применяют силикотермический способ «Магнетерм» (Франция), основанный на получении магния из обожженного доломита с ферросилицием по реакции:
2(СаО • MgO) + Fe(Si)x = 2Mg + 2СаО • Si02 + Fe(Si)x-l.
Доломит кальцинируют и смешивают с ферросилицием, после брикетирования загружают в восстановительную печь, где под вакуумом получают в специальных ретортах металлический магний. Для производства металлического магния целесообразно использовать установки жидкофазового восстановления металлов. Магний, получаемый термическим методом, содержит 99,6-99,9% металлического магния.
36. Электролитическое получение магния
Электролитический метод является основным и основан на получении чистого безводного хлорида магния, его электролизе и рафинировании магния. Любой вид магнезиального сырья (природный магнезит, бишофит МgСl2 х 6Н2O, карналлит КМg Сl3 х 6Н3О, рассолы, морская вода и др.) с помощью соляной кислоты переводят в магниевые соли. Далее хлорид магния, бишофит, карналлит и рассолы выпаривают и обезвоживают. Затем он поступает в электролизеры, где катодом является железистый электрод, на котором выделяется металлический магний, и анодом - графитовый электрод, на котором выделяется хлор, удаляющийся по газопроводу из электролизера. Магний вычерпывают около катода и разливают в чушки, которые далее рафинируют. При производстве магния из его оксида возможен способ растворения оксида магния в расплаве смеси фторидов магния, натрия, калия и бария. Присутствие ВаF2, к которому добавляется NaF в таком количестве, чтобы температура расплава составляла 950°С, способствует всплыванию металлического магния на поверхность электрода.
37. Технология производства титана
Титан отличается высокой механической
прочностью, коррозионной стойкостью,
жаропрочностью (Тпл = 1660 °С) и малой
плотностью (4,51 г/см3). Его применяют как
конструкционный материал в самолетостроении,
а также при постройке сосудов,
предназначенных для транспортирования
концентрированной азотной и разбавленной
серной кислот. Применяют также диоксид
TiO2 для производства титановых белил и
эмали. Наиболее распространенным сырьем
для производства титана и диоксида Ti
служит ильменитовый концентрат,
выделяемый при обогащении титаномагнетитовых
железных руд, в котором содержится, %:
40-60 TiO2, ~30 FeO, ~20 Fe2O3 и 5—7 пустой породы
(CaO, MgO, Al2O3, SiO2), причем титан в виде минерала
ильменита FeO • TiO2. Технологический
процесс производства титана из
ильменитового концентрата состоит из
следующих основных стадий: получение
титанового шлака восстановительной
плавкой, получение тетрахлорида титана
хлорированием титановых шлаков,
производство титана (губки, порошка)
восстановлением из тетрахлорида. Кроме
того, зачастую проводят рафинирование
полученного титана и иногда переплав
для получения титана в виде слитков.
Восстановительная плавка ильменитового
концентрата имеет целью перевести TiO2
в шлак и отделить оксиды железа путем
их восстановления. Плавку проводят в
электро дуговых печах. Сначала загружают
концентрат и восстановитель (кокс,
антрацит), их нагревают до ~ 1650 °С. Основной
реакцией является: FeO • TiO2 + С = Fe + TiO2 +
CO. Из восстановленного и науглероживающегося
железа образуется чугун, а оксид титана
переходит в шлак, который содержит
82—90% TiO2 (титановый шлак). Получение
тетрахлорида титана TiCl4 осуществляют
воздействием газообразного хлора на
TiO2 при температурах 700—900 °С, при этом
протекает реакция: TiO2 + 2Cl2 + 2С = TiCl4 + 2СО.
Исходным титаносодержащим сырьем при
этом является титановый шлак. Хлорирование
осуществляют в шахтных хлораторах
непрерывного действия или в солевых
хлораторах. Шахтный хлоратор — это
футерованный цилиндр диаметром до 2 и
высотой до 10 м, в который сверху загружают
брикеты из измельченного титанового
шлака и снизу вдувают газ магниевых
электролизеров, содержащий 65—70 % Cl2.
Взаимодействие TiO2 брикетов и хлора идет
с выделением тепла, обеспечивающего
необходимые для процесса температуры
(~ 950 °С в зоне реагирования). Образующийся
в хлораторе газообразный TiCl4 отводят
через верх, остаток шлака от хлорирования
непрерывно выгружают снизу. Солевой
хлоратор для производства титана
представляет собой футерованную шамотом
камеру, наполовину заполненную
отработанным электролитом магниевых
электролизеров, содержащим хлориды
калия, натрия, магния и кальция. Сверху
в расплав загружают измельченные
титановый шлак и кокс, а снизу вдувают
хлор. Температура 800—850 °С, необходимая
для интенсивного протекания хлорирования
титанового шлака в расплаве, обеспечивается
за счет тепла протекающих экзотермических
реакций хлорирования. Газообразный
TiCl4 из верха хлоратора отводят на очистку
от примесей, отработанный электролит
периодически заменяют. Основное
преимущество солевых хлораторов состоит
в том, что не требуется дорогостоящее
брикетирование шихты. Отводимый из
хлораторов газообразный TiCl4 содержит
пыль и примеси газов — СО, СO2 и различные
хлориды, поэтому его подвергают сложной,
проводимой в несколько стадий очистке.
Производство титана Металлатермическое
восстановление титана из тетрахлорида
TiCl4 проводят магнием или натрием. Для
восстановления магнием служат аппараты,
представляющие собой помещенную в печь
герметичную реторту высотой 2—3 м из
хромо-никелевых сталей. После ввода в
разогретую до ~ 750 °С реторту магния в
нее подают тетрахлорид титана .
Восстановление титана магнием TiCl4 + 2Mg
= Ti + + 2MgCl2 идет с выделением тепла, поэтому
электронагрев печи отключают и реторту
обдувают воздухом, поддерживая температуру
в пределах 800—900 °С; ее регулируют также
скоростью подачи тетрахлорида титана.
За один цикл восстановления длительностью
30—50 ч получают 1—4 т титана в виде губки
(твердые частицы титана спекаются в
пористую массу — губку). Жидкий MgCl2 из
реторты периодически выпускают.
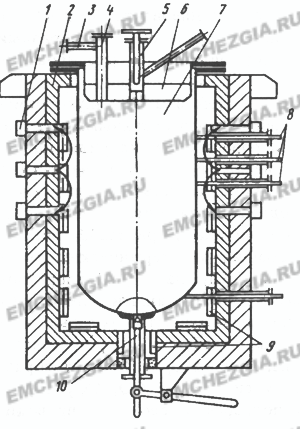
Рисунок 1. Аппарат для восстановления тетрахлорида магнием: 1 — коллектор для подачи и отвода воздуха; 2 — печь; 3 — штуцер для вакуумирования; 4 — патрубок для заливки магния; 5 — узел подачи тетрахлорида; б — крышка; 7 — реторта; 8 — термопары; 9 — нагреватель; 10 — устройство для слива
Титановая губка впитывает много MgCl2 и магния, по-этому после окончания цикла восстановления проводят вакуумную отгонку примесей. Реторту после нагрева до ~ 1000 °С и создания в ней вакуума выдерживают в течение 35—50 ч; за это время примеси испаряются. Иногда отгонку примесей из губки проводят после ее извлечения из реторты. Восстановление титана натрием проводят в аппаратах, схожих с применяемыми для магниетермического восстановления. В реторте после подачи TiCl4 и жидкого натрия идет реакция восстановления титана: TiCl4 + 4Na = Ti + 4NaCl. Температура в 800—880 °С поддерживается за счет выделяющегося при восстановлении тепла. Полученную твердую массу, содержащую 17 % Ti и 83 % NaCl извлекают из реактора, измельчают и выщелачивают из нее NaCl водой, получая титановый порошок.
