
Дифференциальный диагноз и дифференцированная терапия анемий.
Прежде чем обсуждать вопросы дифференциального диагноза и лечения анемических состояний необходимо определиться, а что же такое анемия? В литературе представлено несколько определений. Нам наиболее импонирует следующее: анемия – состояние организма, характеризующееся уменьшением концентрации гемоглобина и количества эритроцитов в единице объема крови.
И еще один вопрос должен быть обсужден до начала дифференциального диагноза – вопрос классификации анемий.
Следует отметить, что даже в настоящее время – речь идет об эпохе «медико-экономических стандартов»- нет единой точки зрения по классификации анемий.
Существует попытка выделять относительные (изменение объема плазмы) и абсолютные (изменение количества эритроцитов) анемии, гипо- и гиперпролиферативные (в зависимости от эффективности продукции эритроцитов в костном мозге) анемии. Достаточно часто используют классификации анемий основанную на величине цветового показателя, патогенетическую и патофизиологическую классификации анемических состояний и пр. Резюмируя дискуссию по поводу классификации анемий, следует отметить: «Существует много классификаций анемий. Некоторые из них более, другие менее приемлемы, но ни одна из них не верна».
И еще один важный тезис. Тщательный анализ причин, лежащих в основе анемий, позволяет утверждать, что анемии чаще всего развиваются на фоне каких либо заболеваний внутренних органов, а, значит, является синдромом, а, значит, четкая этиологическая классификаций анемий невозможна.
Для целей дифференциального диагноза анемических состояний наиболее актуальны оказались две классификации – патогенетическая классификации и разделение анемий в зависимости от величины цветового показателя. Обе они позволяют уже на начальном этапе диагностического поиска существенно сузить дифференциально-диагностический ряд и ориентируют нас на поиск причины болезни и дает основание к проведению эффективной патогенетической терапии.
В зависимости от величины цветового показателя все анемические состояния можно разделить на три группы:
Гипохромные – величина цветового показателя (ЦП) менее 0,8, а насыщение гемоглобином эритроцитов менее 28ɤɤ;
Нормохромные – значение ЦП колеблется в пределах 0,8 – 1,2, насыщение гемоглобина эритроцитов – 28-32 ɤɤ;
Гиперхромные – ЦП – более 1,2, насыщение гемоглобином эритроцитов – более 32 ɤɤ.
Патогенетическая классификация включает шесть вариантов:
Хронические железодефицитные анемии;
РНК-, ДНК-зависимые анемии;
Гемолитические анемии
Апластические анемии
Анемии, обусловленные нарушением синтеза и утилизации порфиринов (сидероахрестические анемии);
Анемии хронических заболеваний.
К гипохромным анемиям относятся хронические железодефицитные анемии (ЖДА), анемии хронических заболеваний (АХЗ), анемии обусловленные нарушением синтеза и утилизации порфиринов, а также таласемия – один из вариантов наследственных гемоглобинопатий.
Нормальными параметрами ЦП характеризуются гемолитические анемии (за исключением таласемии) и апластические анемии. Гиперхромия эритроцитов характерна для РНК-, ДНК-зависимым анемиям (мегалобластные анемии, витамин В12-дефицитные анемии (В12ДА), фолиеводефицитные анемии (ФДА).
Дифференциальный диагноз анемий можно условно разделить на три этапа. Первый включает собственно выявление анемии и определение величины цветового показателя.
Основным клиническим синдромом на начальном этапе диагностического поиска является анемический (циркуляторно-гипоксический) симптомокомплекс, который проявляется следующими проявлениями - слабостью, головокружением, шумом в ушах, одышкой и, наконец, бледностью кожных покровов. Вторичными по отношению к анемическому синдрому могут быть кардиальные расстройства – нарушения ритма сердца и проводимости, кардиалгии, миокардиальная недостаточность. Субстратом кардиальных нарушений является метаболическая кардиомиопатия, миокардиодистрофия. Выявлением анемического синдрома, а также определением величины цветового показателя собственно и завершается первый этап диагностического поиска.
На втором этапе диагностики определяется патогенетический вариант анемии. Согласно данным статистики наиболее частым патогенетическим вариантом анемий являются железодефицитные анемии. По данным ВОЗ, в мире, население которого сейчас приближается к 6 млрд. человек, около 2 млрд. страдает ЖДА.
Из всех анемий 80% составляет ЖДА. Возрастные группы, в которых анемия встречается чаще, - это женщины детородного возраста, беременные и дети 12-17 лет. Распространенность ЖДА у детей меняется с возрастом. В период быстрого роста дефицит железа достигает 50% и превалирует у девочек (они быстрее растут, и у них появляются менструальные кровопотери). Среди детей от многоплодной беременности и детей с опережающим обычные нормы ростом ЖДА на первом году жизни выявляется более чем в 60% случаев. В пожилом возрасте половые различия постепенно исчезают, и даже отмечается преобладание мужчин с дефицитом железа. По данным официальной статистики Минздрава России, из числа родивших женщин в 1995 г. имели анемию 34,4%, а в 2000 г. - 43,9%- В отдельных группах населения частота встречаемости железодефицитных состояний достигает 50% и даже 70-80%. Дефицит железа, по данным ВОЗ 1992 г., определяется у 20-25% всех младенцев, 43% детей в возрасте до 4 лет и до 50% подростков (девочки).
Прежде обсуждения основных клинических и диагностических критериев ЖДА целесообразно в двух словах остановиться на регуляции обмена железа
В основе регуляции обмена железа лежит контроль за его всасыванием и депонированием, и практически отсутствует контроль за потерей железа. Ежедневные физиологические потери железа малы, не более 1 мг в день, за исключением периода менструации, беременности и лактации у женщин, когда они могут увеличиваться до 5 мг. Физиологическая потеря железа происходит через пищеварительный тракт: десквамация эпителиальных клеток кишечника, микрокровотечения и потери с желчью. Железо также теряется и при десквамации эпителиальных клеток кожи, и незначительно с мочой.
Всасывание железа происходит в 12-перстной кишке и проксимальном отделе тощей кишки. Клетки дуоденальных и тонкокишечных крипт программируются на интенсивность всасывания железа, природа этого молекулярного механизма до конца не изучена, изменение интенсивности абсорбции железа энтероцитами развивается в течение 2-3 дней (рис 1).
Рисунок 1.
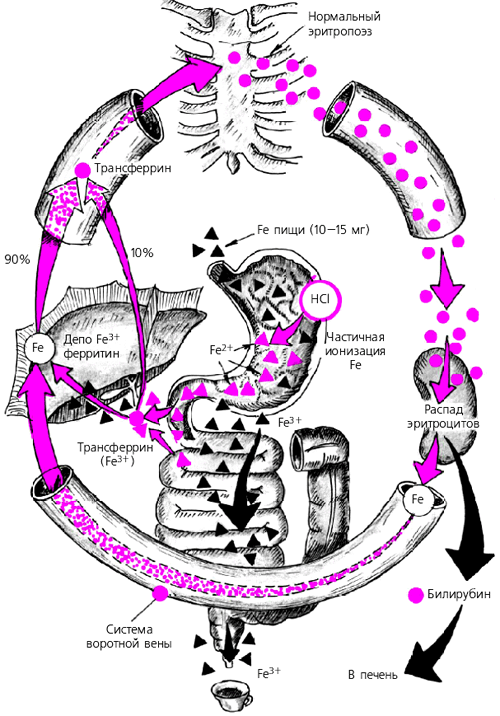
Интенсивность абсорбции контролируется количеством железа, поступившим с пищей, количеством запасов железа и интенсивностью эритропоэза. Finch выдвинул гипотезу о существовании двух регуляторов интенсивности всасывания в тонком кишечнике. Stосk-зависимый регулятор, который позволяет увеличивать интестинальную абсорбцию железа, обусловленную физиологическими потребностями и не превышает 1 или 2 мг. Эритрозависимый регулятор, регулирующий по потребностям эритропоэза при увеличении физиологических потребностей 3-4 мг в день, например, при незначительной кровопотере, при взятии крови у доноров или лечебном кровопускании. В настоящее время в качестве плазмарастворимых агентов такой регуляции обсуждаются такие белки, как гепсидин - белок, синтезируемый в печени, его повышение вызывает снижение абсорбции железа и приводит к его депонированию в макрофагальной системе. И наоборот, понижение уровня выработки гепсидина усиливает абсорбцию железа и препятствует его накоплению в макрофагах. Это вещество стало уже диагностическим инструментом и может стать новым средством терапии. Протеин HFE, который располагается на поверхности клетки и вызывает гиперабсорбцию и перегрузку железом. Рецепторы трансферрина 1 и 2 (RTf1, RTf2), связывающие трансферрин в клетках.
Кроме анемического синдрома для ЖДА характерен синдром тканевой сидеропении, патогномоничный для этого варианта заболевания симптомокомплекс. Проявлениями синдрома тканевой сидеропении являются поражение кожи и ее придатков (сухость кожи, ломкость волос и ногтей, появлением койлонихий и пр.). Помимо кожи в патологический процесс вовлекаются и другие ткани, обладающие высокой регенераторной способностью – эпителиальные ткани, кроветворная ткань. А это значит, что вторичными проявления тканевого дефицита железа будут гастроэнтерологический расстройства (атрофический гастрит), изменения со стороны периферической крови (нейтропения, относительный лимфоцитоз), синдром вторичного иммунодефицита. Среди наиболее «ярких» клинических признаков дефицита железа следует упомянуть извращение вкуса и обоняния – «pica chlorotica». У пациентов появляется патологическая тяга к резким запахам (ацетон, выхлопные газы, лаки, краски) и несъедобным вещам (глина, мел, уголь и пр.).
Особый интерес представляют осложнения ЖДА у беременных и плода. К таковым относятся:
плацентарная недостаточность (18-24%);
угроза невынашивания и преждевременных родов (11-42%);
гестоз (40-50%), преимущественно отечно-протеинурическая формы;
слабость родовых сил (10-15%);
несвоевременное излитие околоплодных вод у каждой 3-й беременной;
гипотоническое кровотечение (7-10%);
послеродовые септические осложнения (12%);
эндометрит (12%);
мастит (2%);
гипогалактия (39%);
многоводие.
Исследование общего анализа крови помимо снижения ЦП позволяет выявить умеренное снижение количества лейкоцитов, нейтропению, относительный лимфоцитоз. Содержание тромбоцитов в единице объема крови, как правило, существенно не изменяется.
В рамках второго этапа диагностического поиска при ЖДА совершенно необходимо исследовать показатели обмена железа. Концентрация железа сыворотки крови при ЖДА уменьшается как и концентрация трансфррина, общая железо связывающая способность сыворотки (ОЖСС) увеличивается.
Два этих простейших теста позволяют доказать наличие ЖДА. На этом этапе можно считать завершенным первый этап диагностического поиска – определение патогенетического варианта заболевания. На третьем этапе диагностического поиска предстоит выявить этиологию патологического процесса. Причинами ЖДА может быть:
Хроническая кровопотеря;
Алиментарный дефицит железа;
Повышение потребности в железе (беременность, лактация, период активного роста у детей и подростков;
Исходный дефицит железа;
Нарушение всасывания железа в тонком кишечнике.
С целью уточнения причины дефицита железа должен быть использован весь комплекс инструментальных методов исследования, включающий рентгенологические, ультразвуковые, эндоскопические, иммунологические и пр. Лишь обнаружив причину заболевания диагностический поиск можно считать законченным.
Постановка диагноза ЖДА предполагает проведение патогенетической терапии. Правила ферротерапии достаточно просты и необременительны:
Прием препаратов железа per os – соли железа (сорбифер, тардиферрон, ферроградумет и пр.) или железо в составе полимальтозного комплекса (ферреум лек);
Использование средне терапевтических дозировок препаратов железа – 100-300 мг элементарного железа в сутки;
Прием препаратов железа в перерывах между приемами пищи – через 30-60 минут после приема пищи;
Достаточная продолжительность терапии – 6-8 недель. Цель столь продолжительной терапии – восполнение всех запасов железа в организме, включая запасное, транспортное и тканевое железо.
Профилактический прием препаратов железа, особенно при циклических кровопотерях у женщин фертильного возраста.
Отдельно необходимо остановиться на показаниях к назначению парентерального железа:
Неэффективность железа, назначенного через рот;
Нарушение всасывания железа вследствие резекции тонкого кишечника или тяжелых энтеритов;
Непереносимость препаратов железа, принимаемых через рот;
Необходимость в быстром повышении содержания железа в крови при некоторых состояниях – последний триместр беременности, подготовка к оперативным вмешательствам.
Одним из критериев правильности установленного диагноза кроме показателей общего анализа крови и параметров обмена железа является оценка эффективности проводимой терапии по следующим критериям:
Субъективное улучшение через 48-72 часа
Увеличение количества ретикулоцитов на 9-12 сутки
Нормализация уровня гемоглобина на 3-4 неделе терапии.
Отсутствие эффекта от проводимой ферротерапии требует выявления причин, которые представлены ниже:
Недостаточная продолжительность терапии
Нарушение всасывания в тонком кишечнике
Неадекватная доза препаратов железа
Продолжающаяся кровопотеря
Neo
Неправильный диагноз.
Как правило, не возникает существенных проблем при постановке диагноза ЖДА. Однако следует упомянуть, что гипохромными анемиями являются также анемические состояния сопровождающие хронические воспалительные заболевания и некоторые заболевания внутренних органов, сидероахрестические анемии, обусловленные нарушениями синтеза гема, одна из наследственных гемолитических анемий – талассемия.
В диагностике АХЗ помогает выявление таких болезней как ревматоидный артрит, хронические нагноительные заболевания, хронические заболевания почек, гипотиреоз и некоторые другие вкупе с лабораторными сдвигами, представленными следующими нарушениями в обмене железа:
Снижение концентрации железа сыворотки;
Пониженный или нормальный уровень трансферрина;
Нормальный или повышенный уровень ферритина.
При таласемии ведущим клиническим синдромом является симптомокомплекс гемолиза – желтуха, темная моча, гиперхоличный кал, спленомегалия. Изложенное выше вместе с отягощенным анамнезом позволяет заподозрить таласемию и провести соответствующие исследования.
Нарушения порфиринового обмена маркирует изменение цвета мочи (красная, оранжевая) и появление неврологических расстройств (двигательный полиневрит), а также болевого абдоминального синдрома.
