
Рівні структурної організації білків.
Первинна стуктура – це певна послвдовність залишків α-амінокислот, що утворюють поліпептидний ланцюг, з урахуванням їх кількості і якості. Формують первинну структуру пептидні (амідні) зв'язки:
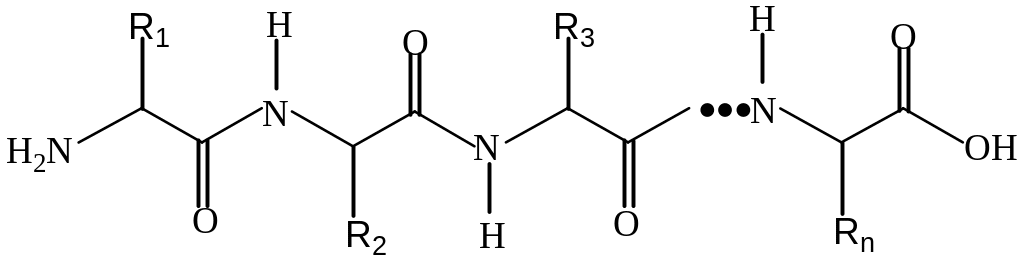
Початком пептиду вважається амінокислотний залишок з вільною α-аміногрупою (N-кінець), а кінцем – залишок амінокислоти з вільною α-карбоксильною групою (С-кінець).
Будова пептидної групи.
Чотири атоми пептидної групи (–CO-NH-) мають особливості:
- всі чотири атоми цієї групи розміщені в одній геометричній площині (компланарні);
- атоми кисню і водню знаходяться в транс-положенні відносно С-N - зв'язку;
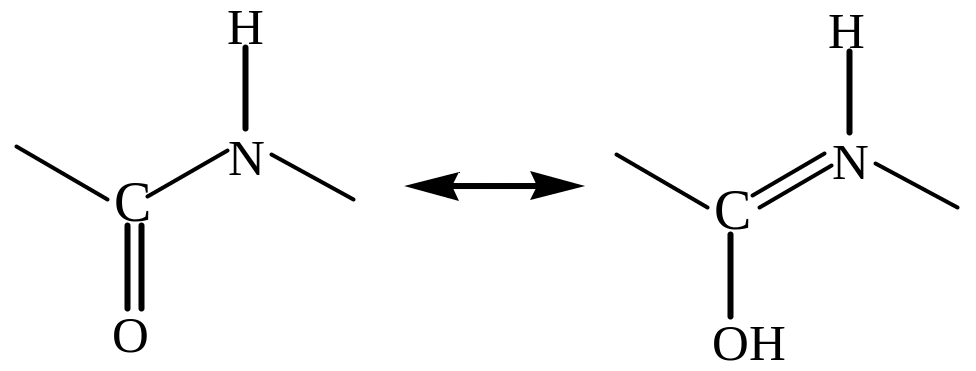
- довжина зв'язку між атомами С та N (0,132 нм) є проміжною між довжиною одинарного зв'язку (0,147нм) й довжиною подвійного зв'язку (0,127 нм). Це означає, що пептидна група є трьохцентровою спряженою системою, для якої справедливими є дві резонансні структури (кето-форма і енольна форма):
- вільнее обертання в поліпептидному ланцюзі з утворенням різних конформацій білкової молекули можливо тільки біля груп –СHR сусідніх амінокислотних залишків.
В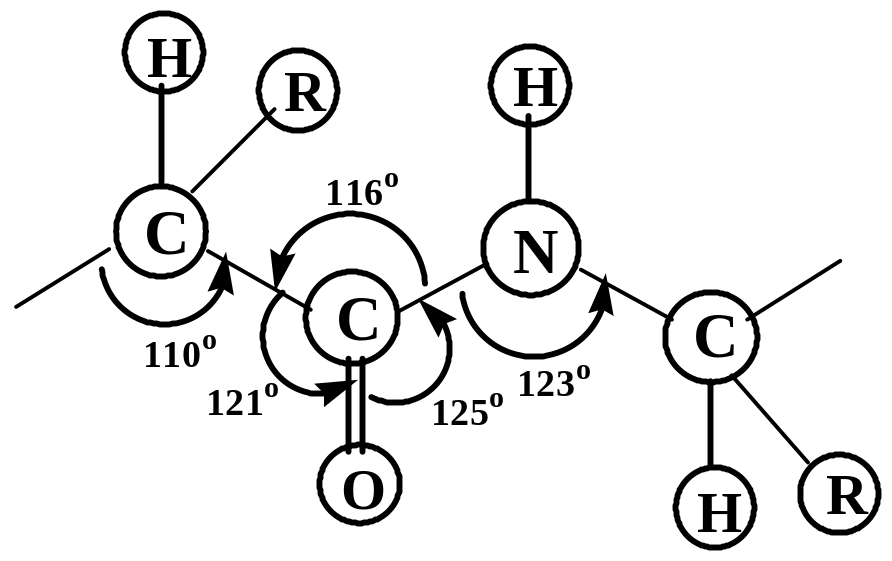 иходячи
з особливостей пептидної групи, наведемо
модель будови первинної структури
фрагменту поліпептидного ланцюга з
урахуванням транс-положення груп С=О і
N-H
та валентних кутів між окремими атомами:
иходячи
з особливостей пептидної групи, наведемо
модель будови первинної структури
фрагменту поліпептидного ланцюга з
урахуванням транс-положення груп С=О і
N-H
та валентних кутів між окремими атомами:
В зв'язку зі здатністю окремих частин поліпептидного ланцюга взаємодіяти один з одним, пептидний ланцюг може набувати і більш складні рівні структури (вторинну, третинну та четвертинну). Але їх вид визначається первинною структурою.
2. Вторинна структура білків – це ряд впорядкованих конформацій поліпептидного ланцюга, обумовлений утворенням водневих зв'язків між просторово наближеними пептидними групами.
Розрізняють такі основні види вторинної структури:
- α-спіраль,
- спіраль колагену,
- β-структуру,
- невпорядковану (хаотичну) структуру.
α-Спіраль – це конформація, що утворюється при просторовому скручуванні поліпептидного ланцюга за рахунок водневих зв'язків, які виникають між пептидними групами поліпептидного ланцюга, віддаленими одна від одної на чотири амінокислотних залишки. Водневі зв'язки в α-спіралі спрямовані паралельно осі молекули.
Напрямок обертання в природних білках для поліпептидного ланцюга в такій спіралі – правий («правозакручена спіраль»). Геометричні параметри α-спіралі: радіус – 0,25 нм; крок спіралі – 0,54 нм; на один оберт α-спіралі припадає 3,6 амінокислотних залишка.
Спіраль колагену. Формування α-спіралі залежить від просторових (стеричних) взаємовідносин між амінокислотними залишками, що утворюють поліпептидний ланцюг. Окремі амінокислоти (пролін, глутамінова кислота, глутамін, аспарагінова кислота, аргінін) протидіють утворенню α-спіралі або дестабілізують її. В зв'язку з цим можливо утворення спіралеподібних структур іншого виду. Прикладом є спіраль колагену (головного білкового компоненту сполучної тканини), особливістю первинної структури якого є постійне повторення фрагменту –Глі-Про-. Всього в складі колагену міститься близько 33 % гліцину і 21 % проліну та гідроксипроліну.
β-Структура – це структура типу складчастого шару, що утворюється з декількох зигзагоподібно згорнутих поліпептидних ланцюгів (чи фрагментів одного і того ж ланцюга), розташованих поруч.
β-Структура формується переважно за рахунок міжланцюгових водневих зв'язків сусідніх поліпептидних послідовностей.
Прикладом білків з β-конформацією є β-кератини, що складаються з зигзагоподібних антипаралельно орієнтованих поліпептидних ланцюгів. Представником β-кератинів є фіброїн – фібрилярний нерозчинний білок шовку та павутиння.
Невпорядкована (хаотична) структура також утворюється при формуванні водневих зв'язків між просторово наближеними пептидними групами, проте виникають такі зв'язки нерегулярно, самочинно та хаотично.
В багатьох природніх білках на протязі однієї поліпептидної послідовності присутні як α-спіралізовані ділянки, так і зони, які мають β-складчасту структуру чи нерегулярну конформацію. Наприклад, в молекулі хімотрипсину до 14 % загальної довжини поліпептидного ланцюга припадає на α-спіраль, 45 % - на β-структуру, 61 % складають ділянки з невпорядкованою структурою.
Супервторинна структура. Декілька білкових молекул з вторинною структурою у вигляді спіралі можуть взаємодіяти одна з одною, утворюючи міжмолекулярні комплекси, що є суперспіралізованими (супервторинними) структурами. Таким чином відбувається формування багатьох біологічно важливих фібрилярних білків, наприклад, мікрофібрил тропоколагену – структурных одиниць колагенових фібрил сполучної тканини, молекул β-кератинів – основного типу фібрилярних білків, з яких побудовані зовнішні покривні тканини хребетних тварин (епідерміс, волосся, нігті людини).
3.Третинна структура білків – це спосіб укладання в певному об'ємі тримірного простору поліпептидного ланцюга з певною вторинною структурою. В утворенні та стабілізації третинної структури беруть участь різні типи зв'язків між бічними радикалами амінокислотних залишків (водневі, іонні, гідрофобні, тощо).
Водневі зв'язки – слабкі, нековалентні. Вони утворюються між двома електронегативними атомами (різними або однаковими) за участю атома водню, зв'язаного з одним з цих електронегативних атомів ковалентно. Наприклад:
δ- δ+ δ- δ- δ+ δ- δ- δ+ δ-│
-О-Н…О=С- -О…Н-N- -N-H...N-
│ │ │ │ │
H H H H H
Механізм утворення водневих зв'язків – електростатична взаємодія між протилежними частково зарядженими атомами та групами атомів.
Іонні зв'язки утворюються за тим же механізмом між протилежно зарядженими іонізованими кінцевими аміно- і карбоксильними групами:
-СОО-...NH3+-
Дисульфідні зв'язки – ковалентні, утворюються при дегідруванні двох просторово наближених –SH груп в складі залишків цистеїну поліпептидного ланцюга:
-SH + HS- → 2H + -S-S-
Гідрофобні зв'язки утворюються між гідрофобними радикалами амінокислотних залишків. Ці радикали витискуються із зовнішньої гідрофільної зони всередину молекули, де між ними виникають зв'язки.
Характер розташування полярних і неполярних амінокислотних радикалів (на поверхні або всередині білкової глобули) визначає фізико-хімічні та біологічні властивості білків з третинною структурою, зокрема, їх розчинність у воді, здатність до комплексоутворення з ліпідами, вуглеводами чи іншими лігандами.
Виділяють два види третинної структури білків: глобулярну та фібрилярну. Крім цього, існують так звані доменні білки.
Глобулярні білки – це білки, що мають округлу форму (шароподібну чи еліпсовидну), згорнуті в щільну структуру. Вони можуть бути утворені одним або декількома поліпептидними ланцюгами, сполученими дисульфідними зв'язками. До них належать альбумін сироватки крові, міоглобін м'язів, більшість ферментативних білків.
Фібрилярні білки – це білки, структурною особливістью котрих є видовжена форма молекул (довжина молекули більше ніж в 50 разів превищує їх ширину). Такі білки здатні формувати мультимолекулярні ниткоподібні комплекси – фібрили, які складаються з декількох паралельних поліпептидних ланцюгів.
Фібрилярні білки є часто структурними компонентами сполучної тканини або інших опорних тканин організму. Прикладами структурних фібрилярних білків є колаген, еластин, α-кератини покровних тканин.
Доменні білки – це білкові молекули, окремі ділянки поліпептидного ланцюга яких можуть утворювати глобулярні структури (домени). Створюється враження, що такий білок складається з декількох поліпептидних ланцюгів (тобто має четвертинну структуру). Домени сполучені між собою «шарнірними ділянками» поліпептидного ланцюга – ділянками, що легко конформуються. Прикладом доменних білків є ферменти гліколітичного циклу окислення глюкози.
4. Четвертинна структура білків – це об'єднання декількох субодиниць (протомерів), що мають первинну, вторинну і третинну структуру, в єдиний комплекс (олігомерний білок). Як правило, олігомерні білки складаються з парної кількості протомерів (2, 4, 6, 8, 10, 12). Окремі протомери в білках з четвертинною структурою зв'язані між собою нековалентними зв'язками. Це створює можливість їх дисоціації при зміні фізико-хімичних умов середовища (рН, іонної сили розчину, тощо). При такій дисоціації білок втрачає специфічну для нього біологічну активність.
Прикладом білка з четвертинною структурою є гемоглобін еритроцитів, який виконує функцію транспортера кисню в організмі людини і вищих тварин. Молекула гемоглобіну складається з чотирьох попарно однакових субодиниць – двох α- і двох β-поліпептидних ланцюгів в третинній глобулярній структурі. Кожна з таких субодиниць сполучена з небілковою структурою – гемом (похідним порфірину, що містить іон заліза Fe2+), здатним приєднувать молекулу кисню. Умовна формула гемоглобіну: Hb = α2β2.
