
АМІНОКИСЛОТНИЙ СКЛАД БІЛКІВ ТА ПЕПТИДІВ
1. Конктерні цілі:
- Трактувати основні принципи класифікації, номенклатури, будови та властивостей найважливійших -амінокислот як хімічної основи структурної організації білків для подальшого вивчення їх біологічної ролі.
- Аналізувати просторову будову молекул амінокислот, типи їх ізомерії;
- Трактувати хімічні властивості амінокислот в залежності від їх будови;
- Аналізувати значення амінокислот для організму людини у відповідності до їх хімічних властивостей;
- Аналізувати досліджувані біологічні рідини на вміст в них амінокислот за якісними реакціями.
2.Базовий рівень підготовки.
Назва попередніх дисциплін |
Отримані знання, вміння, навички |
1. Біоорганічна хімія |
Знати основні правила систематичної та міжнародної номенклатури; знати класифікацію органічних сполук та будову функціональних груп, характерних для біологічно важливих речовин; знати основні типи ізомерії органічних сполук. знати властивості карбоксильної та аміно-групп. |
2. Фізична та колоїдна хімія |
Знати валентність хімічних елементів та графічні способи зображення будови речовин за допомогою структурних формул; уміти застосовувати знання електронегативності елементів при визначенні зміщення електронної густини в молекулі; знати основні типи хімічних реакцій; знати поняття кислотності та основності. |
3. Організація змісту навчального матеріалу.
Класифікація -амінокислот за:
а) будовою вуглецевого ланцюга;
б) здатністю до синтезу в організмі;
в) полярністю радикалу.
Загальні властивості амінокислот:
а) кислотно-основні;
б) утворення цвіттер-іонів;
в) вплив рН середовища на диссоціацію амінокислот.
Ізоелектрична точка амінокислот.
Специфічні реакції амінокислот в організмі:
а) дезамінування;
б) трансамінування;
в) декарбоксилювання;
г) поліконденсація з утворенням пептидів.
Реакції кількісного визначення амінокислот:
а) формолтитрування за Серенсеном;
б) реакція Ван-Слайка.
До складу природніх білків – біополімерів – входять як мономери залишки приблизно 20 різних α-амінокислот (їх називають протеїногенними). Всі інші амінокислоти в складі тканин тварин, рослин та мікроорганізмів (їх відкрито більше 200) існують у вільному стані та у вигляді коротких пептидів чи комплексів з іншими органічними речовинами.
Амінокислоти – це гетерофункціональні біоорганічні сполуки – похідні карбонових кислот, в складі яких один або декілька атомів водню в радикалі заміщено на аміногрупу. Протеїногені амінокислоти мають аміногрупу в α-положенні і їх структура відображається наступною загальною формулою:

Як випливає з наведеної формули, протеїногенні амінокислоти мають такі структурні особливості:
1) α-атом вуглецю всіх протеїногенних амінокислот (кріме гліцину) зв'язаний з чотирма різними групами та є асиметричним чи хіральним центром молекули. Тому такі амінокислоти є оптично активними, тобто здатні відхиляти площину поляризованого світла.
Всі протеїногенні амінокислоти належать до L-стереохімічного ряду. D-амінокислоти до складу природних білків організму людини не входять, вони зустрічаються в бактеріальних та рослинних клітинах, входять до складу деяких антибіотиків (граміцидин, актиноміцин D). Ферментні системи організму людини зразу окислюють D-амінокислоти, щоб вони не включались в синтез білка та не змінювали його структуру. При цьому D- та L-амінокислоти можуть відрізнятись навіть на смак.
2) Всі протеїногенні амінокислоти належать до α-амінокислот. Деякі протеїногенні амінокислоти (лізин, аргінін) і природні амінокислоти, що не входять до складу білків (орнітин, цитрулін), мають додаткову аміногрупу, разташовану в кінцевому положенні радикалу.
Класифікація амінокислот.
В залежності від будови бічного радикалу природні амінокислоти поділяють на такі класи:
1. Ациклічні амінокислоти, до яких відносять
а) моноаміномонокарбонові амінокислоти;
б) моноамінодикарбонові амінокислоти;
в) диаміномонокарбонові амінокислоти;
г) диамінодикарбонові амінокислоти;
2. Циклічні амінокислот, до яких відносять
а) карбоциклічні (ароматичні) амінокислоти;
б) гетероциклічні амінокислоти:
-з первинною аміногрупою в бічному ланцюзі;
-імінокислоти.
За здатністю до синтезу в організмі людини всі протеїногенні амінокислоти поділяються на три групи:
1. Незамінні амінокислоти (не синтезуються в організмі людини і повинні надходити з продуктами харчування). До них належать валін, ізолейцин, лейцин, лізин, метионін, треонін, триптофан, фенілаланін (всього-8 амінокислот).
2. Замінні амінокислоти (здатні синтезуватись в організмі людини). До них належать аланін, аспарагінова кислота та аспарагін, гліцин, глутамінова кислота та глутамін, пролін, серин, тирозин, цистеїн (всього-10 амінокислот).
3. Частково замінні амінокислоти (не в повному об'ємі). До них належить 2 амінокислоти: аргінін і гістидин.
За полярністю та зарядом бічного радикалу всі амінокислоти можна розділити на 4 групи:
А
 мінокислоти
з неполярним (гідрофобним) радикалом.
мінокислоти
з неполярним (гідрофобним) радикалом.

Аланін Валін

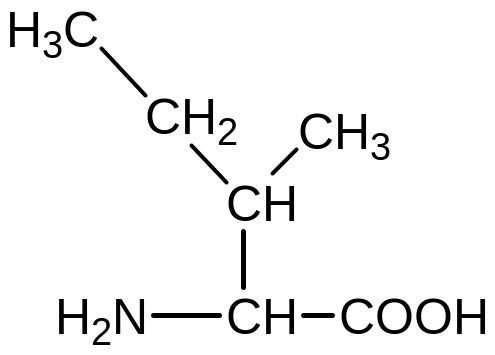
Лейцин Ізолейцин



 Метионін
Фенілаланін
Метионін
Фенілаланін
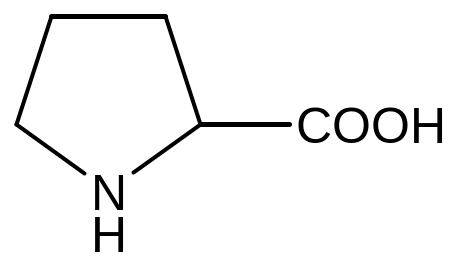
Триптофан Пролін
Амінокислоти з полярним (гідрофільним) незарядженим радикалом.
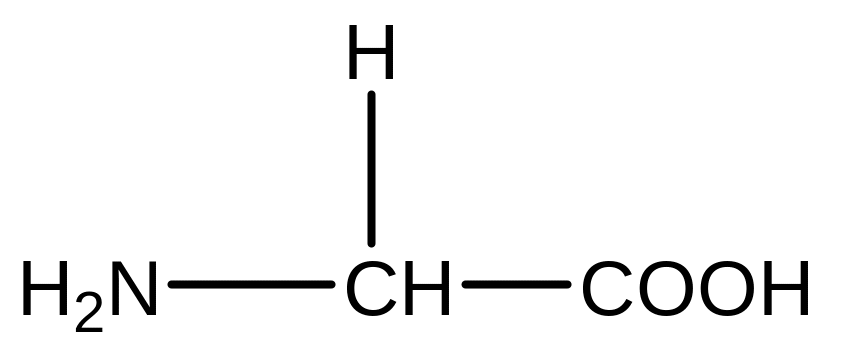
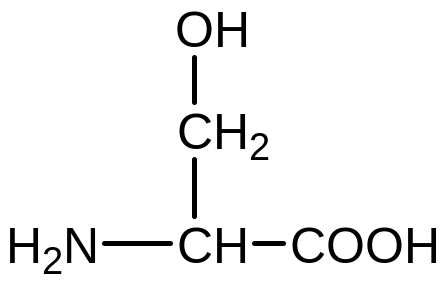

Гліцин Серин

Т
 реонін
Цистеїн
реонін
Цистеїн
Тирозин Аспарагін
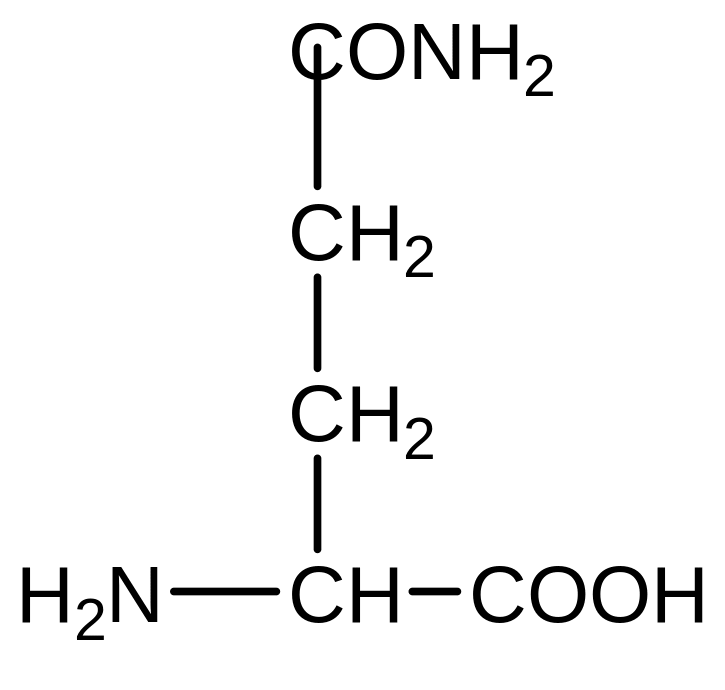 Глутамін
Глутамін
А
 мінокислоти
з негативно зарядженим радикалом
(кислі).
мінокислоти
з негативно зарядженим радикалом
(кислі).
 Аспарагінова
кислота Глутамінова
кислота
Аспарагінова
кислота Глутамінова
кислота
А

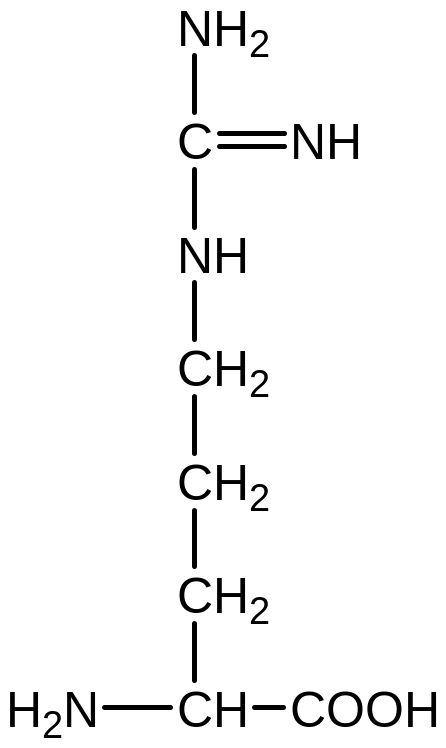
 мінокислоти
з позитивно зарядженим радикалом
(основні).
мінокислоти
з позитивно зарядженим радикалом
(основні).
Лізин Аргінін Гістидин
