
- •Аналитикалық химия пәні, оның ғылыми зерттеулердегі және өндірістік практикадағы орны. Аналитикалық химия әдістерінің жіктелу түрлері.
- •Аналитикалық реакциялардың мінездемелері. Олардың орындалу жолдары.
- •Аналитикалық катиондарды бөлшектеп және жүйелеп талдау.
- •Катиондардың қышқылдық-негіздік жіктелуі. Топтық реагенттің әсері. Түзілген тұнбалардың ерігіштігі.
- •Күшті және әлсіз электролиттер. Гомогенді жүйедегі химиялық тепе-теңдіктер
- •Гомогенді тепе-теңдік тұрақтылары – термодинамикалық, концентрациялық, шартты.
- •Күшті қышқыл және күшті негіз ерітінділерінің рН есептеу
- •Әлсіз қышқыл және әлсіз негіз ерітінділерінің рН есептеу
- •Тотығу-тотықсыздану реакциялары.Тотығу-тотықсыздану потенциалы. Нернст теңдеуі. Тотығу-тотықсыздану реакцияларының тепе-теңдік константалары.
- •1) Тотықтырғыш пен тотықсыздандырғыш анықтап алу керек. Ол үшін типті тотықтырғыш пен тотықсыздандырғыштың тізімін пайдалану керек.
- •4) Ттр теңдеуіндегі коэффициенттер электрондық және электронды-иондық баланс арқылы анықталады.
- •Тотығу-тотықсыздану реакцияларының аналитикалық химиядағы сапалық талдауда пайдаланылуы. Күшті тотықтырғыштар мен тотықсыздандырғыштар.
- •Аналитикалық химиядағы комплекс түзу реакцияларының сапалық талдауда қолданылуы.
- •Аниондардың әртүрлі қасиеттеріне қарай жіктеліну түрлері. І-ііі топ аниондары
- •Ерігіштік және оның есептелуі. Тұнбаның еруіне әсер ететін факторлар.
- •Сандық талдау, оның түрлері, қолданылу салалары. Гравиметриялық талдау, әдістің артықшылығы және кемшілігі.
- •Титриметриялық талдау, оның түрлері. Титриметриялық талдауда қолданылатын реакцияларға қойылатын талаптар. Аналитикалық талдауда жиі қолданылатын ерітінді концентрацияларының есептеу жолдары
- •Титрлеу қисығын тұрғызу және оны талдау. Күшті қышқылды күшті негізбен титрлеуде ерітіндінің рН-ның өзгеруі (және керісінше).
- •Титрлеудің соңғы нүктесін анықтау әдістері. Қышқыл-негіздік индикаторлар. Индикаторлардың түсінің ауысу интервалы. Индикатор қателігі.
- •Комплексонометриялық титрлеу. Металл комплексонаттардың тұрақтылығына рН әсері. Тура және кері титрлеу. Металлохромды индикаторлар
- •Физика-химиялық талдау әдістері, электрохимиялық талдау әдістерінің жіктелуі. Потенциометрия.
- •Потенциометрлік титрлеу, эквивалентті нүктені анықтау жолдары.
Потенциометрлік титрлеу, эквивалентті нүктені анықтау жолдары.
Потенциометрлік титрлеу Эквиваленттік нүктені табуға негізделген титрлеу реакциясына қатынасқан қосылыстың тек біреуі ғана электродты құбылысқа араласатын болғанда, эквиваленттік нүктенің маңында индикаторлы электродтың потенциалы өзгереді. Айталық қышқылды - негізді әдіс бойынша титрлегенде, шыны электродын хлоридті хлор-күміс арқылы жүзеге асырады. Мұндағы реакциялар тез өтіп, соңына дейін толық жүреді. Жалпы потенциометрлік титрлеуді жүргізу үшін талданатын ерітіндідегі индикаторлы электрод пен салыстыру электродынан тұратын тізбекті жинақтайды.
Соңғы нүктені анықтау. Суретте титрлеу қисықтары мысал ретінде келтірілген.
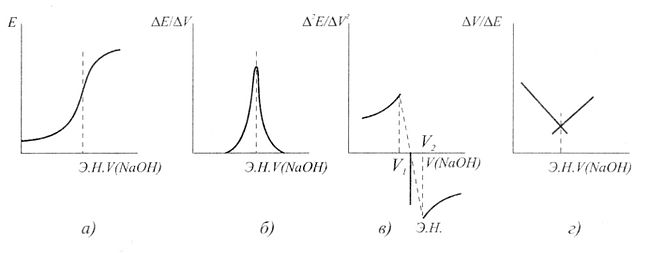
Осы суретте (а) тұз қышқылын калий гидроксидімен, яғни күшті қышқылды күшті негізбен титрлеудің кисығын теориялық тұрғыдан кескінделген. Мұндағы эквивалент нүкте индикаторлыэлектрод потенциалының кенеттен секіруіне байланысты. Бұл секіру эквивалент нүктені анықтайды, осыған қарап талданатын ерітінді құрамындағы қышқыл концентрациясы есептелінеді.
Екінші (б) суретте эквивалентті нүктені табу үшін AE/Av - V координатында дифференциалды қисық сызылады, ал абсцисса өсіндегі есептеу титрант көлемін көрсетеді. Дифференциалды қисық көмегімен эквивалент нүктені нақтылы тауып, дәл есептеуге болады.
Потенциометрлік титрлеу әдісі бойынша талдаулық әр түрлі физика-химиялық мәселелер шешіледі: ерітіндідегі бір не бірнеше заттардың концентрациясын анықтау; әлсіз негіздер мен қышқылдардың диссоциациялану тұрақтысын табу; кешенді қосылыс тұрақтысын анықтау; ерігіштік көбейтіндісін анықтау; қалыпты тотығу-тотықсызданудың потенциалын табу.
Потенциометрлік титрлеу әдістері реакция түріне байланысты тұнбалау, кешенді қосылыс түзу, тотығу-тотықсыздану, бейтараптау әдісі болып бөлінеді.
Потенциометрлік титрлеуді суы бар және сусыз, әрі аралас ерітінділерге қолданады. Алайда, органикалық еріткіштердің ерітінді құрамында кездесуі диффузиялық потенциалды дәл анықтауға мүмкіндік бермейді де, мұның салдарынан термодинамикалық өлшемдерді анықтау қиындайды. Қышқылдық-негіздік титрлеу. Егер қышқылдың немесе негіздің диссоциация тұрақтысындағы айырмашылық үш реттілік шамасынан кем болмаса, қышқыл қоспасындағы құрамдас бөліктерді сапалық тұрғыдан, қышқылдық-негіздік титрлеу әдісі арқылы анықтауға болады. Мысалы, тұз және сірке қышқылының қоспасын негізбен титрлегенде екі секіру байқалады. Ал көп негізді қышкылдар мен негіздерді титрлегенде, оларға сәйкес болатын потенциал секіруінін санын титрлеу қисығынан анықтауға болады. Бұған үш негізді фосфор қышқылын күшті негізбен титрлеу мысал.
Оптикалық талдау әдістері. Бугер-Ламберт-Бер заңы. Фотоколориметрия мен спектрофотометрия әдістерінің ерекшелігі, қолданылу саласы
Оптикалық әдістер жарықтың электромагнитті шашырауына негізделеді. Электромагнитті шашырау фотон санына байланысты. Осыған орай бұл әдістер мына топтарға жіктеледі:
Физикалық құрылымы |
Әрекеттесу деңгейі |
|
атом |
молекула |
|
Спектральды әдістер |
||
Жарықтың жұтылуы (абсорбция) |
Атомды абсорбциялық әдіс (ААӘ) |
Молекулалы абсорбция әдісі: фотоколориметрия, спектрофотометрия |
Жарықтың шашырауы (эмиссия) |
Атомды эмиссионды спектроскопия АЭС |
Молекулалы эмиссионды спектроскопия МЭС люминесценция |
Екіншілік эмиссия |
Атомды –флюрресцентті спектроскопия АФС |
Молекулалы –флюрресцентті спектр-я МФС |
Жарықтың шашырауы |
- |
Шашырау спектроскопиясы (нефилометрия, турбидиметрия) |
Жарықтың сынуы |
- |
Рефроктометрия |
Жарықтың айналуы |
- |
Поляриметрия |
Спектроскопиялық әдістерді қолданған кездеүнемі комплексті қосылыстар зерттеледі. Комплексті қосылыстар 380 -760 нм жарық толқынының аралығында қарастырылады. Осыған байланысты оптикалық әдісті фотоколориметрия, спектрофотометрия деп бөлінеді.
Оптикалық |
|
фотоколориметрия |
спектрофотометрия |
Ерітінді түсі: түсті |
түссіз |
Фильтрді таңдау аймағы: 380 -760нм |
200 -3000нм |
Хим.реакция жүру механизмі: түсті фотометриялық р-сы |
Түссіз, рН-қа байланысты электролит нәт.аналитикалық реакциясы |
Аналитикалық шегі: 10-1 -10-5 |
10-1-10-7; 10-1-10-6 |
Барлық спектроскопиялық әдістер жарықтың табиғаты арқылы өрнектеледі. Егер де біз түскен жарықтың қарқындылығы І деп белгілесек, жарықтың негізгі заңдылығын былай түсіндіреді.
т үскен
қарқындылық белгілі қалыңдықтан өтіп
қандай да бір төменгі қарқындылыққа ие
болады. Осы жағдайдағы
үскен
қарқындылық белгілі қалыңдықтан өтіп
қандай да бір төменгі қарқындылыққа ие
болады. Осы жағдайдағы

Ламберт –Бер заңы
К-жұтылу коэф, l-кювета қалыңдығы
І0-түскен қарқындылық, It-шыққан қарқындылық, (-)-жарық қарқынының төмендегенін көрсететін мән.
Осы теңдеуді алғаш қорытындылаған Бугер –Ламберт.
Кейіннен жарықтың әр түрлі қасиетін ескере отырып Бер мынадай K=K’C түзету енгізді. С-ерітінді концентрациясы, К*-жарықтың жұтылу коэф.әр түрлі толқын ұзындығына байл. Екі ғалым бірігіп аналитикалық мақсатта мынадай қорытындыға келген:
С
;
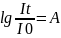 A=klC
;
егер l=1cm,
C=1моль/л
A=klC
;
егер l=1cm,
C=1моль/л
А=ε*С*l –БУГЕР-ЛАМБЕРТ-БЕР заңы
