
- •Список сокращений
- •Введение
- •Глава 1. Литературный обзор реакции нуклеофильного присоединения природных циклических a,b-еноновых монотерпеноидов
- •Использование продуктов 1,2-присоединения металлоорганических реагентов к α,β-еноновым монотерпеноидам
- •Глава 2. Обсуждение результатов
- •Оптически чистый синтон для полового феромона сосновых пилильщиков рода Diprion и Neodiprion
- •Глава 3. Экспериментальная часть
- •Методы подготовки реагентов и растворителей
- •Методика проведения реакций 1,2-присоединения металлорганических реагентов к (r)-4-ментенону
- •(2S)-метилдец-1-илбромидов
- •Литература
Глава 2. Обсуждение результатов
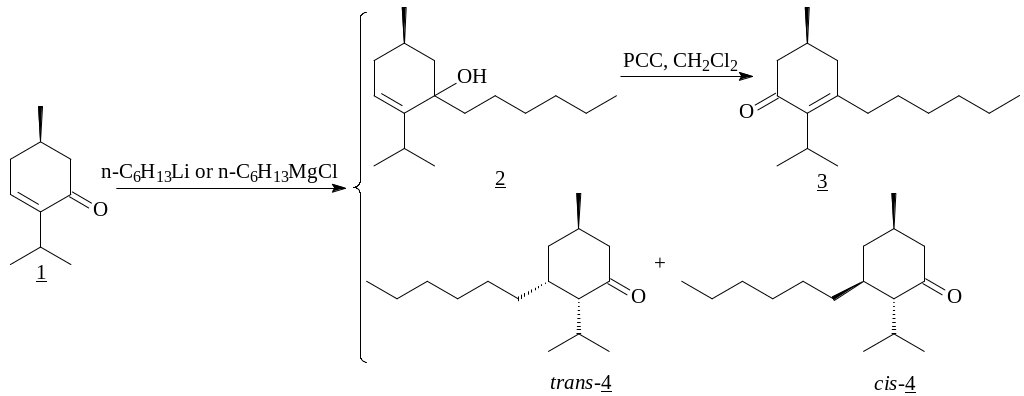
Оптически активные монотерпеновые сопряженные циклические еноны, входящие в состав эфирных масел, широко используются при получении более сложных структур, многие из которых обладают биологической активностью. Одним из таких перспективных соединений является (R)-4-ментен-3-он(1), получаемый в результате несложных трансформаций l-ментола [50] (ее~100%), выделяемого из масла перечной мяты в стадии цветения. Наличие сопряженной еноновой системы открывает широкие перспективы для участия оптически чистого ментенона в реакциях присоединения. Кроме того, в его структуре имеется оптический центр, который в ходе реакции не затрагивается.
Нами были проведены работы по расширению синтетического потенциала данного хирального енона с использованием в качестве основополагающих реакций 1,2- и 1,4-присоединение нуклеофильных реагентов и дальнейшей фрагментации полученных соединений. Для проведения реакций нуклеофильного присоединения нами были использованы реактивы Гриньяра и литийорганические соединения. Ранее было показано, что (R)-4-ментенон в обычных условиях проявляет инертность в реакции 1,4-присоединия реактива Нормана. Поэтому с целью изучения способности енона вступать в реакции 1,2- и сопряженного 1,4-присоединения с металлоорганическими соединениями была осуществлена серия экспериментов, где варьировались реагенты, катализаторы, а также температурный режим процесса.
1,2- И 1,4- ПРИСОЕДИНЕНИЕ МЕТАЛЛООРГАНИЧЕСКИХ РЕАГЕНТОВ RX (R= Не; X= -MgСl; -Li) К (R)-4-МЕНТЕНОНУ
Комплексного изучения свойств монотерпеноида (R)-4-ментен-3-она ранее не проводились. Наличие сопряженной еноновой системы предполагает возможность проведения реакций с металлоорганическими реагентами.
Нами было решено ввести в еноновую систему (R)-4-ментенона с помощью реакций 1,2-и 1,4-присоединения гексильную группу с целью дальнейшего использования продуктов присоединения в целенаправленном синтезе низкомолекулярных биорегуляторов насекомых.
Ранее было известно, что как реактивы Гриньяра, так и литийорганические соединения при низких температурах приводят к образованию продукта 1,2-присоединения для сопряженных еноновых систем. Первым примером в данном направлении явилась конденсация енона(1) с n-C6H13MgCl и n-C6H13Li. На самом деле при проведении реакций с n-C6H13MgCl и n-C6H13Li при -78°C получили преимущественно 1,2-аддукт.
Окисление полученного третичного аллилового спирта (2) сопровождается аллильной перегруппировкой, результатом которой является β-замещенный сопряженный енон (3).
№ опыта |
металлоорг. |
t , oC |
р-ль |
kat. |
Соотношение продуктов |
Конвер сия, % |
||
3 |
trans-4 |
cis-4 |
||||||
1. |
n-C6H13Li |
-78 |
n-C6H14 |
- |
17 |
1 |
0 |
44 |
2. |
n-C6H13Li |
0 |
n-C6H14 |
- |
1 |
6 |
4 |
63 |
3. |
n-C6H13Li |
∆ |
n-C6H14 |
- |
3 |
4 |
1 |
79 |
4. |
n-C6H13MgCl |
-78 |
THF |
- |
5 |
1 |
1 |
15 |
5. |
n-C6H13MgCl |
0 |
Et2O |
- |
4 |
2 |
1 |
92 |
6. |
n-C6H13MgCl |
∆ |
THF |
- |
2 |
1 |
1 |
66 |
7. |
n-C6H13MgCl |
-78 |
THF |
CuI BF3∙Et2O |
0 |
1 |
1 |
98 |
Повышение температуры проведения реакции в случае n-C6H13MgCl способствовало увеличению продукта 1,4-присоединения. В случае же n-C6H13Li повышение температуры проведения реакции с непосредственным присутствием ментенона при получении металлоорганического реагента (in situ) приводит к термодинамически более выгодному продукту 1,4-присоединения (trans-4), (cis-4), причем преобладающим во всех случаях является trans-изомер, что согласуется с известными данными, когда -алкильный заместитель в сопряженном циклогексеноне ориентирует входящую -группу преимущественно в trans-положение.
Однако проведенные реакции 1,4-присоединения металлоорганических реагентов к еноновой системе ментенона прошли нерегиоселективно, в реакционной массе присутствовал и 1,2-аддукт. Поэтому нами была использована способность комплексов медьорганических реагентов с кислотами Льюиса, увеличивающих поляризацию сопряженных енонов за счет образования комплексов с кислородом карбонильной группы, и, следовательно, особенно эффективно катализировать 1,4-алкилирование. Наиболее известен тандем эфират трехфтористого бора - CuI, применяемый при низких температурах. В результате его использования нами был получен 3-гексилментон (trans-4), (cis-4), в котором соотношение trans : cis изомеров, согласно капиллярной ГЖХ, составил 1:1.
Таким образом, варьирование металлоорганических реагентов и условий проведения реакций показало, что в случае еноновой системы ментенона для гексильного металлоорганического реагента региоселективное 1,2-присоединеие происходит в случае использования n-C6H13Li при низких температурах. В случае n-C6H13MgCl при всех температурных режимах проведения реакции преимущественно образовывается 1,2-аддукт. Региоселективно 1,4-аддукт образуется при использовании тандема эфират трехфтористого бора – CuI. То есть закономерности присоединения гексилпроизводных металлоорганических реагентов, выявленные для аналогичных еноновых систем для (R)-4ментен-3-она не соблюдаются.
Полученный продукт 1,2-присоединения (S)-3-гексилментенон (3) был использован далее в целенаправленном синтезе хиральных синтонов
