
- •Список сокращений
- •Введение
- •Глава 1. Литературный обзор реакции нуклеофильного присоединения природных циклических a,b-еноновых монотерпеноидов
- •Использование продуктов 1,2-присоединения металлоорганических реагентов к α,β-еноновым монотерпеноидам
- •Глава 2. Обсуждение результатов
- •Оптически чистый синтон для полового феромона сосновых пилильщиков рода Diprion и Neodiprion
- •Глава 3. Экспериментальная часть
- •Методы подготовки реагентов и растворителей
- •Методика проведения реакций 1,2-присоединения металлорганических реагентов к (r)-4-ментенону
- •(2S)-метилдец-1-илбромидов
- •Литература
СОДЕРЖАНИЕ
Список сокращений…………………………………………………………….. |
3 |
Введение………………………………………………………………………….. |
5 |
Глава 1. Литературный обзор…………………………………………………... |
6 |
Реакции нуклеофильного присоединения природных циклических α¸β-еноновых монотерпеноидов |
|
1.1. 1,2- и 1,4- присоединение металлоорганических реагентов. Общие положения………………………………………………………………………... |
6 |
1.2. Использование продуктов 1,2-присоединения металлоорганических реагентов к α¸β-еноновым монотерпеноидам………………………………….. |
19 |
Глава 2. Обсуждение результатов……………………………………………… |
29 |
Глава 3. Экспериментальная часть……………………………………………... |
35 |
Вывод……………………………………………………………………………... |
42 |
Литература……………………………………………………………………….. |
43 |
Список сокращений
Ac - ацетил
Ac2O – уксусный ангидрид
AIBN – азоизобутиронитрил
Am – амил
Bz – бензоил
Bu – бутил
m-CPBA – м-хлорнадбензойная кислота
DBU - 1,8-диазобицикло[5.4.0]ундец-7-ен
DCM - дихлорметан
DCC - дициклогексилкарбодиимид
DMAP - 4-N,N-диметиламинопиридин
DMF - диметилформамид
Et - этил
HMDS - гексаметилдисилилазид
HMPA – гексаметилфосфортриамид
hν – ультрафиолетовое излучение
LAH - лития алюмогидрид
LDA - лития диизопропиламид
LHMDS – литийгексаметилдисилазид
Me - метил
NBS - N-бромсукцинимид
PCC - пиридиния хлорхромат
Ph – фенил
Pr - пропил
p-TSA – п-толуолсульфонамид
Py – пиридин
r.t. - комнатная температура
TBDMS - трет-бутилдиметилсилил
THF - тетрагидрофуран
TMS – триметилсилил
Ts - р-толуолсульфонил (тозил)
W-лампа – вольфрамовая лампа
Введение
В состав эфирных масел входят оптически активные монотерпеновые сопряженные циклические еноны. Их используют при получении более сложных структур, которые проявляют биологическую активность. Однако, часто предлагаемые методы синтеза не находят дальнейшего применения из-за высокой стоимости субстрата. Поэтому актуальным является поиск доступных оптически чистых соединений. Одним из таких соединений является (R)-4-ментен-3-он, получаемый путем несложных превращений из l-ментола, который редко использовался в органическом синтезе до настоящих дней [1].
При проведение озонолиза (R)-4-ментенона стало известно, что двойная связь более реакционноспособна в отличие от других еноновых систем, что связано, по-видимому, со значительным +I -эффектом i-Pr-группы. В связи с этим представляет интерес реакции нуклеофильного присоединения в (R)-4-ментеноне. Полученные производные открывают выход к оптически чистым хиральным соединениям.
Глава 1. Литературный обзор реакции нуклеофильного присоединения природных циклических a,b-еноновых монотерпеноидов
Интерес к природным монотерпеноидам связан с тем, что наряду с двойной связью они содержат и сопряженную с ней карбонильную группу. Самыми распространенными соединениями данного класса, являются карвон (1), пулегон (2), пиперитон (3), ментенон (4), каренон (5), вербенон (6).
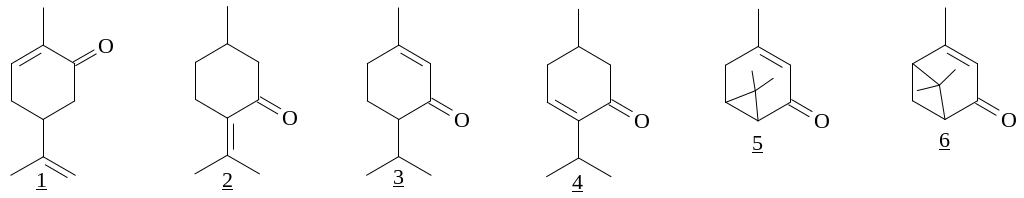
Наличие сопряженной еноновой системы в природных монотерпеноидах позволяет вводить их в разнообразные химические реакции с различными реагентами. Среди них наиболее интересными являются металлоорганические реагенты. Они способны вступать в реакцию присоединения как в 1,2-, так и в 1,4-положение сопряженной a,b-еноновой системы, что позволяет получать аддукты для синтеза различных природных соединений. Однако, довольно сложно предсказать по какому из путей пойдет процесс. Хотя имеются некоторые данные, позволяющие сделать определенные обобщения.
1,2- И 1,4- ПРИСОЕДИНЕНИЕ МЕТАЛЛООРГАНИЧЕСКИХ РЕАГЕНТОВ. ОБЩИЕ ПОЛОЖЕНИЯ
Большое значение имеет способность металлорганических реагентов присоединяться как в 1,2-, так и в 1,4-положение a,b-енонов, поскольку модификацией реагентов и условий взаимодействия можно направить реакцию предпочтительно по одному из двух возможных путей. Для этих целей чаще всего на практике используются реактивы Гриньяра, литий - и медьорганические соединения. В зависимости от условий проведения реакции, реактивы Гриньяра могут давать как 1,2-, так и 1,4-аддукты. RLi-реагенты преимущественно дают продукты 1,2-присоединения, а наилучшими реагентами для 1,4-алкилирования сопряженных циклических енонов являются органические купраты.
Использование литийорганических соединений в отличие от реактивов Гриньяра предпочтительнее, так как литийорганические соединения более реакционноспособны и, вследствие чего, конечные продукты получаются с более высокими выходами. Для них легче подобрать растворитель, в отличие от магнийорганических реагентов, для которых необходимы более полярные растворители. Кроме того, литийорганические реагенты более активны и менее склонны к реакциям восстановления и енолизации, а также менее чувствительны к стерическому влиянию в отличие от реактивов Гриньяра. Одно из важнейших отличий литийорганических соединений от реактивов Гриньяра в том, что они образуют исключительно 1,2-аддукты при взаимодействии с α,β-енонами [1, 2].
В работе Dikusar E.A. и сотрудников исследовалось поведение соединений с сопряженной еноновой системой, а именно, вербенона (6) и соединений содержащих только кето-группу, таких как адамантанон (7) и вербанон (13). Эти субстраты были вовлечены в реакцию с ацетиленидом лития. В результате были образованы третичные спирты (8, 14, 17). В дальнейшем, как выяснилось, выход третичного спирта, полученного из вербенона (6) превышает выход тех спиртов, которые были получены из адамантанона (7) и вербанона (13). Дальнейшее вовлечение ацетиленида вербенола (17) в реакции не было целесообразным, поскольку при взаимодействии с нитратом диамминосеребра [Ag(NH3)2]NO3 образовывался неустойчивый продукт, который распадается с выделением энергии. Введение (17) в синтез с уксусным ангидридом, привело вместо ожидаемого ацетата, к трудноразделяемой реакционной смеси [3].
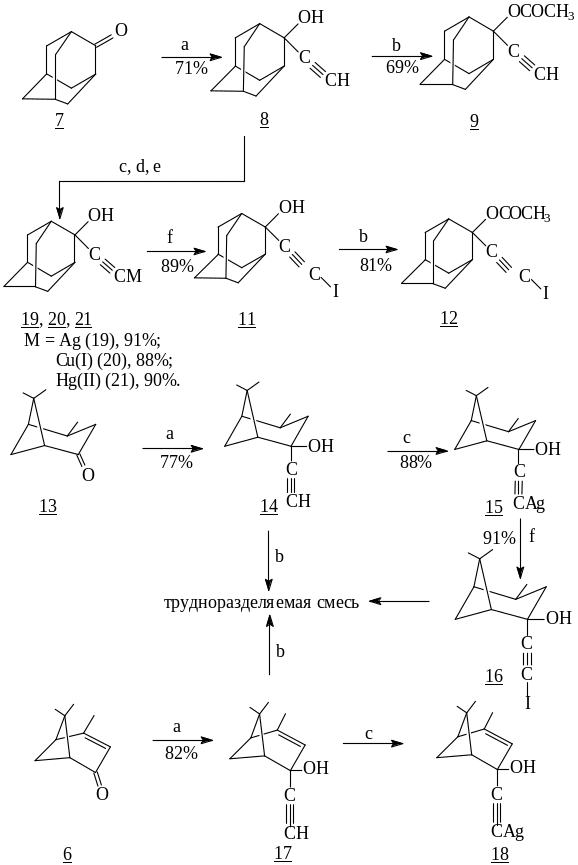
Реагенты: а) HC≡CLi; b) Ac2O; c) [Ag(NH3)2]NO3; d) CuCl; e) K2[HgI4]; f) I2;
В реакции карвона (R)-1 с 4-бромобутенлитием наблюдается регио- и стереоселективное 1,2-присоединение с образованием третичного аллильного спирта и последующим его окислением Cr(VI). При этом процесс сопровождается аллильной перегруппировкой с образованием -замещенного сопряженного енона (22) [4, 5].
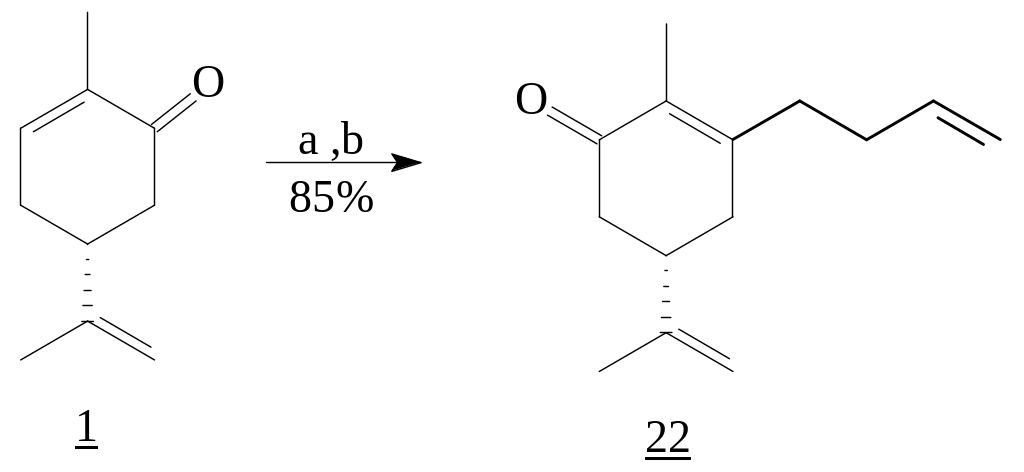
Реагенты: а) Li, BrCH2CH2CH=CH2, THF, 1h; b) PCC, CH2Cl2.
Комплекс ацетиленида лития с этилендиамином приводит к образованию продукта 1,2-присоединению (23) при взаимодействии с (R)- карвоном (1) [6].
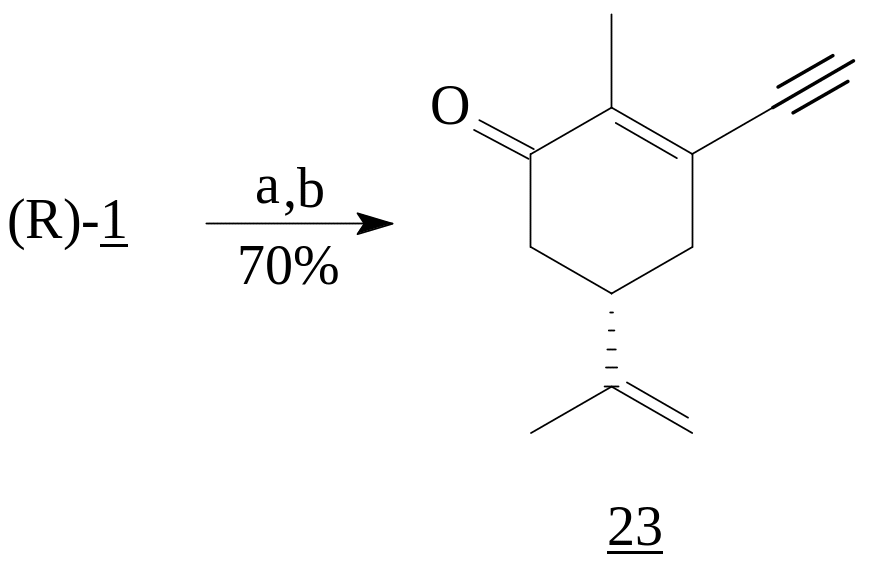
Реагент: а) HC≡CLi·C2H4(NH2)2, THF; b) PCC, CH2Cl2.
Взаимодействие 6,6-диметилкарвона (24) с MeLi при пониженной температуре также привело к 1,2-присоединению и образованию третичного спирта, окисление которого дало триметилкарвон (26) [7, 8]. Подобная картина наблюдается и в случае использования реактива Гриньяра, но уже время проведения реакции увеличивается [9].
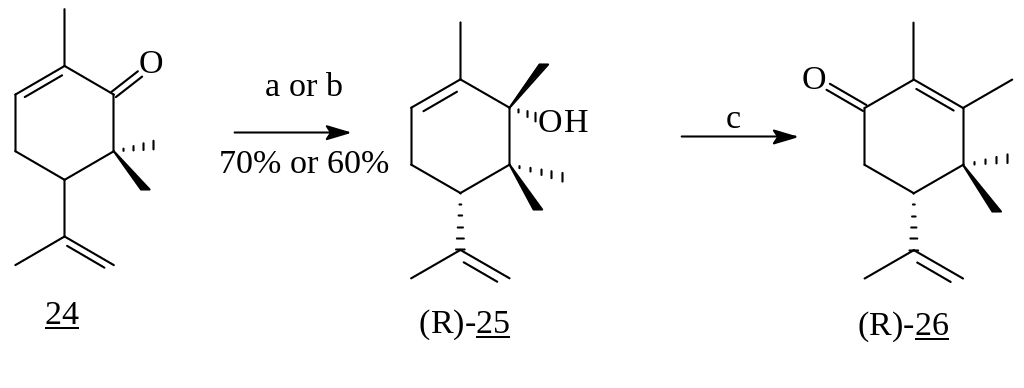
Реагенты: а) MeLi, 0°C, 1h; b) MeMgJ, Et2O, 0°C, 12h; с) PCC, CH2Cl2;
Проведенные исследования Scott T. H. и Duncan Omune показали, что в случае использования эквимолярного соотношения реагентов
присоединение к (27) идет только по одной сопряженной еноновой системе. С избытком реагентов алкилирование идет по обеим сопряженным системам [10].
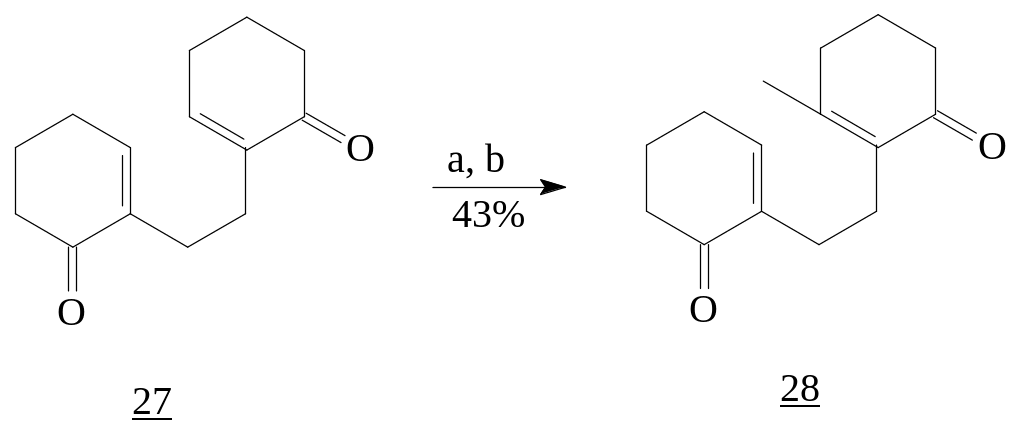
Реагенты: а) MeLi (1экв.), Et2O, -20°C; b) PCC, CH2Cl2.
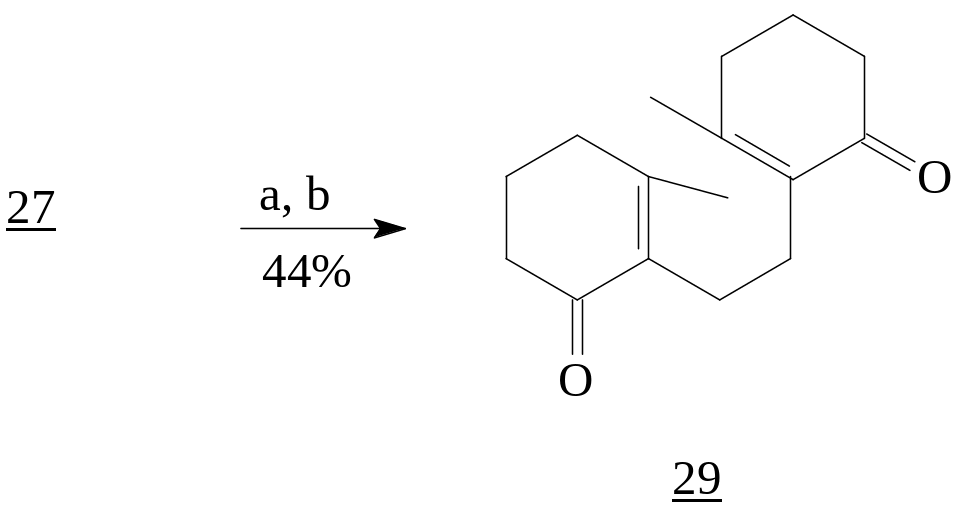
Реагенты: а) MeLi (изб.), Et2O, -20°C; b) PCC, CH2Cl2.
1,2-Присоединение фениллития, синтезированного переметалированием из PhBr и t-BuLi, к 2-метилциклопентенону (30) с последующим эпоксидированием и перегруппировкой привело к образованию 2-метил-2-фенилциклопентан-1,3-диону (32) [11, 12], аддукту реакции Торгова.
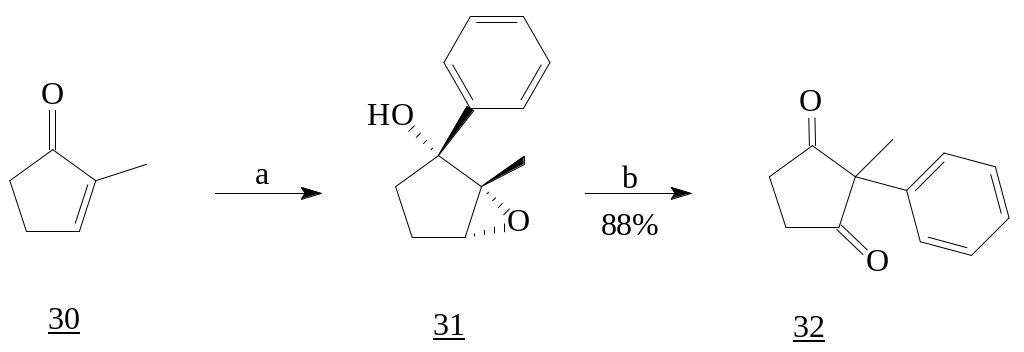
Реагенты: а) PhBr, t-BuLi (2eq.), -78ºC; m-CPBA, DCM, 0ºC; b) BF3·OEt2, DCM, -40ºC; PCC, DCM, 22ºC.
Необходимо отметить, что в присутствии литийдиизопропиламида (LDA) алкилирование происходит в α-положение относительно карбонильной группы [13, 14, 15, 16, 17].
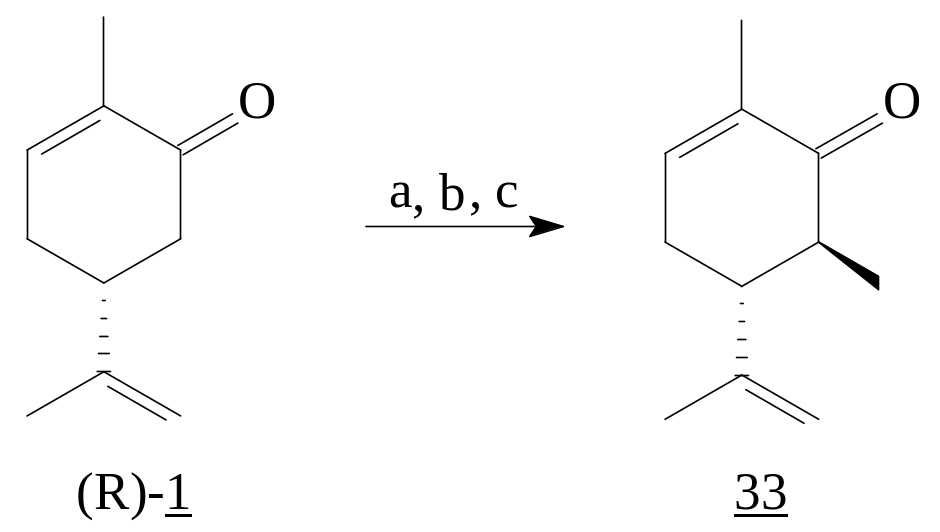
Реагенты: а) LDA, MeI, THF; b) DBU; c) перекристаллизация.
S. Tanis и сотрудники использовали в качестве реагента 1,2-присоединения MeSCH2Li [18]. Последовательным его взаимодействием с циклогексеноном (34) с образованием гидроксисульфида (35), последующим S-метилированием MeI и циклизацией был получен эпоксид (37), который интересен как бис-электрофильное соединение. Реакция бис-электрофилов с бис-нуклеофильным реагентом представляет собой интересный подход к трициклическим продуктам, которые являются ключевыми синтонами в синтезе биологически активных природных соединений [19].
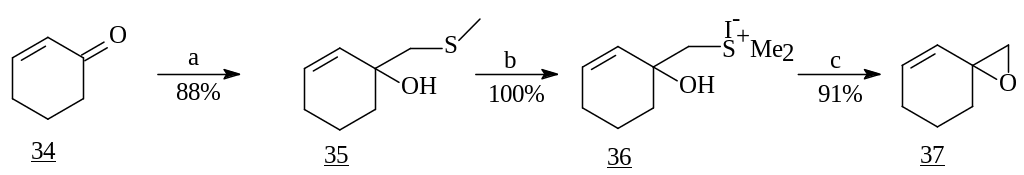
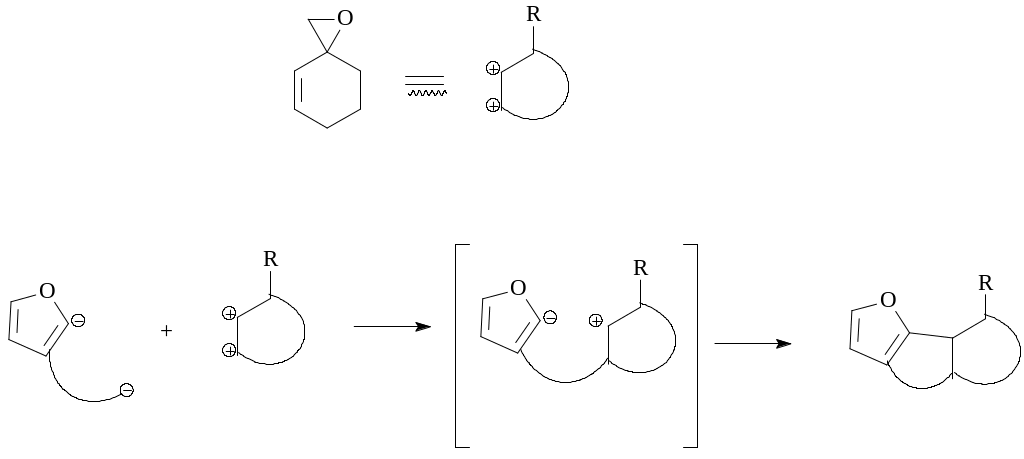
Реагенты: a) MeSCH2Li, -78°С; b) MeI; c) KOBut-THF.
Использование данной методики для енона (S)-(1) привело к смеси эпоксидов (38) и (39) в соотношении 4.5:1, в то время как S-(+)-пиперитон (3) дал один изомер (40) с выходом 90%.
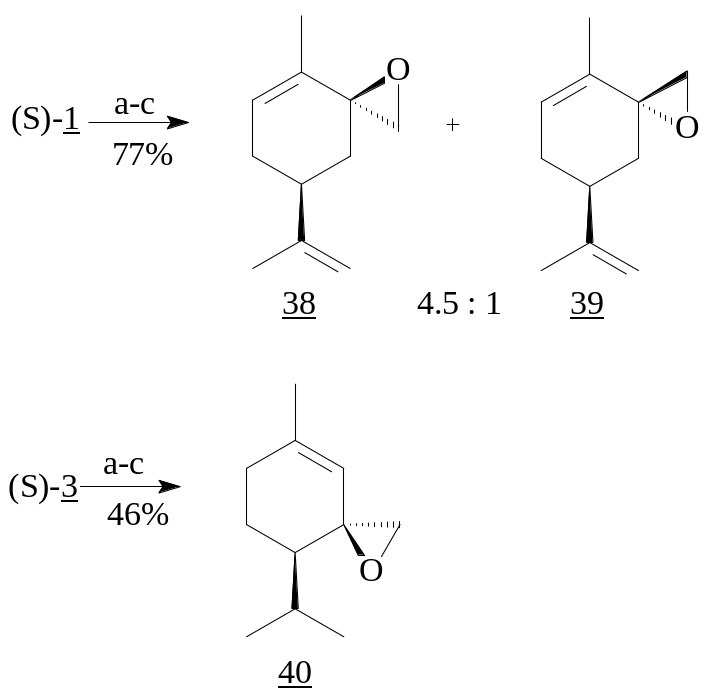
Реагенты: a) MeSCH2Li; b) MeI; c) KOBut-THF
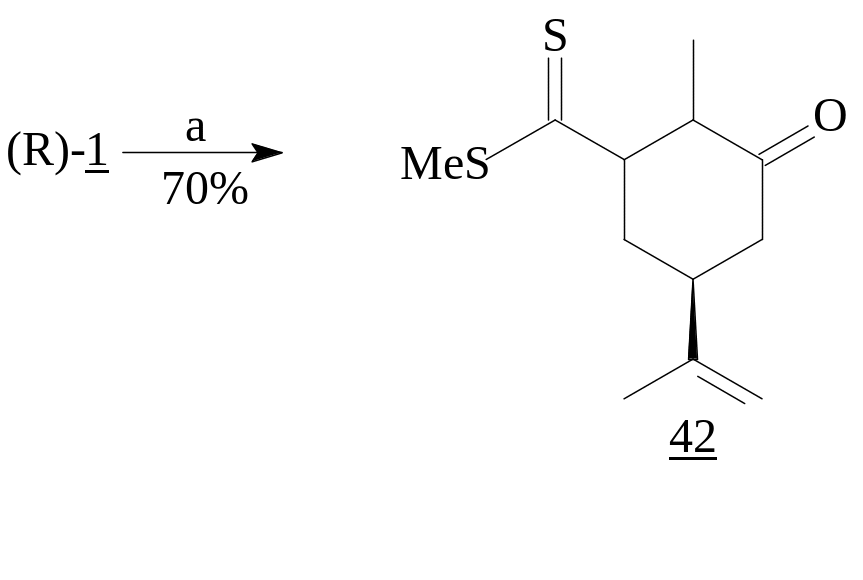
Если обычные RLi-реагенты преимущественно дают продукты 1,2-присоединения, то CH2=C(SMe)SLi, получаемый из метилдитиоацетата, приводит к 5-оксодитиоэфирам - продуктам 1,4-присоединения, используемым в синтезе 6-членных циклов [20]. Соединения же (41) и (42) являются предшественниками бициклов.
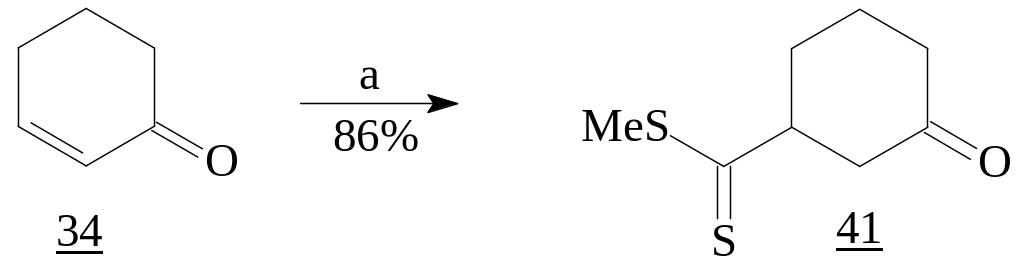
Реагенты:
a)
 ,
LDA; NH4Cl,
H2O.
,
LDA; NH4Cl,
H2O.
1,4-Присоединение Li-енолята к 4-гидроксициклогексенону (43) в зависимости от температурного режима идет с образованием различных изомеров. Таким образом, получают метиловые эфиры 3-оксо-6-OTBS-циклогексанкарбоновых кислот (trans-(45), cis-(45) ) и бициклические кетолактоны (trans -(46) и cis -(46) ) [21].
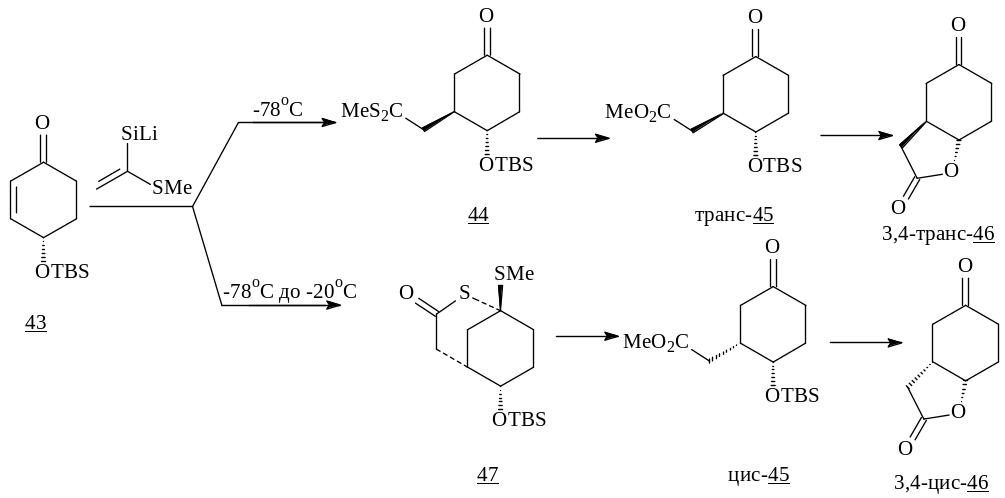
Проведение реакции в присутствии HMPA позволяет сменить направление 1,2-присоединения на 1,4-присоединение [22, 23]. Так, например, присоединение Me3SiLi в THF-HMPA (5:1) к 2-циклогексенону (34) приводит к 1,4-аддукту.
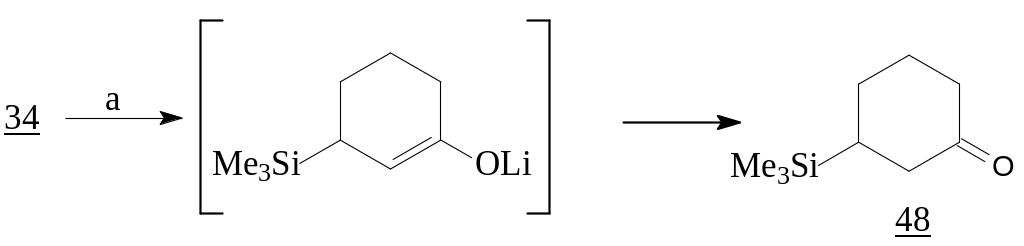
Реагенты: a) Me3SiLi, THF-HMPA, -78°C.
При присоединении к сопряженной еноновой системе реактива Гриньяра могут образовываться как 1,2- так и 1,4 – аддукты, в зависимости от условий проведения реакции. Кинетически контролируемое присоединение магнийорганического реагента при низких температурах способствует образованию 1,2-аддукта, тогда как повышение температуры проведения реакции, приводит к преимущественному образованию продукта 1,4-присоединения.
Нуклеофильное присоединение винилмагнийбромида к (R)-карвону (1) при температуре -78°C ведет к образованию третичного спирта (49). Присоединение всегда протекает по аксиальному направлению с образованием trans- аддукта как основного изомера [25].
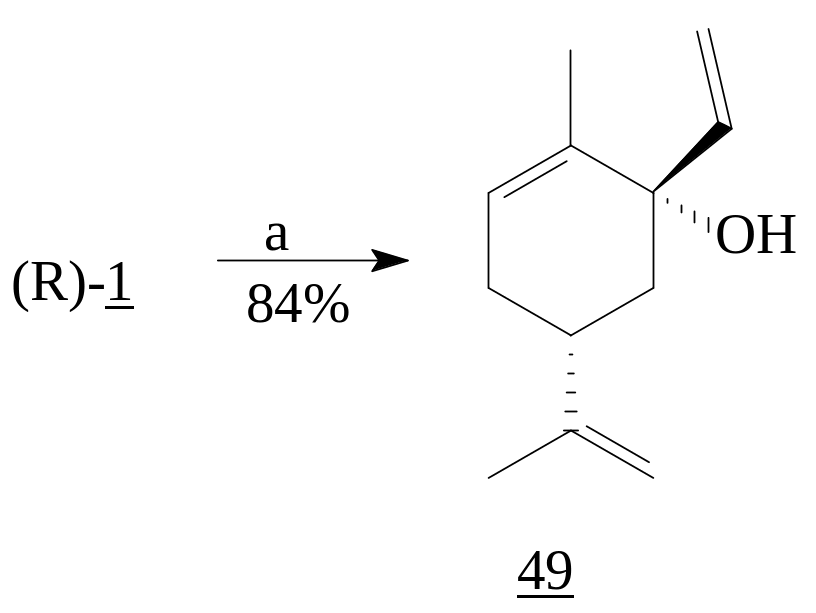
Реагенты: а) CH2=CHMgBr, THF, -780С.
На ход реакции влияет и строение органического радикала. Так, присоединение аллил, кротил, 3-метилбут-2-енильных производных при температуре -15°C идет регио- и стереоселективно по 1,2-пути [26].
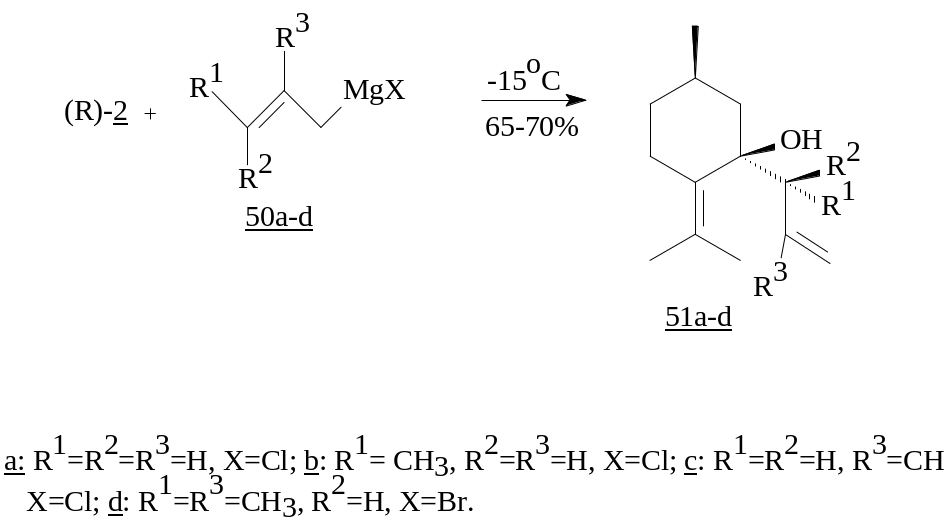
1,2-Присоединение реактива Гриньяра при низких температурах, наблюдается и при взаимодействии (R)-карвона (1) с фенилмагний бромидом, последующее окисление третичного спирта дает фенилзамещенный продукт (53) [27].
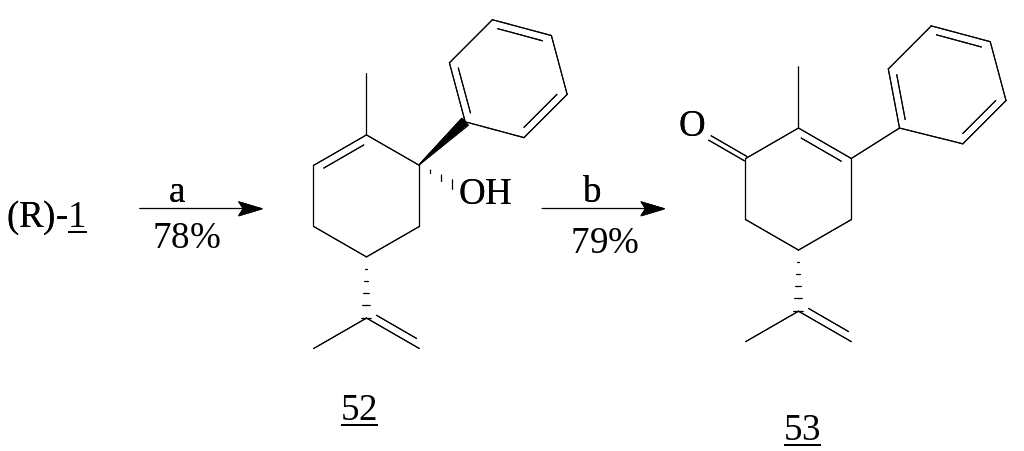
Реагенты: а) PhMgBr, THF; b) PCC, CH2Cl2.
Мягкое окисление выделенного при метилировании trans-6-метилкарвона (33) реактивом Гриньяра спирта (54) дало енон (55), трансформированный в ключевой аллильный спирт (56). Дальнейшее превращение которого ведет к образованию природного сесквитерпена (+)-пингвисенола (57) [13, 28].
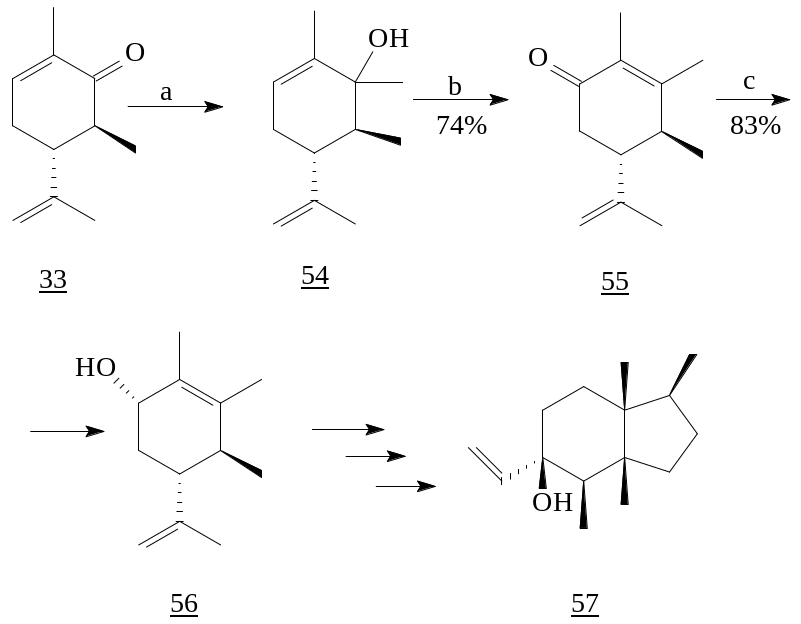
Реагенты: а) MeMgJ, -5°C, Et2O, 3h; b) PCC, CH2Cl2; c) LiAlH4.
Взаимодействие (R)-карвона (1) с аллилмагний хлоридом дает продукт 1,2-присоединения [29].
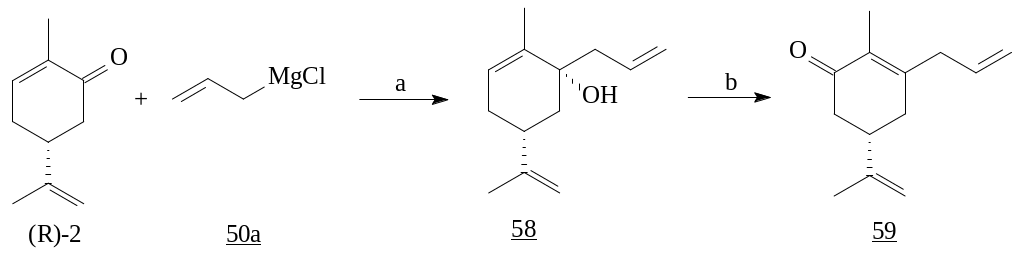
Реагенты: а) CH2=CH-CH2MgCl, THF, 0ºC; b) PCC, CH2Cl2.
Взаимодействие 1,1-диметилаллилмагнийбромида (60) с (R)-пулегоном (2) дает при 0°C смесь продуктов как 1,2- (61, 62) так и 1,4- (63, 64) присоединения.
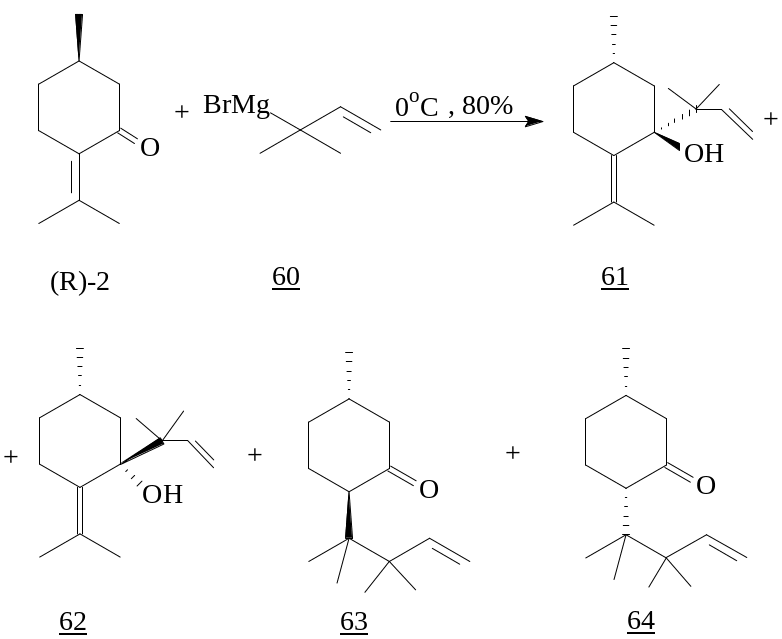
61 : 62 : 63 : 64 = 4 : 2 : 2 : 1
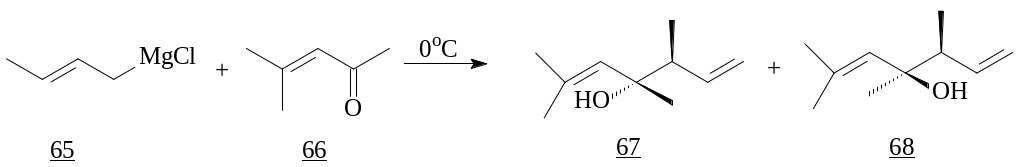
Для нециклических енонов прослеживается иная закономерность. Взаимодействие с кротилмагнийхлоридом (65) при температуре 0°C образует смесь третичных спиртов, с преобладанием trans-изомера (67) с выходом 65% [26].
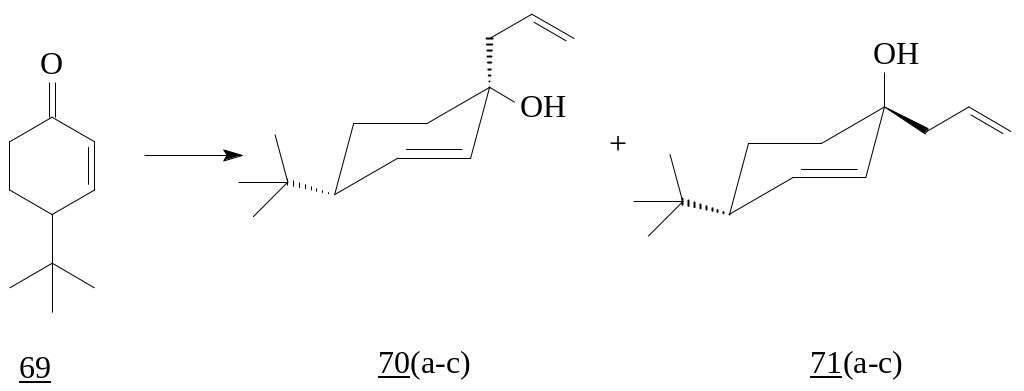
Интересны результаты исследований, полученные Хоуком и сотрудниками, в которых сообщалось о стереоселективном 1,2-присоединении аллилмагния, аллилиндия и аллилвисмута к циклогексенону (69) в аксиальное положение. Это объясняется тем, что 1,2-присоединение нуклеофильного реагента в аксиальное положение энергетически более выгоднее, чем в экваториальное. В результате были получены третичные спирты с преимущественным преобладанием продуктов присоединения алкильных заместителей в аксиальное положение [30, 31].
Реагенты:
а)
![]() , 85%;b)
, 85%;b)
![]() , 83%; с)
, 83%; с)
![]()
Необходимо отметить, что реакция протекает как стерео-, так и региоспецифически. Взаимодействие аллилмагния и аллилвисмута с 4-третбутилциклогекс-2-еноном (69) приводит к образованию смеси соединений, где соотношение trans -(71(b,c)) : cis-(70(b,c)) составляет 5:1 и 2,2:1 [32-34]. В случае аллилиндия соотношение продуктов присоединения 70а и 71а составило 1:1[30].
Варьирование условий проведения реакции (катализатора, температуры, растворителя и соотношение реагентов) позволяет направлять реакцию присоединения по 1,2- или 1,4- положению к еноновой системе. Интересны результаты исследований, полученные Syuzanna R. и сотрудниками [24]. Для нециклических енонов (72) присоединение метилмагнийбромида при низких температурах в отсутствие катализатора в реакционной смеси приводит преимущественно к региоселективному продукту 1,2-присоединения нуклеофильного реагента.
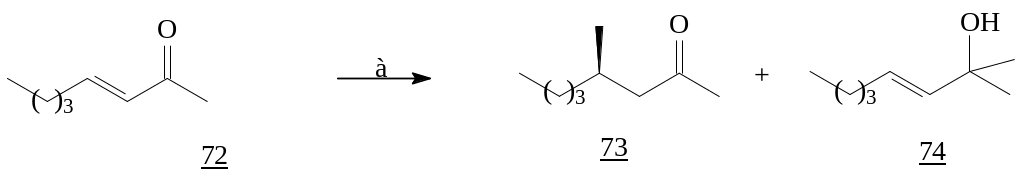
Реагенты: а) MeMgBr, cat., -78°C, раст-ль.
|
cat. |
Раст-ль |
73: 74 |
1 |
— |
Et2O |
1:99 |
2 |
— |
CH2Cl2 |
1:99 |
Использование медного катализатор CuBr·Me2S ведет уже к образованию как 1,2- так и 1,4-аддукта реакции.
|
cat. |
Раст-ль |
73 : 74 |
1 |
CuBr·Me2S |
Et2O |
55:45 |
2 |
CuBr·Me2S |
CH2Cl2 |
42:58 |
