
- •Содержание
- •1Аналитический обзор литературы
- •Использование уникальных свойств кадмия и его соединений в современной науке и технике
- •1.1.2 Распределение кадмия между промпродуктами гидрометаллургического способа получения цинка
- •1.1.3 Поведение кадмия при переработке меднокадмиевых кеков
- •1.2 Состояние кадмия в щелочных растворах
- •1.3 Экстракционное выделение кадмия
- •1.3.1 Экстракция кадмия анионообменными экстрагентами
- •1.3.2 Экстракция кадмия катионообменными экстрагентами
- •1.3.3 Экстракция кадмия из щелочных растворов
- •2 Экспериментальная часть
- •2.1 Исходные вещества, методики эксперимента, исследований и анализа
- •2.1.2 Методики анализа
- •2.2 Исследование экстракция кадмия нбэа-2 из сульфатных растворов
- •2.2.1 Изучение влияния времени контактирования фаз на экстракцию кадмия
- •2.2.2 Влияние рН водной фазы на экстракцию кадмия
2.1.2 Методики анализа
Титриметрическое определение кадмия. Для определений макроконцентраций кадмия в водных растворах (рафинатах и реэкстрактах) использовали метод прямого титрования кадмия раствором комплексона III (ЭДТА) в присутствии эриохрома черного Т в качестве индикатора [].
Определение кадмия с эриохромом черным Т .
Реактивы:
ЭДТА, 0,01 М раствор.
Эриохром черный Т.
Буферный раствор, рН 10.
Ход определения. В 100 мл анализируемого раствора должно содержаться не более 50 мг Cd. Кислые растворы сначала нейтрализуют едким натром, затем к каждым 100 мл раствора прибавляют 2 мл буферного раствора, индикатор и титруют до перехода красной окраски в синюю. С последней каплей раствора титранта исчезает красноватый оттенок окраски.
Замечание. Кривые титрования кадмия, полученные комбинированием кривых титрования кадмия и перехода окраски эриохрома черного Т представлены на рис. 10.

Рис. 10. Кривые перехода окраски эриохрома черного Т в процессе титрования кадмия при различных значениях рН.
Из рис.10 видно, что определение кадмия можно выполнять в интервале рН от 7 до 10, при этом получается настолько резкий переход окраски, что можно применить даже 0,001 М раствор ЭДТА. рН раствора не следует понижать меньше 7, так как иначе не связанный с металлом эриохром черный Т начинает переходить в свою красную форму H2F-. При рН > 10 скачок pCd (рис. 10) быстро уменьшается. В действительности положение не настолько неблагоприятное, как этого можно было бы ожидать в соответствии с рис.10, так как в присутствии большого содержания аммиака получается резкий переход окраски. Причиной этого является образование смешанного комплекса с красителем CdF(NH3)x.
Концентрацию кадмия определяли по формуле:
CCd
= ![]() МCd,
[г/л] (16)
МCd,
[г/л] (16)
где СТр – концентрация раствора комплексона III, VТр – объем комплексона III, пошедшего на титрование, Val – объем аликвоты анализируемого раствора, МCd – молярная масса кадмия, равная 112,41 г/моль.
Метод позволяет определить содержание кадмия от 5 мг/л в пробе и выше, ошибка составляет 0,5 % [ ].
Фотометрическое определение кадмия. Для определения микроконцентраций кадмия использовали фотометрический метод анализа [ ].
Способ фотометрического определения кадмия
Предлагаемый способ фотометрического определения кадмия заключается в следующем.
Кадмий взаимодействует с тиродином с образованием комплексного соединения сиреневого цвета с λмакс = 520 нм при рН 3,8-5,5. Оптимальное значение рН для комплексообразования – 4,5-5. Состав образующегося комплекса Cd : R = 1:2. Для развития цветной реакции необходим 1,5-3-кратный избыток тиродина. Растворы комплексов устойчивы в течение часа. Оптимальная концентрация реагента, при которой достигается наибольшая чувствительность реакции равна 6∙10-5 М. Контрастность реакции ∆λ = 75 нм, молярный коэффициент погашения ε = 3,0∙104.
Фотометрическое определение кадмия. В мерную колбу вместимостью 25 мл вводят 0,5 мл раствора, предположительно содержащего 20 мкг/мл кадмия, приливают 0,5 мл 0,2%-ного водного раствора тиродина, 1 мл универсальной буферной смеси NaOH-KHC8H4O4 (рН 4,5), доводят дистиллированной водой до метки и фотометрируют при 520 нм в кювете с толщиной поглощающего слоя l = 1 см. Содержание кадмия определяют по градуировочному графику. Для построения градуировочного графика в мерные колбы вместимостью 25 мл вводят 0,5 мл 0,2 %-ного раствора тиродина, 1 мл универсальной буферной смеси NaOH-KHC8H4O4 (рН 4,5), 0,06; 0,12; 0,25; 0,3; 0,38; 0,45; 0,5; 0,75; 1,0; 1,5; 2,0; 2,5 мл стандаpтного раствора кадмия, приготовленного в 0,1 н. H2SO4, из азотно-кислого кадмия, доводят дистиллированной водой до метки и фотометрируют при 520 нм в кювете с толщиной поглощающего слоя l = 1 см. В качестве раствора сравнения берут раствор реагента, приготовленный в тех же условиях. Прямолинейность градуировочного графика наблюдается в интервале 0,01-
0,1 мкг/мл кадмия.
Определение концентрации НБЭА в органической фазе. НБЭА представляет собой слабое основание и в растворах его можно оттитровать соляной кислотой [ ].. Обычно в таких случаях проводят титрование с индикаторами, но так как переход окраски нечеткий, то для индикации точки эквивалентности проводили потенциометрическое неводное титрование на лабораторном рН-метре. НБЭА и HCl разбавляли в изобутиловом спирте. По полученным значениям ЭДС и VHCl строят зависимость, из которой графически находят конечную точку титрования и определяют объем кислоты пошедшей на титрование (рис. 13).

Рис 11. Потенциометрическое определение концентрации НБЭА-2 в органической фазе
По известным значениям концентрации и объему кислоты определяют концентрацию реагента.
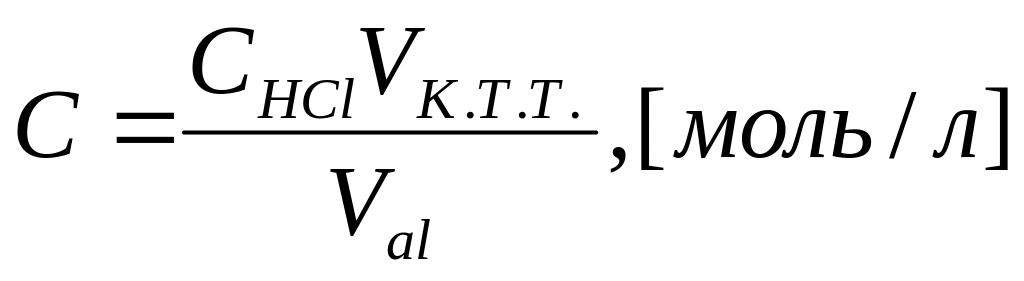 ,
(20)
,
(20)
где СHCl – концентрация соляной кислоты, Vк.т.т. - объем HCl необходимый для достижения конечной точки титрования, Val – объем аликвоты анализируемого раствора.
