
- •Содержание
- •1Аналитический обзор литературы
- •Использование уникальных свойств кадмия и его соединений в современной науке и технике
- •1.1.2 Распределение кадмия между промпродуктами гидрометаллургического способа получения цинка
- •1.1.3 Поведение кадмия при переработке меднокадмиевых кеков
- •1.2 Состояние кадмия в щелочных растворах
- •1.3 Экстракционное выделение кадмия
- •1.3.1 Экстракция кадмия анионообменными экстрагентами
- •1.3.2 Экстракция кадмия катионообменными экстрагентами
- •1.3.3 Экстракция кадмия из щелочных растворов
- •2 Экспериментальная часть
- •2.1 Исходные вещества, методики эксперимента, исследований и анализа
- •2.1.2 Методики анализа
- •2.2 Исследование экстракция кадмия нбэа-2 из сульфатных растворов
- •2.2.1 Изучение влияния времени контактирования фаз на экстракцию кадмия
- •2.2.2 Влияние рН водной фазы на экстракцию кадмия
1.3.2 Экстракция кадмия катионообменными экстрагентами
Исходя из состояния кадмия в щелочных растворах, можно предположить, что для экстракции этого металла могут быть применены катионообменные экстрагенты. К катионообменным экстрагентам относятся, в основном, органические кислоты и их соли.
Чаще других для экстракции кадмия применяют карбоновые кислоты: I) алифатические кислоты [31]; 2) промышленные смеси кислот типа Версатик – такие как Версатик 9 [32], Версатик 9II [33], SRS-100 [34] и другие; 3) нафтеновые кислоты [35,36].
Накасука и др. [37] экстрагировали кадмий каприловой кислотой в бензоле из раствора перхлората натрия. При этом экстрагируемых соединений кадмия несколько: CdA2·4HA; NaCdA3·5Ha; NaCdA3·7HA.
При экстракции цинка, кадмия и ртути каприловой кислотой из растворов NaCIO4, обнаружено, что извлечение металлов понижается в ряду Hg > Cd > Zn [38]. При экстракции данных металлов I моль/л раствором нафтеновой кислоты в керосине порядок понижения экстракции изменяется: Сd > Zn > Hg [39]. Добавление хлоридов натрия, аммония, лития повышает степень экстракции кадмия нафтеновой кислотой при одновременном понижении степени экстракции других элементов (Pb, Pd, Ba, Ca, Mg)[40]. Изучение ИК-спектров нафтенатов кадмия, образующихся при экстракции данного металла I моль/л раствором нафтеновой кислотой показало, что это нейтральные и основные нафтенаты металла, имеющие молекулы воды во внутренней сфере экстрагируемых комплексов[41].
При экстракции кадмия алифатическими карбоновыми кислотами (C3+C10) обнаружена связь экстракционной способности кислот с длиной радикальной цепочки кислоты [42,43], с увеличением молекулярной массы степень экстракции возрастает.
Экстракция кадмия карбоновыми кислотами типа Версатик также изучена достаточно подробно [41,44,45], Спитцер [46] наблюдал повышение значений рН полуэкстракции при экстракции данного металла из хлоридных сред кислотами Версатик, по сравнению с экстракцией нафтеновыми кислотами. Такие же результаты получены Райсом и Смитом [47] и Вереджом [48].
Жибата и Нишимура исследовали экстракцию кадмия Версатик 9II из хлоридных и сульфатных сред [49], а также из щелочных растворов [50]. Состав экстрагируемого соединения при экстракции Версатик 9II из сульфатных растворов определен расчетным методом как CdA2· 4HA [49].
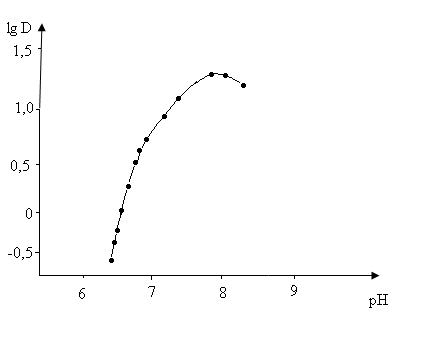
Рис. 6. Экстракция кадмия Версатик - 9II из щелочных растворов.
Необходимо отметить, что во всех исследованиях показана близость величин рН полуэкстракции кадмия практически для всех экстрагентов. Это не позволяет разработать эффективные методы разделения металлов с использованием карбоновых кислот.
В органической фазе, практически во всех используемых органических разбавителях карбоновые кислоты димеризованы [33]. Это определяет характер экстракционных равновесий. Уравнение экстракции кадмия органическими кислотами имеет вид [51]:
M (В)2+ + m / 2(H2A2)(O) ↔ [MA2 · (m · 2)HA](O) + 2H+(В) ( 7 )
Константу равновесия реакции экстракции можно записать следующим образом:
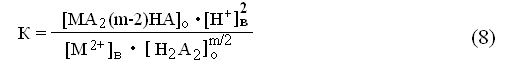
Процесс экстракции реакции протекает в две стадии [52]:
Диссоциация димера в органической фазе:
H2A2(O) ↔ H+(O) + HA2-(O) (9)
2. Межфазный ионный обмен:
M2+(В)+ m/2 H+(O)+m/2HA2-(O)↔[MA2·(m-2)HA](O)+2H+(В) (10)
Следовательно, суммарная константа экстракции может быть представлена :
K∑ = Kдиссm/2 · K обмена (11)
Таким образом, константа экстракции определяется константой кислотной диссоциации экстрагента.
Коэффициент распределения металла можно представить:
 HHРррР
HHРррР
Подставив (8) в (12) получим:
![]()
Предположив, что концентрация экстрагента значительно выше концентрации экстрагируемого металла и остается постоянной, получим:
Д = Kв / [ H+]2(в) (14)
где KВ = K · [H2R2]m/2 = const.
Данный химизм экстракции справедлив для описания извлечения кадмия индивидуальными кислотными реагентами.
Отдельную группу катионообменных экстрагентов, которая представляет несомненный интерес при рассмотрении экстракции кадмия составляет хелатобразующие реагенты [53]. При взаимодействии таких экстрагентов с металлами кроме замещения протона функциональной группы на экстрагируемый металл, образуется дополнительная связь металла с донорным атомом молекулы экстрагента. В результате образуется внутрикомплексное соединение. Функциональными группами, содержащими протон, являются, как правило, функциональные группы органических кислот: -COOH; -SO3H; =POOH; -SH, иногда гидроксильная группа C-OH или оксимная =NOH. К группам образующим координационную связь с металлом, относятся группы, содержащие донорные атомы кислорода, азота или серы. Для экстракции металла применяют в основном хелатные реагенты, которые проявляют слабые кислотные свойства.
Примером использования подобных соединений в качестве экстрагентов являются оксимные реагенты. Оксимы подразделяют на алифатические α-оксиоксимы и ароматические β-оксиоксимы. Для экстракции кадмия опробованы промышленные экстрагенты второго типа к которым относят реагенты Lix 65N, SME-529 и др. [54-56]. Они представляют собой различным способом замешенные салицилальдоксимы. Экстракцию кадмия с использованием салицилальдоксимов изучена достаточно подробно [55,57,58]. Структура экстрагируемого комплекса определена в [59].
Уравнение экстракции определено:
M2+ + 2HA ↔ MA2 + 2H+ (15)
При этом установлено, что соединение кадмия экстрагируется несколько хуже, чем цинка [55].
Для экстракции кадмия предложены также реагенты, принадлежащие к классу сульфонамидов. К ним относятся сульфонамидохинолин [60,61], Lix 34 [62]. Данные реагенты более эффективны, чем окисмные реагенты при экстракции кадмия. Причем данные реагенты способны эффективно экстрагировать кадмий из аммиачных растворов [63]. Экстракция кадмия различными N-8-хинолилсульфонамидами – синтезированными аналогами Lix-34 из ацетатной среды подробно рассмотрена Мацумото и др. [64,65]. Ими были синтезированы несколько представителей хинолилсульфонамидов (CAX), с общей формулой:
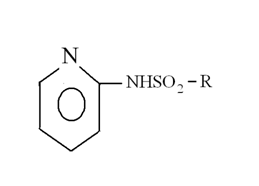 ,
,
где R – I) бутил (ВСФХ); 2) октил (ОСАХ); 3) бензил (ТСАХ), 4) додецил (ДСАХ).
Согласно теории мягких и жестких кислот и оснований [66] кадмий является мягкой кислотой, следовательно, будет образовывать прочный комплекс с серусодержащим комплексообразователем, являющимся мягким основанием. Так, в работе [67], при экстракции металла фенил(гидроксифенил-2) сульфидом и тетрагидрофурфурил (гидроксифенил-2) сульфидом, показано, что кадмий экстрагируется на 95%.
Кроме вышеприведенных реагентов, можно отметить, также, фосфорсодержащие полиалкилфосфорнитрильные кислоты, которые опробованы для экстракции кадмия из сульфатных растворов [68].
При технологическом использовании промышленных реагентов Lix и Kelex необходимо учитывать, что они не обладают достаточной устойчивостью при взаимодействии с минеральным кислотами [69,70].
