
- •Содержание
- •1Аналитический обзор литературы
- •Использование уникальных свойств кадмия и его соединений в современной науке и технике
- •1.1.2 Распределение кадмия между промпродуктами гидрометаллургического способа получения цинка
- •1.1.3 Поведение кадмия при переработке меднокадмиевых кеков
- •1.2 Состояние кадмия в щелочных растворах
- •1.3 Экстракционное выделение кадмия
- •1.3.1 Экстракция кадмия анионообменными экстрагентами
- •1.3.2 Экстракция кадмия катионообменными экстрагентами
- •1.3.3 Экстракция кадмия из щелочных растворов
- •2 Экспериментальная часть
- •2.1 Исходные вещества, методики эксперимента, исследований и анализа
- •2.1.2 Методики анализа
- •2.2 Исследование экстракция кадмия нбэа-2 из сульфатных растворов
- •2.2.1 Изучение влияния времени контактирования фаз на экстракцию кадмия
- •2.2.2 Влияние рН водной фазы на экстракцию кадмия
1.2 Состояние кадмия в щелочных растворах
Гидролиз ионов кадмия с образованием мономерных форм в растворах с низкой концентрацией изучен достаточно подробно. В ранних работах [14,15] определена единственная мономерная форма CdOH+. В более поздних работах [16,17,18], показано существование в сильнощелочных растворах более сложной щелочной формы Cd(OH)-3. Причем, в интервале щелочности от 5 до 12,5 моль/л, данная форма существования кадмия является доминирующей. При щелочности более высокой, чем 12,5 моль/л обнаружен анион состава Cd(OH)2-4 [13]. Принимая во внимание то, что гидроксид кадмия начинает осаждаться при рН 8,0, а растворяться только в достаточно концентрированных растворах щелочей, можно принять следующие константы гидролиза: рК1г = 7,9; рК2г = 10,6; рК3г = 14,3 [15,16].
Диаграмма распределения гидроксокомплексов кадмия в зависимости от рН раствора рассчитанная с использованием данных констант изображена на рис. 5 [17].
При определении констант гидролиза ионов кадмия в зависимости от ионной силы раствора, Мезецкая и др. [14] предложили интерполяционные уравнения (6), которые могут быть использованы для вычисления констант гидролиза мономерных ионов кадмия при 250С, для промежуточных значений ионной силы от 0,1 до 1,0:

где μ – ионная сила.
Растворимость гидроксида кадмия в водных растворах определена 2·10-5 г/л [19], при этом значение произведения растворимости определено: 3,2·10-14 [19]. Фейткнехт и Рейкман [23] нашли, что в результате старения изменяются произведение растворимости гидроксида кадмия. Для свежеосажденного гидроксида была получена величина ПР = 6,45·10-14 , а для выдержанного в контакте с раствором, из которого производили осаждение – 1,66·10-14.
Из рассмотренных литературных данных по состоянию металла в щелочных растворах следует, что кадмий существует в растворе в виде целого ряда комплексных соединений, что должно оказывать существенное влияние на его экстракцию из растворов щелочного выщелачивания.
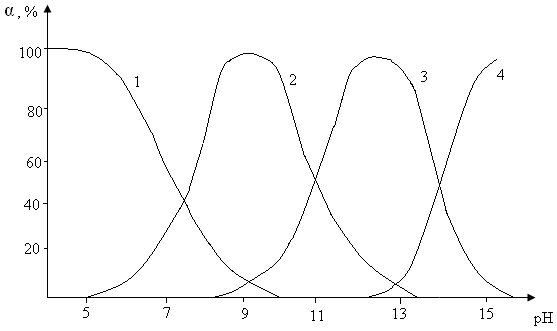
Рис.5 Распределение форм гидроксокомплексов кадмия в зависимости от рН: 1 – Cd2+ , 2 - Cd (OH)+ , 3 - Cd (OH)2, 4 – Cd (OH)3- [17].
1.3 Экстракционное выделение кадмия
Выбор экстрагента и его способность к извлечению металлов во многом определяется состоянием кадмия в водном растворе. Исходя из этого, необходимо рассмотреть состояние кадмия в водных растворах [6].
Кадмий в различных растворах может существовать как в виде катионов, так и в виде комплексных анионов. В зависимости от формы существования данного металла в водных растворах он может экстрагироваться анионообменными и катионообменными экстрагентами.
1.3.1 Экстракция кадмия анионообменными экстрагентами
В работе [22], некоторые исследования посвящены экстракции галогенидных комплексов кадмия замещенными аммониевыми основаниями и их солями. Так, титановая соль октиламмина из растворов, содержащих 4 моль/л соляной кислоты извлекает кадмий с коэффициентом распределения 150 [22].
В работах [24][25] исследована экстракция кадмия третичными аминами из растворов галогеноводородных кислот. Вторичный амин Амберлит αА -1 количественно извлекает кадмий из растворов 2 моль/л соляной кислоты [26]. Третичный амин Аламин 336 достаточно эффективно извлекает кадмий из фосфорнокислых растворов [27]. Селективное извлечение кадмия можно осуществить дииодсодержащим раствором триалкиламина [28]. Экстрагируемость кадмия (ДCd) трибензиламином (С6H5CH2)3N из растворов галогенводородных кислот уменьшается в ряду HI > HBr > HCl, тогда как для цинка наблюдается обратная последовательность. Коэффициент разделения (β Cd∕Zn) при экстракции металлов трибензиламином из 0,25М раствора HI достигает значения 104 [29].
Промышленное применение аминов и солей замещенных аммониевых оснований для извлечения кадмия из галогенидных растворов осложняется трудностями, возникающими при реэкстракции металлов и регенерации экстрагента.
Для промышленного извлечения кадмия из сульфатных растворов, в качестве экстрагента было предложено использовать бинарный экстрагент – соль органической кислоты и органического основания, например, диалкилдитиофосфат тетраалкиламмония. Коэффициент разделения пары кадмий цинк достигает при этом величины 105 [30].
