
- •3.1 Термодинамическая система
- •3.2 Основные законы термохимии
- •3.4 Энергия активации
- •3.5 Общие понятия катализа
- •3. 6 Химическое равновесие
- •Необратимые химические реакции протекают в одном направлении и при постоянных условиях идут до полного расходования одного из реагирующих веществ.
- •Рассмотрим простую реакцию
- •В общем случае для обратимой реакции:
- •3.7 Смещение химического равновесия
3. 6 Химическое равновесие
Равновесие в гомогенных системах
Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией. Такие реакции протекают, например, в водных растворах.
Все химические реакции делят на обратимые и необратимые.
Необратимые химические реакции протекают в одном направлении и при постоянных условиях идут до полного расходования одного из реагирующих веществ.
Обратимыми называют реакции, которые при постоянных условиях протекают одновременно как в прямом, так и в обратном направлении. Продукты таких реакций реагируют вновь с образованием исходных веществ.
Примерами обратимых реакций являются:
– получение йодистого водорода
H2 + I2 2HI;
– получение аммиака
N2 + 3H2 2NH3.
Обратимые реакции в закрытой системе при постоянных температуре и давлении протекают только до определенного момента, когда скорости прямого и обратного процессов становятся одинаковыми, т. е. наступает состояние равновесия.
В обратимых реакциях вместо знака равенства принято ставить знак обратимости , обозначающий, что реакция идет в обоих направлениях. Со временем скорость прямой реакции понижается, а скорость обратной – возрастает. Через некоторое время скорости прямого и обратного процессов сравняются, и наступит химическое равновесие – частный случай термодинамического равновесия. Химическое равновесие является динамическим, или подвижным. Это означает, что в системе с равной скоростью идут прямой и обратный процессы и поэтому в системе видимых изменений не происходит. Существуют ложные равновесия типа псевдоравновесия в смеси газов Н2 и О2, где также не происходит видимых изменений, а также химического взаимодействия. Однако при низких температурах этот процесс не является равновесным, так как при соответствующем внешнем энергетическом воздействии в системе идут необратимые процессы (образуется вода).
Состояние истинного химического равновесия в системе:
– остается неизменным во времени при отсутствии внешних воздействий;
– изменяется под влиянием внешних воздействий, сколь малы бы они не были;
– не зависит от того, с какой стороны (со стороны прямой или обратной реакции) система подходит к равновесию.
Рассмотрим простую реакцию
H2 + I2 2HI.
Используя закон действующих масс, запишем выражения для скорости прямой (V1) и обратной (V2) реакций:
![]() и
и ![]() .
.
В состоянии равновесия V1 = V2, тогда
![]() .
.
Поскольку константы скорости k1 и k2 не изменяются при постоянных температуре и давлении, то их отношение также является постоянной величиной, не зависящей от концентрации исходных веществ продуктов реакции. Ее называют константой химического равновесия и обозначают КС при условии, что концентрации веществ выражены в моль/л:
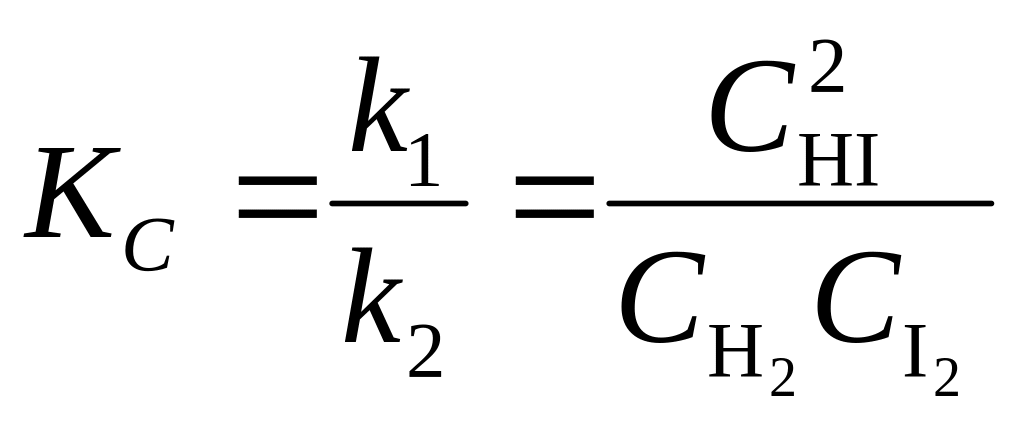 .
.
В общем случае для обратимой реакции:
aA + bB + … = cC + dD + …,
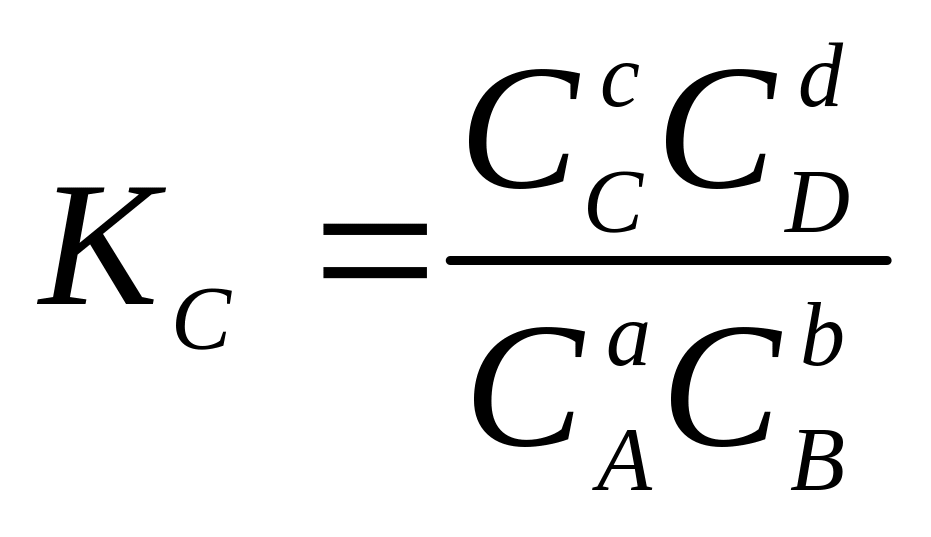 =
=
![]() .
.
Это уравнение для КС представляет собой математическое выражение закона действия масс применительно к обратимым процессам. Величина КС является термодинамической величиной и поэтому не зависит от пути протекания процесса. Константа равновесия зависит от температуры, однако, при постоянной температуре КС есть величина постоянная. Данные о величинах констант и их зависимостях от Т важны при производстве химических веществ. Численное значение константы равновесия указывает на выход реакции при условии, что она идет до конца. При КС 1 выход реакции велик и наоборот.
Если реакция протекает в гетерогенной системе, в которой один или более компонентов являются твердыми веществами, их концентрации принимают равными единице. Так, в реакции
СО2 (г) + С(графит) 2СО(г)
концентрацию (С) углерода принимают за единицу. Тогда в выражении для константы равновесия так же, как и для константы скорости, этот множитель следует опустить, и соотношение для КС будет иметь вид:
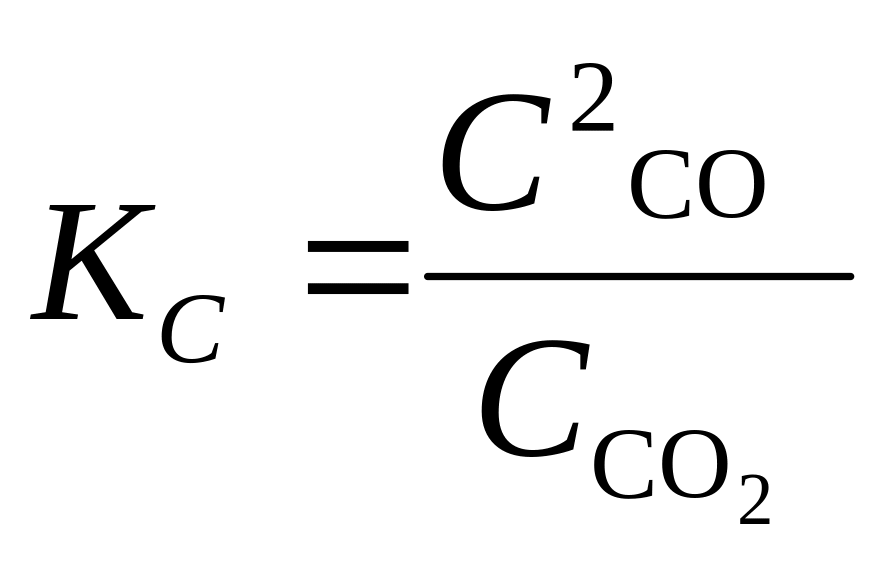
Для реакции идеальных газов вместо молярных концентраций компонентов целесообразно использовать их парциальные давления. Парциальным называется давление (Pi), которое оказывает газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси. То есть это та часть общего давления газовой смеси, которая приходится на данный компонент смеси. Численное значение Pi = Робхi (здесь Роб – общее давление смеси газов, хi – мольная доля i-го газа). Мольная доля равна отношению числа молей данного газа (ni) к общему числу молей в системе (ni):
![]()
В этом случае константа равновесия для реакции идеальных газов
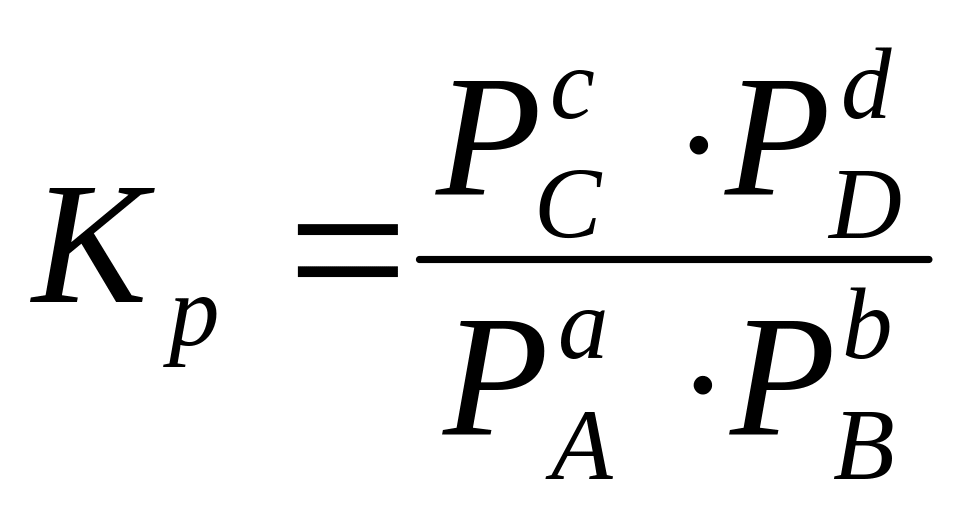
с учетом уравнения Клапейрона–Менделеева PV = nRT. Б. Клапейрон – французский физик и инженер ввел названное его именем уравнение в 1856 г.:
KP = KC(RT)n,
где R = 8,31431Дж/(мольК) – газовая постоянная;
n – число молей газа.
Константа равновесия КР является функцией температуры Т и не зависит от общего и парциальных давлений в системе при постоянном объеме, поскольку изменение давлений эквивалентно изменению концентрации компонентов, от которых константа равновесия не зависит.
В ряде случаев концентрации компонентов удобно выражать через мольные доли (х). Тогда константа равновесия
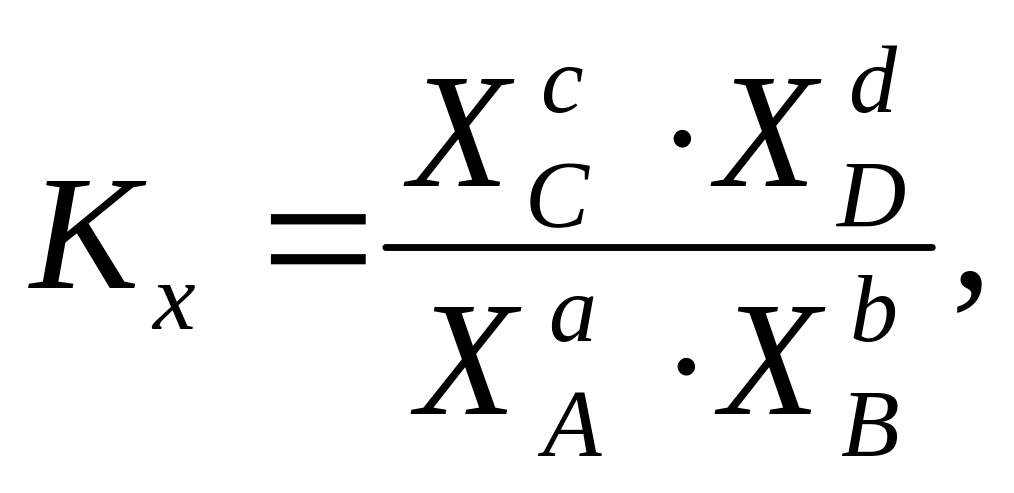
а, учитывая уравнение Клапейрона-Менделеева,
Кх = КРР-n.
Из последнего выражения видно, что Кх есть функция температуры и давления. При n 0, когда реакция идет с уменьшением числа молей, Кх возрастает при увеличении давления.
При взаимодействиях конденсированных фаз, объем которых в химических процессах, как правило, изменяется несущественно, давление не изменяет направление реакции.
