
- •3.1 Термодинамическая система
- •3.2 Основные законы термохимии
- •3.4 Энергия активации
- •3.5 Общие понятия катализа
- •3. 6 Химическое равновесие
- •Необратимые химические реакции протекают в одном направлении и при постоянных условиях идут до полного расходования одного из реагирующих веществ.
- •Рассмотрим простую реакцию
- •В общем случае для обратимой реакции:
- •3.7 Смещение химического равновесия
3.4 Энергия активации
Значительное ускорение реакций при нагревании невозможно объяснить только увеличением скорости молекул и, соответственно, ростом соударений реагирующих частиц. Шведский физико-химик С. Аррениус предположил, что в реакцию при столкновении вступают не все молекулы, а только те, энергия которых больше некоторой минимальной величины, называемой энергией активации. Молекулы, обладающие этой энергией, называются активными. С. Аррениус показал, что число активных частиц, а следовательно, скорость и константа скорости возрастают с температурой по экспоненциальному закону:
k = A exp (– Ea / RT).
Логарифмируя это уравнение, получим:
ln k = ln A – Ea / RT,
где Еа – энергия активации;
А – предэкспоненциальный множитель, или фактор частоты (столкновений).
Э кспоненциальная
зависимость константы скорости реакции
от температуры объясняет большие
величины температурных коэффициентов
реакции. Согласно приведенному уравнению
фактор частоты (столкновений) А
равен константе скорости реакции при
Еа = 0 или Т
∞. В координатах lnk
– 1 / T уравнение
является прямой линией. Определив
угол наклона ее к оси обратных температур,
можно найти значение энергии активации,
так как tg
= Ea
/ R
(рисунок 2.2). Зная tg
и ln
k
при конкретном
значении 1
/ Т, можно
рассчитать частотный фактор А
(ln
A
представляет собой отрезок, отсекаемый
на оси ординат при бесконечной температуре,
когда 1 / Т = 0). Из приведенного уравнения
также следует, что температурный
коэффициент равный, 2 – 4, реализуется
лишь для реакций с Еа
= 81…170 кДж/моль. Однако
энергии активации химических реакций
могут составлять от 40 до 400 кДж/моль.
Следовательно, температурный коэффициент
может принимать значения от 1 до 10.
кспоненциальная
зависимость константы скорости реакции
от температуры объясняет большие
величины температурных коэффициентов
реакции. Согласно приведенному уравнению
фактор частоты (столкновений) А
равен константе скорости реакции при
Еа = 0 или Т
∞. В координатах lnk
– 1 / T уравнение
является прямой линией. Определив
угол наклона ее к оси обратных температур,
можно найти значение энергии активации,
так как tg
= Ea
/ R
(рисунок 2.2). Зная tg
и ln
k
при конкретном
значении 1
/ Т, можно
рассчитать частотный фактор А
(ln
A
представляет собой отрезок, отсекаемый
на оси ординат при бесконечной температуре,
когда 1 / Т = 0). Из приведенного уравнения
также следует, что температурный
коэффициент равный, 2 – 4, реализуется
лишь для реакций с Еа
= 81…170 кДж/моль. Однако
энергии активации химических реакций
могут составлять от 40 до 400 кДж/моль.
Следовательно, температурный коэффициент
может принимать значения от 1 до 10.
При столкновении молекулы могут приблизиться друг к другу на такое расстояние, когда между ними преобладают силы отталкивания. Такие молекулы после столкновения разлетаются, и реакция не идет. Реакция возможна только в том случае, если энергия молекулы превышает некоторую величину, достаточную для преодоления потенциального барьера – барьера отталкивания. В этом случае происходит такое сближение молекул, при котором расстояния между ядрами атомов становятся близкими к длине возникающих связей и создаются условия для перегруппировки атомов и перераспределения электронов. Энергию, необходимую для того, чтобы превратить молекулу в активную, т. е. способную преодолеть потенциальный барьер, называют энергией активации Е. Если энергия активации мала (Е 40 кДж/моль), то скорость реакции велика. Примером таких реакций являются ионные реакции в водных растворах, протекающие практически мгновенно. Напротив, если энергия активации велика (Е 120 кДж/моль), скорость реакции очень мала. Реакции, требующие для протекания заметной энергии активации, начинаются с разрыва или ослабления связей между атомами в молекулах исходных веществ, которые переходят в неустойчивое промежуточное состояние называемое активированным комплексом. Именно для его образования и необходима энергия активации. Время существования активированного комплекса мало (порядка 10-13 с). Он распадается с образованием продуктов реакции и выделением энергии. Рассмотрим на примере газовой бимолекулярной реакции образования йодистого водорода из водорода и паров йода:
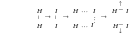

Энергетическая схема реакции представлена на рисунке 2.3.
Р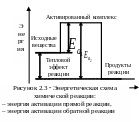 азность
энергий активации прямой и обратной
реакции равна тепловому эффекту реакции
азность
энергий активации прямой и обратной
реакции равна тепловому эффекту реакции
![]()
Для эндотермического процесс
Н
0 и
![]() ,
для экзотермического
Н
0 и
,
для экзотермического
Н
0 и
![]() .
.
Образование переходного состояния – процесс энергетически более выгодный, чем полный распад вступающих в реакцию молекул. Поэтому образование активированного комплекса характерно для подавляющего большинства химических процессов.
