
Водные электролиты
Химически чистая вода является слабым амфотерным электролитом, поэтому ее электролитическая диссоциация выражена слабо (амфотерность – способность химических соединений проявлять основные либо кислотные свойства в зависимости от условий). Вода диссоциирует на катион водорода и анион гидроксила по уравнению:
Н2О Н+ + ОН (Н 0) (8.16)
Поскольку в воде всегда существует гидратированный протон – ион гидроксония Н3О+, процесс ассоциации воды:
Н2О + Н+ Н3О+ (Н 0).
Итак, вода является неравновесной системой, в которой протекают обратимые реакции.
На основании закона действующих масс константа электролитической диссоциации воды
![]()
отсюда
[H+]
[OH]
=
![]() [H2O].
[H2O].
Величина
KW=
[H+][OH]
названа
ионным
произведением воды.
Для чистой воды [H2O]
= 1000/18 = 55,6 моль/л (![]() = 1 л = 1000 мл;
= 1 л = 1000 мл;
![]() =18 г/моль),
=1,810-16.
Подставив эти значения получим Кw=
[H+][OH]=1,810-1655,6
10-14.
=18 г/моль),
=1,810-16.
Подставив эти значения получим Кw=
[H+][OH]=1,810-1655,6
10-14.
Величина KW постоянна для любых концентраций водородных и гидроксильных ионов в растворе электролита при данной температуре. В растворах кислот или щелочей, концентрации водородных и гидроксильных ионов различны, однако, ионное произведение воды остается постоянным при условии неизменности температуры.
С увеличением температуры степень диссоциации воды возрастает, и, следовательно, увеличивается KW. Так, при температуре кипения ионное произведение воды равно 10-12.
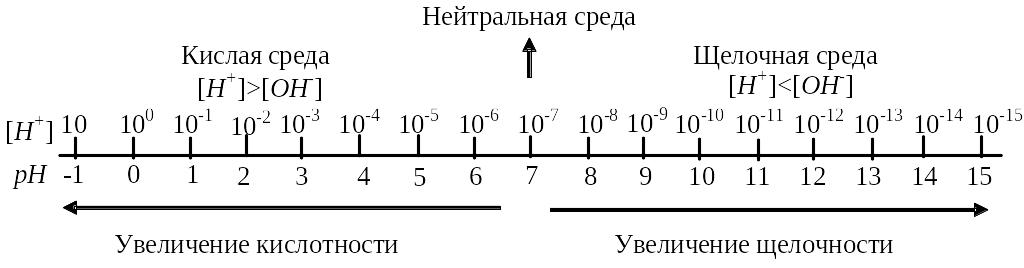
Для количественной характеристики кислотных или щелочных свойств водных растворов введена величина, называемая водородным показателем (рН) – это отрицательный десятичный логарифм концентрации ионов Н+:
рН = -lg[H+].
В нейтральном водном растворе при комнатной температуре KW=[H+][OH] = 10-14, откуда [H+] = [OH] = 10-7 моль/л и рН = 7. В кислых растворах концентрация водородных ионов больше, чем ионов ОН-, [H+]10-7 моль/л, следовательно, рН7. В щелочных растворах [H+] [OH], [H+] 10-7 моль/л, значит рН 7. Необходимо подчеркнуть, что эти закономерности справедливы только при 25С.
Гидролиз солей.
Гидролиз (гидролитическое расщепление или гидролитическая деструкция) – обменная реакция между веществом и водой.
Аналогичные реакции для неводных сред называют сольволизом. Гидролиз – разновидность ионных реакций сольволиза. Реакция нейтрализации между различными по силе кислотами и основаниями не всегда доходит до конца вследствие протекания обратного процесса – гидролиза образующейся соли, т.е. процесса, обратного реакциям нейтрализации.
Ранее было показано, что большинство солей в водных растворах диссоциирует на катион металла и кислотный остаток. Например,
CH3COONa Na+ + CH3COO.
Определенная доля молекул воды (хотя и очень малая) диссоциирует на ионы Н+ и ОН:
Н2О Н+ + ОН.
Ионы, образовавшиеся в результате диссоциации солей, могут взаимодействовать с ионами воды с образованием малодиссоциированных соединений (слабых электролитов). В данном случае
СН3СОО + Н+ СН3СООН,
и реакция гидролиза записывается в виде
NaCH3COO + H2O CH3COOH + NaOH
или в ионной форме
СН3СОО + Н2О CH3COOH + ОН.
Таким образом, сущность гидролиза состоит в том, что катионы соли (слабое основание), или ее анионы (слабая кислота), либо оба вида ионов одновременно могут связывать соответственно ионы ОН или Н+ воды, либо и те и другие с образованием слабого электролита – соответственно, основания, кислоты или основания и кислоты сразу). Различают гидролиз трех типов 1) гидролиз солей, образованных слабым основанием и сильной кислотой (рН растворов таких соединений меньше 7); 2) гидролиз солей, образованных сильным основанием и слабой кислотой (рН 7); 3) гидролиз солей, образованных слабым основанием и слабой кислотой (рН 7).
Рассмотрим подробнее процесс гидролиза солей для всех случаев.
Соли слабого основания и сильной кислоты (гидролиз по катиону), например, Al2(SO4)3, FeCl2, NH4Cl. Среда при этом виде гидролиза кислая (рН 7),
FeCl2 Fe2+ + 2Cl,
Cl + HOH реакция не идет,
Fe2+ + H2O Fe(OH)+ + H+ (1 ступень),
Fe(OH)+ + HOH Fe(OH)2 + H+ (2 ступень).
Соответствующие молекулярные уравнения 1 и 2 ступени гидролиза
FeCl2 + H2O Fe(OH)Cl + HCl,
Fe(OH)Cl + H2O Fe(OH)2 + HCl.
Соли сильного основания и слабой кислоты (гидролиз по аниону). При гидролизе KClO, Na2CO3, CH3COONa, Na2S, K2SiO3 создается щелочная среда (рН 7), например,
CH3COONa + H2O CH3COOH + NaOH (рН 7).
При растворении солей многоосновных кислот гидролиз протекает ступенчато, например
Na2S 2Na+ + S2
Na+ + HOH реакция не идет
S2 + HOH HS + OH ( 1 ступень)
HS + HOH H2S + OH (2 ступень)
Молекулярные уравнения соответственно имеют вид:
Na2S + H2O NaHS + NaOH,
NaHS + H2O H2S + NaOH.
Соли слабого основания и слабой кислоты (гидролиз по катиону и аниону) – Al2S3, CH3COONH4, (NH4)2CO3). Например,
CH3COONH4 CH3COO- + NH4+,
CH3COO + HOH CH3COOH + HO,
NH4+ + HOH NH3·H2О + H+.
Итоговое уравнение в ионном виде
CH3COO + NH4+ + HOH CH3COOH + NH3·H2О,
молекулярное уравнение
CH3COONH4 + H2O CH3COOH + NH3·H2О.
Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований. Для вышеприведенной реакции гидролиза CH3COONH4 раствор будет слабощелочной (т.е. pH7).
Если соль образована катионами сильного основания и анионом сильной кислоты (NaCl, K2SO4) гидролиза не происходит, так как в этой водной системе имеется лишь один слабый электролит – Н2О, и поэтому отсутствует возможность связывания ионов Н+ и ОН.
На глубину гидролиза влияют те же факторы, что и на ионные равновесия вообще: температура, концентрация соли и т.д. Количественной характеристикой гидролиза служат константы равновесия и степень гидролиза.
Степень гидролиза (h), равна отношению числа гидролизованных молекул к общему числу растворенных молекул, которое определяется концентрацией вещества. Степень гидролиза соли зависит от константы гидролиза и концентрации соли и выражается в процентах или долях единицы. Она связана с константой гидролиза следующим соотношением:
![]()
где Сс – концентрация соли, Кг – константа гидролиза, h – степень гидролиза. Это уравнение справедливо для солей, образованных как сильной кислотой и слабым основанием, так и слабой кислотой и сильным основанием.
Гидролиз солей играет большую роль в жизнедеятельности организмов.
При гидролизе минералов происходят изменения в составе земной коры. Например, в результате гидролиза горных пород вулканического происхождения в раствор переходят в гидролизованном виде кремнезем (SiO2) и глинозем (Al2O3), которые, взаимодействуя друг с другом, образуют глины по схеме:
горные породы Н2О продукты гидролиза (SiO32, Al3+, K+) KАlSi3O10.
Гидролиз широко применяется в химической промышленности [49] для получения сахаров, спиртов, пищевых органических кислот, мыла, глицерина и других веществ. Реакции, происходящие при гидролизе, используются при получении коллоидных растворов, для очистки воды, подаваемой в парогенераторы, и для других целей.
Химическое равновесие. Принцип Ле Шателье
Если система находится в равновесии, то она будет находиться в нём до тех пор, пока внешние условия сохранятся постоянными. На практике зачастую бывает важно добиться максимально возможного смещения равновесия в сторону прямой реакции (или обратной, если требуется подавить образование вредных веществ). Условия для этого выбирают на основе принципа, сформулированного известным французским учёным. Этот принцип, названный в честь французского химика Анри Луи Ле Шателье, можно сформулировать следующим образом: если на систему, находящуюся в равновесии, производится какое либо внешнее воздействие (изменяется концентрация, температура, давление), то равновесие смещается в том направлении, которое способствует ослаблению этого воздействия.
Влияние концентрации. Если увеличить концентрацию исходных веществ, то система будет стремиться быстрее их израсходовать, то есть сместится в сторону образования продуктов. И, наоборот, если в системе увеличить концентрацию продуктов, то система сместится в сторону исходных веществ.
Влияние давления. Изменение давления наиболее существенны в случае реакций, протекающих с изменением числа моль газообразных веществ.
При увеличении общего давления равновесие смещается таким образом, что общее давление снижается, то есть, смещается в направлении той реакции, которая протекает с уменьшением числа моль газообразных веществ.
Рассмотрим применение принципа Ле Шателье на примере реакции образования аммиака.
N2(gas) + ЗН2(gas) = 2NН3(gas)
Если: а) уменьшить концентрации исходных веществ N2 и Н2 б) увеличить давление равновесной смеси (сжать), то:
а) Уменьшение концентрации исходных веществ N2 и Н2 приведет к смещению равновесия справа налево, в результате концентрации N2 и Н2 вновь увеличатся за счет разложения аммиака.
б) Увеличение давления системы приведет к смещению равновесия слева направо, то есть в направлении реакции синтеза аммиака, при этом число моль газообразных веществ уменьшится (из 4-х моль исходных веществ образуется 2 моль продуктов), а соответственно уменьшится и общее давление системы.
Повышение температуры будет способствовать протеканию эндотермической реакции, идущей с поглощением тепла; понижение температуры будет способствовать протеканию экзотермической реакции, идущей с выделением тепла ( < 0). Например, уменьшение температуры сместит равновесие реакции N2+О2=2NO (ΔН0=-180 кДж/моль) справа налево, то есть в направлении экзотермической реакции, идущей с выделением тепла. Температура системы в результате повысится.
Влияние катализатора. Катализаторы одинаково ускоряют как прямую, так и обратную реакцию, и поэтому не смещают химическое равновесие. Они способствуют более быстрому достижению равновесного состояния.
