
- •Введение
- •1 Предмет и значение химии
- •§2 Основные понятия и законы химии
- •Находим эквивалентную массу металла из соотношения
- •§3 Классификация и номенклатура неорганических веществ
- •HClO – хлорноватистая кислота h2so4 – серная кислота
- •Глава 1. Строение вещества
- •§1. Основные сведения о строении атома
- •§2 Квантово-механические принципы строения вещества
- •§3. Строение электронных оболочек атомов
- •§4. Периодическая система элементов д. И. Менделеева и изменение их свойств
- •§5. Изменение свойств химических элементов
- •§ 5 Природа из условия образования химической связи
- •§6 Ковалентная связь
- •§ 7 Ионная связь
- •§8 Степень окисления элементов. Как уже подчеркивалось выше, способность того или иного атома образовывать ионную связь характеризуют понятием степени окисления элемента.
- •§ 9 Металлическая связь
- •§10 Окислительно-восстановительные реакции
- •§11. Типы взаимодействия молекул
- •§ 12 Комплексные соединения
- •§ 13 Свойства веществ в различных состояниях
- •Глава II. Общие закономерности химических процессов
- •§ 1. Энергетика химических процессов
- •§2. Основы термохимии
- •§4. Скорость химической реакции
- •§ 5. Химическое равновесие
- •§ 6. Скорость гетерогенных химических реакций
- •III. Растворы и другие дисперсные
- •§ 1. Дисперсные системы
- •§ 2 Растворы.
- •§ 3Осмотическое давление
- •§ 4 Давление пара растворов и фазовые превращения в растворах.
- •§ 5Электролитическая диссоциация
- •Основания
- •§ 6 Ионные реакции.
- •§7 Гидролиз солей
- •Глава IV. Электрохимические процессы
- •§1 Электродные и окислительно-восстановительные (ов) потенциалы
- •§2 Гальванические элементы
- •§3 Промышленные источники тока
- •§4 Электролиз
- •§5 Законы Фарадея
§ 7 Ионная связь
Природу ионной связи, структуру и свойства ионных соединений можно объяснить электростатическим взаимодействием ионов.
Ионная связь – электростатическое притяжение между ионами, образованными путем практически полного смещения электронной пары к одному из атомов. Этот тип связи образуется, если разность электроотрицательностей атомов велика (>1,7 по шкале Полинга). Ионная связь – предельный случай полярной ковалентной связи.
Электрические заряды ионов обусловливают их притяжение и отталкивание и в целом определяют стехиометрический состав соединения. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении. Иначе говоря, ионная связь, в отличие от ковалентной, характеризуется ненаправленностью.
Понятно, что взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Следовательно, в отличие от ковалентной ионная связь характеризуется также ненасыщаемостью.
Вследствие ненаправленности и ненасыщаемости ионной связи энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Однако из-за отталкивания одноименных ионов друг от друга устойчивость системы достигается лишь при определенной взаимной координации ионов, поэтому координационное число в "чисто" ионных соединениях зависит не только от специфики электронной конфигурации элементов, но определяется и соотношением размеров ионов. Так, при соотношении ионных радиусов в пределах 0,41-0,73 имеет место октаэдрическая координация ионов, при соотношении 0,73-1,37 — кубическая координация и т.д. Например, при взаимодействии ионов Na+ (rNа+ 0,098 нм) и Сl(rCl-,181 нм), соотношение значений радиусов которых равно 0,54, возникает октаэдрическая координация. Подобная взаимная координация ионов достигается при образовании простой кубической кристаллической решетки хлорида натрия, в узлах которой находятся ионы натрия (темные кружочки) и ионы хлора (светлые кружочки) (рисунок 14)
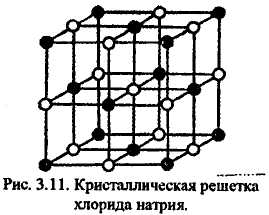
Рисунок 14 – Кристаллическая решетка хлорида натрия
Таким образом, весь кристалл поваренной соли представляет собой как бы одну огромную макромолекулу, состоящую из огромного числа ионов (Na+ Cl−)n. Поэтому для ионных соединений понятие простых двухатомных молекул типа NaCI или CsBr при обычных условиях теряет смысл. Отдельные молекулы типа NaCI существовать все же могут, но лишь в газовой фазе при очень высоких температурах (температура плавления NaCI составляет 800 "С, температура кипения — 1450 °С) и низких давлениях, когда вероятность столкновения между молекулами мала.
Однако энергия разрыва ионной связи не определяется только энергией притяжения ионов, так как не существует молекул, которые, находясь в основном состоянии, распадались бы в газовой фазе на ионы. Это следует из того, что работа, затрачиваемая на ионизацию атома металла, не компенсируется энергией, выделяющейся при присоединении электрона к атому галогена. Так, минимальная энергия ионизации атома цезия (3,89 эВ) превосходит максимальную энергию сродства к электрону, которой обладает атом хлора (3,83 эВ). Таким образом, даже такая "предельно ионная" молекула, как хлорид цезия, фактически не является ионной на 100 процентов.
Наглядное доказательство отсутствия "полного разделения" заряда в типичных ионных молекулах получено на основании измерений электрического момента диполя и межъядерных расстояний. В частности, экспериментально определенная величина электрического момента диполя молекулы NaCI в газовом состоянии 33,3-10'30 Кл-м заметно меньше теоретической 40-10~30 Кл-м. Последняя может быть получена исходя из предположения о существовании ионов Na+ и Сl при значении межъядерного расстояния в молекуле поваренной соли (250 пм). Диссоциация галоидов щелочных металлов на ионы в полярных растворителях объясняется тем, что ионы имеют большие энергии сольватации, способные скомпенсировать недостаточную энергию диссоциации на ионы в газовой фазе.
У атомов одних элементов преимущественно проявляется тенденция к потере электронов с превращением в положительно заряженные ионы (катионы) атомы же других элементов , наоборот, стремяться приобрести электроны, переходя при этом в отрицательно заряженные ионы (анионы).
Способность элементом образовывать простые ионы обусловлена электронной конфигурацией их атомов, а также величинами их электроотрицательностей, энергий ионизации и сродства к электрону. Понятно, что легче всего катионы образуют элементы с малыми энергиями (потенциалами) ионизации — щелочные и щелочноземельные металлы. Образование же в условиях обычных химических превращений простых катионов других элементов менее вероятно, так как это связано с затратой большой энергии на ионизацию атомов.
Простые анионы легче всего образуют р-элементы VII группы вследствие их высокого сродства к электрону. Присоединение одного электрона к атомам кислорода, серы, углерода, некоторым другим элементам сопровождается выделением энергии. Присоединение же последующих электронов с образованием свободных многозарядных простых анионов места не имеет.
Поэтому соединения, состоящие из простых ионов, немногочисленны. Они легче всего образуются при взаимодействии щелочных и щелочноземельных металлов с галогенами.
