
- •Введение
- •1 Предмет и значение химии
- •§2 Основные понятия и законы химии
- •Находим эквивалентную массу металла из соотношения
- •§3 Классификация и номенклатура неорганических веществ
- •HClO – хлорноватистая кислота h2so4 – серная кислота
- •Глава 1. Строение вещества
- •§1. Основные сведения о строении атома
- •§2 Квантово-механические принципы строения вещества
- •§3. Строение электронных оболочек атомов
- •§4. Периодическая система элементов д. И. Менделеева и изменение их свойств
- •§5. Изменение свойств химических элементов
- •§ 5 Природа из условия образования химической связи
- •§6 Ковалентная связь
- •§ 7 Ионная связь
- •§8 Степень окисления элементов. Как уже подчеркивалось выше, способность того или иного атома образовывать ионную связь характеризуют понятием степени окисления элемента.
- •§ 9 Металлическая связь
- •§10 Окислительно-восстановительные реакции
- •§11. Типы взаимодействия молекул
- •§ 12 Комплексные соединения
- •§ 13 Свойства веществ в различных состояниях
- •Глава II. Общие закономерности химических процессов
- •§ 1. Энергетика химических процессов
- •§2. Основы термохимии
- •§4. Скорость химической реакции
- •§ 5. Химическое равновесие
- •§ 6. Скорость гетерогенных химических реакций
- •III. Растворы и другие дисперсные
- •§ 1. Дисперсные системы
- •§ 2 Растворы.
- •§ 3Осмотическое давление
- •§ 4 Давление пара растворов и фазовые превращения в растворах.
- •§ 5Электролитическая диссоциация
- •Основания
- •§ 6 Ионные реакции.
- •§7 Гидролиз солей
- •Глава IV. Электрохимические процессы
- •§1 Электродные и окислительно-восстановительные (ов) потенциалы
- •§2 Гальванические элементы
- •§3 Промышленные источники тока
- •§4 Электролиз
- •§5 Законы Фарадея
§ 5 Природа из условия образования химической связи
Лишь немногие химические элементы (благородные газы) в обычных условиях находятся в состоянии одноатомного газа. Атомы остальных элементов, наоборот, в индивидуальном виде не существуют, так как могут взаимодействовать между собой или с атомами других элементов, образуя при этом более или менее сложные частицы. Среди частиц, образуемых совокупностью атомов, обычно выделяют молекулы, молекулярные ионы и свободные радикалы. Взаимодействие между атомами осуществляется по причине химической связи: она обусловлена тем, что между атомами действуют электростатические силы, т.е. силы взаимодействия электрических зарядов, носителями которых являются электроны и ядра атомов.
Доказано, что в образовании химической связи между атомами главную роль играют электроны, расположенные на внешней оболочке и, следовательно, связанные с ядром наименее прочно, так называемые валентные электроны. Именно поэтому строение валентной электронной конфигурации атомов является определяющим фактором при рассмотрении условий образования химической связи.
Согласно теории химической связи, наибольшей устойчивостью обладают внешние оболочки из двух или восьми электронов (электронные группировки благородных газов). Это и служит причиной того, что благородные газы при обычных условиях не вступают в химические реакции с другими элементами. Атомы же, имеющие на внешней оболочке менее восьми (или иногда двух) электронов, стремятся приобрести структуру благородных газов. Такая закономерность позволила сформулировать положение, которое является основным при рассмотрении условий образования молекулы: при образовании молекулы атомы стремятся приобрести устойчивую восьмиэлектронную (октет) или двухэлектронную (дублет) оболочки.
Образование устойчивой электронной конфигурации может происходить несколькими способами и приводить к молекулам (и веществам) различного строения, поэтому различают несколько типов химической связи. Таковы ионная, ковалентная и металлическая связи. Отнесение химической связи в конкретной частице к определенному типу не всегда является простой задачей. Для ее решения приходится учитывать целую совокупность химических и физических свойств. Любая химическая связь образуется только тогда, когда сближение двух (или большего числа) атомов приводит к понижению полной энергии системы (суммы кинетической и потенциальной энергий). Проиллюстрируем это утверждение на примере образования простейшей молекулы, состоящей из двух атомов.
Определяющими факторами являются межъядерное расстояние r и энергия взаимодействия атомов Е. На рисунке 8 показано изменение энергии в системе из двух постепенно сближающихся атомов.
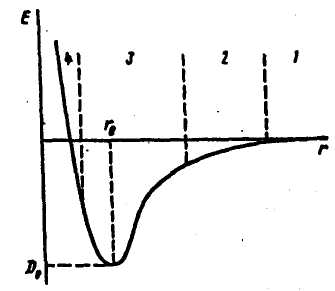
Рисунок 8 – Энергия взаимодействия двух атомов в зависимости от межъядерного расстояния.
Вначале атомы разделены большим расстоянием и энергия их взаимодействия близка к нулю (область 1). При сближении атомов между ними возникает слабое ван-дер-ваальсово взаимодействие (область 2). Когда межъядерное расстояние становится сравнимо с размерами электронных оболочек атомов (область 3), между атомами появляется два конкурирующих вида взаимодействия. Во-первых, притяжение, действующее между ядрами одного и электронами другого атома. Во-вторых, отталкивание, действующее между одноименно заряженными ядрами и электронами обоих атомов. Вначале превалирует притяжение и энергия продолжает уменьшаться вплоть до образования стабильной молекулы при r = rе. Минимум на кривой, глубина которого равна De, показывает тот выигрыш в энергии, которым сопровождается объединение изолированных атомов в молекулу. При дальнейшем сближении атомов (область 4) начинают превалировать силы отталкивания, резко возрастающие на коротких расстояниях. Таким образом, из рисунка 8 следует, что молекулы типа А2 могут быть количественно охарактеризованы указанием равновесного межъядерного расстояния re и энергии связи (энергии диссоциации) De. Для молекул типа АВ, состоящих из разных атомов, необходимо знать полярность связи, которая характеризуется электрическим моментом диполя (см. ниже).
Решение вопроса о природе химической связи стало возможным только на базе квантовой механики, основы которой отмечены в предыдущей главе.
Молекула представляет собой устойчивую электронейтральную систему, состоящую из взаимодействующих электронов и нескольких ядер и способную к самостоятельному существованию. Устойчивость молекулы означает прежде всего то, что для ее разделения на атомы требуется затрата энергии.
Молекулы — это мельчайшие частицы вещества, на которые его можно разделить без потери химической индивидуальности, т.е. способности к определенным химическим превращениям. Например, водяной пар, воду или лед можно разделить на отдельные молекулы воды, каждая из которых представляет собой объединенные в единую прочную систему атом кислорода и два атома водорода. Атом кислорода образует две химические связи по одной с каждым из атомов водорода.
В
отличие от молекул, молекулярные
ионы
—
многоатомные частицы, несущие электрический
заряд, сами по себе не могут образовывать
какое-либо вещество, так как между ними
действуют силы электростатического
отталкивания.
Поэтому, например, существует ион аммония
NH4+,
но не существует
вещества аммония. Электростатическое
отталкивание может быть
скомпенсировано лишь одновременным
присутствием эквивалентного
числа отрицательно заряженных ионов,
скажем, ионов![]() .
Вместе с ионами
ионы
.
Вместе с ионами
ионы
![]() образуют
вещество — хлорид аммония.
образуют
вещество — хлорид аммония.
В некоторых случаях молекулы или молекулярные ионы могут объединяться в более сложные образования, сохраняя основные черты своего строения и способность выделяться в неизменном виде при определенных изменениях условий. Например, аммиак реагирует с ионами серебра, давая частицы Аg(NН3)2+ Эти частицы в определенных условиях распадаются на исходный ион Ад+и молекулы аммиака. Такие образования в химии называются комплексами. Типы комплексов разнообразны. Они играют исключительную роль в биологических системах.
Рассмотрим основные типы химической связи.
