
- •Комплексті қосылыстар ерітіндідегі химиялық тепе-теңдігін өрнектеңіз. Тұрақтылық және тұрақсыздық константалары үшін теңдеулер келтіріп, арасындағы байланысты көрсет.
- •2.Жүйелік және бөлшектік анализ дегеніміз не? Мысал келтір. Катиондардың қышқылды-негіздік жіктелуін көрсетіңіз.
- •5. Аналитикалық химияда комплекстүзу процесінің қолданылуын көрсетіңіз ( ашу, бөліп алу, концентрлеу, бүркемелеу, иондарды анықтау). Мысалдармен жауабыңызды дәлелдеңіз.
- •6.Тотығу-тотықсыздану потенциал шамасына қандай факторлар әсер етеді?
- •7. Тұнбаның ерігіштік көбейтіндісі мен ерігіштігі арасында қандай байланыс бар?
- •8. Тұнбаның ерігіштігіне аттас иондардың қандай әсері бар?
- •8. Реалды және идеалды ерітінділер дегеніміз не? Активтілік, активтілік коэффицент пен ерітіндінің иондық күші қалай есептеледі?
- •10. Тұнбаның ерігіштігіне күшті электролиттің қандай әсері бар?
- •11. Гомогенді жүйелер дегеніміз не? Массалар әрекеттесу заңын тұжырымдаңыз. Гомогенді тепе-теңдік тұрақтыларын (термодинамикалық, концентрациялық шартты) келтіріңіз.
- •12. Титриметриялық ерітіндінің концентрациясын өрнектеу тәсілдері мен өзара байланысын көрсетіңіз.
- •13. Титриметриялық анализдің түрлерін көрсетіңіз. Реакцияларға қойылатын талаптар.
- •14. Бастапқы стандарттар және екінші ретті стандарттарға анықтама беріңіз. Бастапқы стандарттарға қойылатын талаптар. Фиксоналдар дегеніміз не? Мысал келтіріңіз.
- •15. Тура, кері және жанама титрлеу арасындағы айырмашылықты көрсетіңіз.
- •16. Титрлеу кезінде индикатор түсі өзгеруін қалай түсіндіруге болады. Мысал келтіріңіз.
- •17. Комплексонометрлік титрлеудің маңызын түсіндіріп, мысал кетіріңіз.
- •19. Комплексондар дегеніміз не? Метал иондарымен әрекеттескенде комплексондардың ерекшелігін көрсетіңіз.
- •20. Аморфты және ірі кристалды тұнбаларды алу жағдайларын көрстіңіз.
10. Тұнбаның ерігіштігіне күшті электролиттің қандай әсері бар?
Тұнба үстіндегі қаныққан ерітіндіге тұнбамен жалпы иондары жоқ күшті электролит құйғанда ерітіндінің иондық күші жоғарылайды, ол иондардың белсенділік коэффициентін төмендетеді және сәйкесінше тұнба ерігіштігін жоғарылатады. Бөтен күшті электролиттердің тұнба ерігіштігіне әсерінің бұл эффекті тұздық деп аталған.
0,1 М Na3PO4 натрий фосфатының ерігіштігіне қандай тұздық эффект көрсететінін анықтаймыз.
0,1М Na3PO4 енгізгенде тұнба үстіндегі қаныққан ерітіндінің иондық күші мынаған тең:
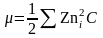
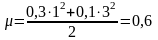
Көрсетілген иондық күште барий фосфатының тұнбасы иондарының белсенділік коэффициенттері анықтама мәндері бойынша:
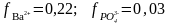
Бұдан 0,1 М Na3PO4 ерітіндісіндегі тұнба ерігіштігі мынаған тең:
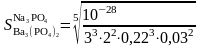 ≈10-5M
≈10-5M
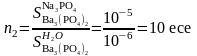
Есептеулерден көретініміз, аттас иондардың эффекті бөтен электролиттің иондық күші эффектіне қарағанда әлдеқайда күштірек. Сондықтан, егер ерітіндіде тұнбамен аттас иондары бар күшті электролит болса, онда тұздық эффектін ескеру қажет емес.
Нашар еритін электролиттің ерітіндісіне бір текті ионы бар күшті электролит қосқанда, оның ерігіштігі төмендейді.
Бірақ заттардың ерігіштігіне тек қана бір текті ионы бар электролит қана әсер етпейді, сонымен қатар, басқа тондары бар тұздар да әсерін тигізеді. Бұл жағдайларда ерігіштік азаймайды, керісінше артады. Мысалы, нашар ерігіш BaSO4, CaSO4, SrSO4 ерігіштігі KCl, KNO3, NaNO3 және т.б. тұздар қосқанда өседі.
11. Гомогенді жүйелер дегеніміз не? Массалар әрекеттесу заңын тұжырымдаңыз. Гомогенді тепе-теңдік тұрақтыларын (термодинамикалық, концентрациялық шартты) келтіріңіз.
Гомогенді жүйе- оны құрайтын бөлімдерге ажырататын, жіктеуші беттері жоқ жүйе болып табылады. Гомогенді жүйенің барлық учаскелері құрпмы мен қасиеті бойынша біртекті, мысалы газдар қоспасы, ауа (егер онда қатты бөлшектер болмаса), тұздар, қышқылдар, негіздердің қанықпаған ерітінділері. Гомогенді жүйеде бір ғана фаза бар.
Химияның басты заңы - әсер етуші массалар заңы талдаудың көптеген әдістерінің теориялық негізі болып табылады. Бұл заң қайтымды химиялық реакциядағы заттар арасындағы сандық қатынасты орнатады, ал аналитикалық реакциясының көпшілігі қайтымды. Химиялық реакцияның жылдамдығы, әрекеттесуші заттар химиялық теңдеудегі әр қайсысының коеффиценттерінің дәреже көрсеткіші болып алынған молярлы концентрациялар көбейтіндісіне тура пропорционал болады. Мысалы,
А + В ↔ С + D
Сұйытылған ерітінділерде f = 1 және а = С тура реакция жылдамдығы:
V1 = K1[A][B] (7)
Мұнда K1 – тура реакция жылдамдығының константасы.
Кері реакция жылдамдығы:
V2 = K2[C][D] (8)
Егер тепе-теңдік күйде тұрған жүйеге қандай да бір болмасын күш әсер ететін болса, онда жүйеде сыртқы әсер эффектін бәсеңдңдетін процесс күшейеді.
Әрекеттесуші массалар заңы электролит еместер мен әлсіз электролиттердің сұйытылған ерітінділерде қолданылады. Барлық күшті электролиттер (қышқылдар, негіздер, тұздар) және концентрлі әлсіз электролит ерітінділері әрекеттесуші массалар заңынан ауытқиды.
Химиялық тепе – теңдік орнаған сәттегі қайтымды және қайтымсыз реакциялардың жылдамдығы, яғни реакция басталғанла А мен Bның концентрациялары C мен Dның концентрацияларына қарағанда аз. Осының нәтижесінде тікелей реакцияның жылдамдығы артады. Соңында реакцтя жылдамдығы теңеседі.:
V1 = V2 (9)
K1[A][B] = K2[C][D]
Kт-т
=
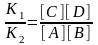 (10)
(10)
Бұдан күрделірек аналитикалық реакция үшін:
аА + bВ ↔ cC + dD
Кт-т
=
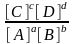 (11)
(11)
 (12)
(12)
Әрбір заттың активтігін тепе-теңдік концентрациясы және активтік коэффицент арқылы көрсетіп, төмендегідей жазамыз:
(13)
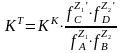
Химиялық тепе-теңдікте реакцияның нәтижесінде пайда болған заттардың концентрацияларының көбейтінідісінің реакцияға қатысқан заттардың концентрацияларының көбейтіндісіне қатынасы тұрақты сан, тепе-теңдік константасы деп аталады (К).
К- реакцияның конценрациялық тепе-теңдік константасы, Кк- тепе-теңдік константасының мәне температура мен қысымға тәуелді, ал реакцияға қатысатын заттардың концентрацияларына тәуелді емес.
Тепе-теңдік константасы Кт/Кк қатынасына тең болғандықтан тұрақты жағдайда тікелей реакцияның жылдамдығы кері реакцияның жылдамдығынан қанша рет басым екенін көрсетеді.

