
- •Комплексті қосылыстар ерітіндідегі химиялық тепе-теңдігін өрнектеңіз. Тұрақтылық және тұрақсыздық константалары үшін теңдеулер келтіріп, арасындағы байланысты көрсет.
- •2.Жүйелік және бөлшектік анализ дегеніміз не? Мысал келтір. Катиондардың қышқылды-негіздік жіктелуін көрсетіңіз.
- •5. Аналитикалық химияда комплекстүзу процесінің қолданылуын көрсетіңіз ( ашу, бөліп алу, концентрлеу, бүркемелеу, иондарды анықтау). Мысалдармен жауабыңызды дәлелдеңіз.
- •6.Тотығу-тотықсыздану потенциал шамасына қандай факторлар әсер етеді?
- •7. Тұнбаның ерігіштік көбейтіндісі мен ерігіштігі арасында қандай байланыс бар?
- •8. Тұнбаның ерігіштігіне аттас иондардың қандай әсері бар?
- •8. Реалды және идеалды ерітінділер дегеніміз не? Активтілік, активтілік коэффицент пен ерітіндінің иондық күші қалай есептеледі?
- •10. Тұнбаның ерігіштігіне күшті электролиттің қандай әсері бар?
- •11. Гомогенді жүйелер дегеніміз не? Массалар әрекеттесу заңын тұжырымдаңыз. Гомогенді тепе-теңдік тұрақтыларын (термодинамикалық, концентрациялық шартты) келтіріңіз.
- •12. Титриметриялық ерітіндінің концентрациясын өрнектеу тәсілдері мен өзара байланысын көрсетіңіз.
- •13. Титриметриялық анализдің түрлерін көрсетіңіз. Реакцияларға қойылатын талаптар.
- •14. Бастапқы стандарттар және екінші ретті стандарттарға анықтама беріңіз. Бастапқы стандарттарға қойылатын талаптар. Фиксоналдар дегеніміз не? Мысал келтіріңіз.
- •15. Тура, кері және жанама титрлеу арасындағы айырмашылықты көрсетіңіз.
- •16. Титрлеу кезінде индикатор түсі өзгеруін қалай түсіндіруге болады. Мысал келтіріңіз.
- •17. Комплексонометрлік титрлеудің маңызын түсіндіріп, мысал кетіріңіз.
- •19. Комплексондар дегеніміз не? Метал иондарымен әрекеттескенде комплексондардың ерекшелігін көрсетіңіз.
- •20. Аморфты және ірі кристалды тұнбаларды алу жағдайларын көрстіңіз.
8. Тұнбаның ерігіштігіне аттас иондардың қандай әсері бар?
Аттас иондар қатысында тұнба ерігіштігі әлдеқайда төмендейді.
Ерігіштік көбейтіндісі мен ерігіштіктің өзара байланысын бұл жағдайда есептеу жолымен көрсетеміз:
Гетерогенді тепе-теңдікте:
AmBn mA + nB
Артық катиондар (СА) қатысында тұнба иондарының концентрациялары:
[A] = mS + CA ≈ CA
[B] = nS

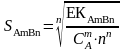 (30)
(30)
Артық иондар (СВ) қатысында тұнба ерігіштігі мынаған тең:
 (31)
(31)
Аттас иондар тұнбаның ерігіштігінің төмендеуі эффектін түзеді, ал басқа жағынан ерітіндінің иондық күшін өзгертетін бөтен иондар болып табылады.
Тұнба мен қаныққан ерітінді арасында келесі тепе-теңдік бар деп алайық:
Ba3(PO4)2 ↔ 3Ba2+ + 2PO43-
тұнба қанық еріт.μ
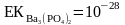 болғанда
барий фосфаты үшін аттас ионның эффектін
анықтаймыз.
болғанда
барий фосфаты үшін аттас ионның эффектін
анықтаймыз.
Барий фосфатының суда ерігіштігін анықтаймыз:
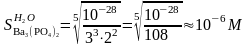
Натрий фосфатының 0,1М ерітіндісінде барий фосфатының ергіштігін анықтаймыз:


Тұнба ерігіштігі 0,1М Na3PO4 қатысында 1000 есе азаяды, ол барий фосфатының тұнбаға сандық толық түсуіне әсер етеді.
8. Реалды және идеалды ерітінділер дегеніміз не? Активтілік, активтілік коэффицент пен ерітіндінің иондық күші қалай есептеледі?
Егер электролиттің сулы ерітіндісіндегі иондар геометриялық нүкте болса және бір-біріне әсерін тигізбесе ол идеалды болып саналады. Идеалды ерітінділерге электролиттердің сұйытылған ерітінділері және электрбейтарап молекулалардан тұратын ерітінділері жатады. Сұйытылған ерітінділерде иондар арасындағы қашықтық олардың көлемін және бір-біріне тигізетін электростатикалық әсерін ескермеуге мүмкіндік береді. Соңғы фактор электролит емес ерітінділерге жатпайды.
Активтілік деп - химиялық процестерде иондар өзін соған сәйкес көрсететін заттың (ионның) тиімді (қиын болып көрінген) концентрациясын атайды. Активтілік мәні активтілік коэффициентінің молярлық концентрация көбейтіндісіне тең: a = f . C (1)
Активтілік коэффициентін есептеу үшін ерітіндінің иондық күшін (µ) білу керек. Иондардың активтілік коэффициенті электролиттің концентрациясына ғана емес, сонымен қатар ерітіндідегі басқа барлық иондардың концентрациясына тәуелді. Ерітіндінің иондық күші деп ерітіндідегі иондардың электростатикалық әрекеттесу мәнін айтады.
Г.Н.
Льюис және М. Рендел (1921 ж.) формуласы
бойынша ерітіндінің иондық күші иондар
концентрацияларының көбейтіндісінің
жарты қосындысының олардың зарядтарының
квадраттарының көбейтіндісіне тең:
 (2)
(2)
АВ
заты үшін μ =
 (СА.ZА2
+ СВ.ZВ2).
(СА.ZА2
+ СВ.ZВ2).
Дербес ионның белсенділік коэффициенті мынаған тең:
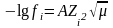 (3)
(3)
Мұнда А – еріткіштің диэлектрлік өткізгіштікке және температураға тәуелді тұрақтылық. 25ͦС-де су үшін А = 0,5.
Сондықтан, сулы ерітінділер үшін:
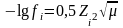 (4)
(4)
Бұл теңдеуді иондық күші μ≤0,01 өте сұйытылған ерітінділер үшін ғана қолданылады.
Орта сұйытылған ерітінділерде μ≤0,1 белсенділік коэффициентін ионның соңғы өлшемін ескеретін формуламен есептейді:
 (5)
(5)
Өте концентрлі ерітінділерде белсенділік коэффициентін күрделірек формуламен есептейді, мұнда тек иондар әрекеттесуі ғана емес, басқа да факторлар ескеріледі: ион жұптарының түзілуі, иондар сольватациясы дәрежесінің өзгеруі және ортаның диэлектрлікөткізгіштігінің өзгеруі, иондар сфералылығын болжаудың пайдалануының заңсыздығы:
 (6)
(6)
μ>1,0 болатын ерітінділер үшін, келтірілген (6) формула бойынша белсенділік коэффициентін есептеу ұсынылмайды.
Ерітінің иондық күші артқан сайыниондардың активтілік коэффициентінің шамасы азаяды. Бірақ, едәуір сұйытылған ерітінділердің иондық күштері бірдей болғанда зарядтары бірдей иондардың шамалары бір-біріне жақын болады.
