
- •Комплексті қосылыстар ерітіндідегі химиялық тепе-теңдігін өрнектеңіз. Тұрақтылық және тұрақсыздық константалары үшін теңдеулер келтіріп, арасындағы байланысты көрсет.
- •2.Жүйелік және бөлшектік анализ дегеніміз не? Мысал келтір. Катиондардың қышқылды-негіздік жіктелуін көрсетіңіз.
- •5. Аналитикалық химияда комплекстүзу процесінің қолданылуын көрсетіңіз ( ашу, бөліп алу, концентрлеу, бүркемелеу, иондарды анықтау). Мысалдармен жауабыңызды дәлелдеңіз.
- •6.Тотығу-тотықсыздану потенциал шамасына қандай факторлар әсер етеді?
- •7. Тұнбаның ерігіштік көбейтіндісі мен ерігіштігі арасында қандай байланыс бар?
- •8. Тұнбаның ерігіштігіне аттас иондардың қандай әсері бар?
- •8. Реалды және идеалды ерітінділер дегеніміз не? Активтілік, активтілік коэффицент пен ерітіндінің иондық күші қалай есептеледі?
- •10. Тұнбаның ерігіштігіне күшті электролиттің қандай әсері бар?
- •11. Гомогенді жүйелер дегеніміз не? Массалар әрекеттесу заңын тұжырымдаңыз. Гомогенді тепе-теңдік тұрақтыларын (термодинамикалық, концентрациялық шартты) келтіріңіз.
- •12. Титриметриялық ерітіндінің концентрациясын өрнектеу тәсілдері мен өзара байланысын көрсетіңіз.
- •13. Титриметриялық анализдің түрлерін көрсетіңіз. Реакцияларға қойылатын талаптар.
- •14. Бастапқы стандарттар және екінші ретті стандарттарға анықтама беріңіз. Бастапқы стандарттарға қойылатын талаптар. Фиксоналдар дегеніміз не? Мысал келтіріңіз.
- •15. Тура, кері және жанама титрлеу арасындағы айырмашылықты көрсетіңіз.
- •16. Титрлеу кезінде индикатор түсі өзгеруін қалай түсіндіруге болады. Мысал келтіріңіз.
- •17. Комплексонометрлік титрлеудің маңызын түсіндіріп, мысал кетіріңіз.
- •19. Комплексондар дегеніміз не? Метал иондарымен әрекеттескенде комплексондардың ерекшелігін көрсетіңіз.
- •20. Аморфты және ірі кристалды тұнбаларды алу жағдайларын көрстіңіз.
6.Тотығу-тотықсыздану потенциал шамасына қандай факторлар әсер етеді?
Редоксжұптың
тепе-теңдік тотығу-тотықсыздану
потенциалының теңдеуі Нернст теңдеуі
деп аталады. Тепе-теңдік тотығу-тотықсыздану
потенциалы тотығу-тотықсыздану жұптарының
белсенділіктері тең болғандағы берілген
редоксжұптың потенциалына тең:
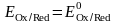
 болғанда
болғанда
Іс жүзінде белсенділікпен емес, тотыққан және тотықсызданған редоксжұп формасының аналитикалық тепе-теңдік концентрациясын қолданған ыңғайлы:
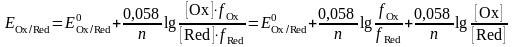
 шамасы
Е01
формальды потенциалы деп аталады.
шамасы
Е01
формальды потенциалы деп аталады.
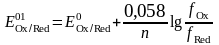
Онда, иондық күшті ескере отырып реалды ерітінділер үшін Нернст теңдеуін былай көрсетеміз:
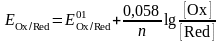
Тұрақты ион күшінде формалды потенциал тұрақты. Анықтамаларда (қолданылуына байланысты) редоксжұптың стандартты немесе формальды потенциалын ерітіндінің иондық күші көрсетіле отырып беріледі. Көптеген жағдайда Е0 және Е01 бір-бірінен қатты ерекшеленбейтіндігін айта кету керек.
Берілген жұптың тотығу-тотықсыздану қасиеттері стандартты және формалды потенциалымен сандық бағаланады. Анықтамаларда көрсетілгендей сулы ерітінділерде стандартты потенциалдар мәндері 6В диапазонын қамти отырып -3В –дан +3В дейінгі аймақта болады. Стандартты (формальды) потенциал көбейгенде тотықтырғыш ионының (молекула атомының) тотықтыру қабілеті жоғарылайды. Ол төмендегенде, ионның (молекула атомының) тотықсыздану қабілеті көбейеді. Мына жұптар күшті тотықтыру қабілеттерге ие: MnO4-/Mn2+; PbO2/Pb2+; Co3+/Co2+, H2O2+2H+/H2O және т.б.; тотықсыздандыруға қабілетті: Li+/Li0; Al3+/Al0; 2I-/I2; S0/S2-.
Сулы ерітінділерде көбіне редокс ауысуларға сутек немесе гидроксил иондары қатысады, олар тепе-теңдік тотығу-тотықсыздану потенциалдарға елеулі әсер етеді.
Йодтың бесвалентті күшәнмен тотығуы мысалын қарастырамыз:
2AsO43- + 2I- + 4H+ ↔ AsO33- + I2 + 2H2O
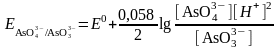
себебі AsO43- + 2H+ + 2e → AsO33- +H2O
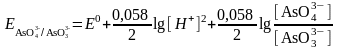
Бұл теңдеуде ерітінді қышқылдығын ескергенде формальды потенциал мынаған тең:
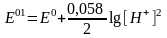 .
.
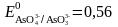 және
[H+]
= 1
болғанда
және
[H+]
= 1
болғанда
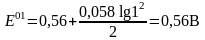
Екінші жарты реакция үшін
2I = 2e → I2
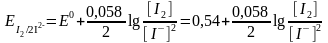 ;
;
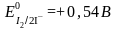
Екі жарты реакцияның потенциалдарын салыстыру қышқыл ортада тотығу-тотықсыздану реакциясы тура бағытта жүретінін көрсетеді.
[H+]=10-9 болғанда сілті ерітіндіде формальды потенциал:
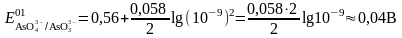 тең
тең
Сілті ерітіндідегі I2/2I- жұбының стандартты потенциалы мен AsO43-/AsO33- редокс жұбының формальды потенциалын салыстыру қарастырылып отырған тотығу-тотықсыздану реакциясы кері бағытта жүретінін көрсетеді. Сілті ортада AsO43-/AsO33- жұбының тотықтыру қасиеті бірден төмендейді. Тотығу-тотықсыздану жұбының тепе-теңдік потенциалына осы жұптың бірінің ионымен қиын еритін тұнба түзуі үлкен әсер етеді.
Ag0 - e → Ag+ жарты реакциясын алайық:
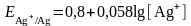
Тұнба үстіндегі қаныққан ерітіндідегі күміс иондарының концентрациясы мынаған тең:
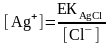
Сонда
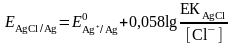
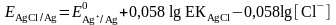
Тұнба түзілу шартында бұл жұптың формальды потенциалы:
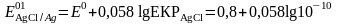
 тең
тең
Жұптың формальды потенциалы тотыққан форманы тұндырғанда, редоксжұптың тотықсыздану қасиеті бірден төмендейтінін көрсетеді. Тепе-теңдік потенциалы потенциал анықтаушы иондармен қиын еритін қосылыстар түзетін иондар концентрациясымен анықталатын электродтар – екінші ретті электродтар деп аталады.
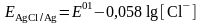
Хлорид-иондарының тұрақты концентрациясында мұндай электродтардың тепе-теңдік потенциалы тұрақты. Екінші ретті электродтар потенциалдары өте тұрақты және жақсы туындайтындықтан, оларды – жұмыста ыңғайсыз және көбіне қауіпті сутектік электродының орнына қолданады.
Берілген салыстыру электроды – хлоркүмісті электродтың құрамы келесі:
Ag0, AgCl/HCl
Егер тұнбаны редокс жұптың тотықсызданған формасы түзсе, мысалы, 2Hg2+/Hg22+ жүйесінде, бірвалентті сынап иондары суда қиын еритін сынап хлоридін түзеді:
Hg22+ + 2Cl- = Hg2Cl2↓
ақ
Берілген редокс жұптың тепе-теңдік тотығу-тотықсыздану потенциалы:
 тең.
тең.
Hg22+ тотықсызданған форма иондарының концентрациялары тұнба ерігіштігі және аниондар концентрацияларының туындыларымен анықталады:

Сонда редокс жұптың тепе-теңдік потенциалы:
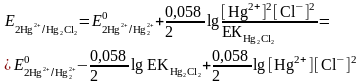
Бұдан редоксжұптың формальды потенциалы:
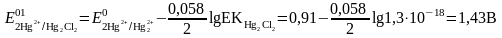

Суда қиын еритін қосылыспен байланысқан тотықсызданған форма концентрациясының төмендеуі нәтижесінде редокс жұптың тотығу қасиеттері бірден өседі. Редокс жұптың тотығу-тотықсыздану потенциалына сонымен қатар бір форманы комплекске байланыстыру елеулі әсерін тигізеді.
а) тотыққан форма – комплекс болсын. Cu2+/Cu+ редокс жұбын аммиакты ерітіндіде аламыз.
Cu2++4NH3=[Cu(NH3)4]2+
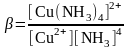

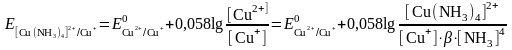
Алынған теңдеуді түрлендіреміз:

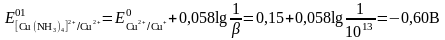
Егер жұптың тотыққан түрі комплекске байланысса, онда жұптың тотығу-тотықсыздану потенциалы бірден оң жаққа ығысады және редоксжұптың тепе-теңдік потенциалы теріс жағына ығысады.
б) Тотықсызданған жұп - комплекс. Cu2+/Cu+ цианидті ерітіндіде
Cu++4CN-
[Cu(CN)4]3-
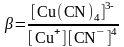
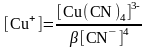
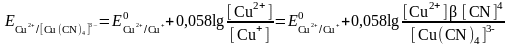
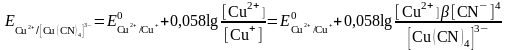
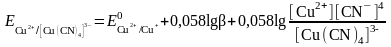
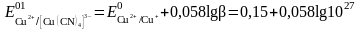
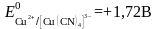
Егер тотыққан форма тұнбаға байланысса, онда жұптың тотығу-тотықсыздану потенциалы бірден оң жаққа ығысады және редокс жұптың тотығу қасиеттері елеулі өседі.
в) Комплекс – тотыққан және тотықсызданған формалар.
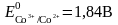
Сулы ерітіндіде үшвалентті кобальт ионы бола алмайды, себебі жоғары тотықтыру қасиетінен оттек бөле отырып сумен екі валентті кобальт ионына дейін тотықсызданады.
Со3+ + е → Со2+
2Н2О - 4е → О2↑ + 4Н+
Бірақ аммиакты ерітіндіде Со3+ және Со2+ аммиакты комплекстердің түзілуі нәтижесінде бола алады:
Co3+
+ 6NH3
↔ [Co(NH3)6]3+

Co2+
+6NH3
↔ [Co(NH3)6]2+
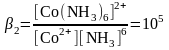
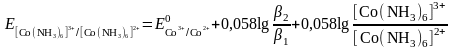
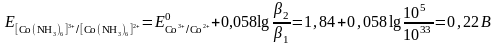
Егер екі форма да комплекске байланысса және тотыққан форма тотықсызданған формаға қарағанда тұрақтылау комплекс түзсе, онда редокс жұптың тотықтыру қасиеттері көбінесе төмендейді.
Сиректеу кездесетіні – тұрақты комплексті тотықсызданған форманың түзуі. Комплекстүзу онда тотығу-тотықсыздану потенциалының үлкеюіне әкеп соғады.
Ерітіндінің иондық күші комплекстүзуге қарағанда тотығу-тотықсыздану потенциалына елеусіз ғана әсер етеді.
