
- •Комплексті қосылыстар ерітіндідегі химиялық тепе-теңдігін өрнектеңіз. Тұрақтылық және тұрақсыздық константалары үшін теңдеулер келтіріп, арасындағы байланысты көрсет.
- •2.Жүйелік және бөлшектік анализ дегеніміз не? Мысал келтір. Катиондардың қышқылды-негіздік жіктелуін көрсетіңіз.
- •5. Аналитикалық химияда комплекстүзу процесінің қолданылуын көрсетіңіз ( ашу, бөліп алу, концентрлеу, бүркемелеу, иондарды анықтау). Мысалдармен жауабыңызды дәлелдеңіз.
- •6.Тотығу-тотықсыздану потенциал шамасына қандай факторлар әсер етеді?
- •7. Тұнбаның ерігіштік көбейтіндісі мен ерігіштігі арасында қандай байланыс бар?
- •8. Тұнбаның ерігіштігіне аттас иондардың қандай әсері бар?
- •8. Реалды және идеалды ерітінділер дегеніміз не? Активтілік, активтілік коэффицент пен ерітіндінің иондық күші қалай есептеледі?
- •10. Тұнбаның ерігіштігіне күшті электролиттің қандай әсері бар?
- •11. Гомогенді жүйелер дегеніміз не? Массалар әрекеттесу заңын тұжырымдаңыз. Гомогенді тепе-теңдік тұрақтыларын (термодинамикалық, концентрациялық шартты) келтіріңіз.
- •12. Титриметриялық ерітіндінің концентрациясын өрнектеу тәсілдері мен өзара байланысын көрсетіңіз.
- •13. Титриметриялық анализдің түрлерін көрсетіңіз. Реакцияларға қойылатын талаптар.
- •14. Бастапқы стандарттар және екінші ретті стандарттарға анықтама беріңіз. Бастапқы стандарттарға қойылатын талаптар. Фиксоналдар дегеніміз не? Мысал келтіріңіз.
- •15. Тура, кері және жанама титрлеу арасындағы айырмашылықты көрсетіңіз.
- •16. Титрлеу кезінде индикатор түсі өзгеруін қалай түсіндіруге болады. Мысал келтіріңіз.
- •17. Комплексонометрлік титрлеудің маңызын түсіндіріп, мысал кетіріңіз.
- •19. Комплексондар дегеніміз не? Метал иондарымен әрекеттескенде комплексондардың ерекшелігін көрсетіңіз.
- •20. Аморфты және ірі кристалды тұнбаларды алу жағдайларын көрстіңіз.
19. Комплексондар дегеніміз не? Метал иондарымен әрекеттескенде комплексондардың ерекшелігін көрсетіңіз.
Комплексиметрлік титрлеу әдістерінің кең дамуы органикалық титранттарды, әсіресе 1945 ж. швейцар ғалымы Шварценбах ұсынған аминополикарбон қышқылдарын металл иондарын анықтауға пайдаланғаннан кейін басталды. Аминополикарбон қышқылдары – комплексондар, ал оларды пайдаланып титрлеуді – комплексонометрлік титрлеу деп атайды. Комплексондарың өкілдері:
нитрилоүшсірке қышқылы - N(СН2СООН)3 (комплексон І, трилон А).
Комплексонометрияда кең қолдану тапқан қышқыл – этилендиаминтетрасірке қышқылы (ЭДТУ не комплексон ІІ): (СН2СООН)2N-(СН2)2- N(СН2СООН)2, оны қысқа түрде Н4Y деп жазуға болады. Оның құрамында екі аминді азот және төрт карбоксил топшалары бар. Н4Y үшін Ка мәндері: Ка(1) =1.10-2; Ка(2) =2.10-3; Ка(3) =7.10-4; Ка(4) = 6.10-11.
ЭДТУ формуласын Н2[Н2Y] деп те жазуға болады.
Ауыл шаруашылфғфнда және техникадағы талдауда жиі ұолданылатын этилендиамин тетра сірке қышқылының қос натриййлі тұзы қолданылады. Титрлеуде қышқылдың екі натрийлі тұзы - ЭДТА (комплексон ІІІ, Трилон Б)
жиі қолданылады, оны қысқа түрде Na2Н2Y деп жазуға болады. Комплексон ІІІ көптеген катиондармен едәуір берік, суда еритін іш комплексті тұздар түзеді. Олар металл катионы органикалық қосылыстың функционалды тобындағы сутек атомын алмастырып, әрі координациялық байланыс басқа топтармен әрекеттесуі арқылы түзіледі.
Комплексон ІІІ химиялық талдауда кең түрінде қолданылады. Мысалы, Cu2+, Mg2+, Co2+, Zn, Al, CN-, PO43- және т.б. катиондар және аниондармен ішкі комплексті тұздар түзеді.
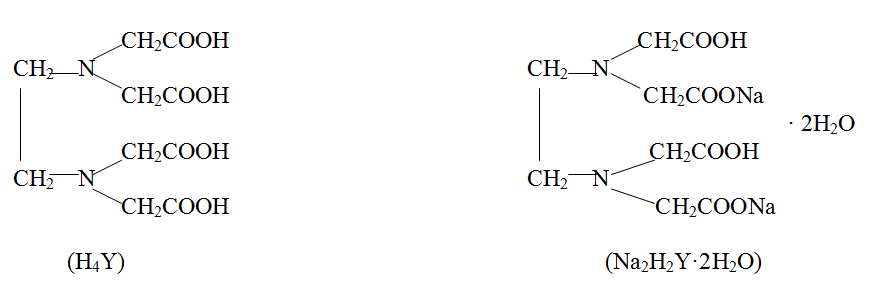
Түзілетін комплекстің құрамы Ме : L = 1 : 1 :
Ме2+ + Н2Y2- ↔ МеY2- + 2Н+
Ме3+ + Н2Y2- ↔ МеY- + 2Н+
Ме4+ + Н2Y2- ↔ МеY + 2Н+
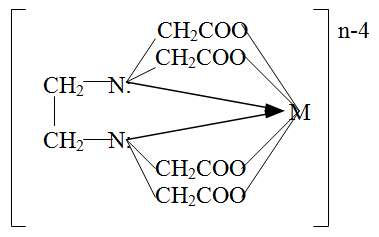
Химиялық талдауда комплексонометрияның кең таралуы келесі ерекшеліктермен сипатталады:
Реакция жүру нәтижесінде металл:лиганд 1:1 қатынаста бірдей құрамы комплексонаттар түзіледі . Олар түссіз, суда жақсы ериді, металдың орталық атомы полидентантты хелатты лигандттармен мықты байланысқадықтан жоғары тұрақтылықпен сипатталады.
Ерітіндінің рН-ын өзгеру арқылы комплекстүзілу процесі қайтымды болу мүмкін.
Реакция нәтижесінде сутек-иондары бөлінеді, сондықтан титрлеуді буфер ортада жүргізу қажет. рН-шамасы комплексонаттың тұрақтылық констасымен анықталады.
20. Аморфты және ірі кристалды тұнбаларды алу жағдайларын көрстіңіз.
Кристалды тұнбаларды мүмкіншілігі болғанша ірі кристалды түрінде алған жөн. Мұндай тұнбалар тез тұнады, сондықтан ерітіндіден фильтрлеп бөліп алу жеңіл болады. Сонымен қатар беткі қабаты кіші болғандықтан ерітіндіден бөгде иондарды аз адсорбциялайды. Жоғарыда келтірілгендей ірі кристалды тұнбаның пайда болу жағдайында салыстырмалы аса қанығу мәні мүмкіншілігі болғанша аз болуы керек.
СА=(Q-E)/Е
(Q- тұндырар алдындағы араластыратын
реагенттердің молярлы концентрациясы,
Е-тепе-теңдік орнағаннан кейінгі тұнбаның
моляры ерігіштігі) формуласынан тұнбаның
ерігіштігі неғұрлым көп болса және
түзілетін реактивтердің концентрациясы
неғұрлым аз болса, соғұрлым салыстырмалы
аса қанығу мәні аз, соған сәйкес алғашқы
кристалдар пайда болады да, кристалдар
ірі болып түседі. Сондықтан ірі кристалды
тұнбаларды тұнба алу үшін тұндыру
процесінде тұнбаның ерігіштігін арттыру
және реактивтердің концентрациясын
азайту қажет. Тұнба түзілуде реакцияласатын
иондардың концентрациясын азайтудың
бірнеше жолы бар. Оның ең қарапайым
жолы: 1)тұнба түсірер алдында ерітінділерді
сұйылту; 2) тұнбаға түсіргішті тамшылап
қосу; 3) ерітіндіні үнемі араластыру.
Сұйытылған ерітінділерді пайдалану
және араластырып ептеп тұндыру бір
жерде пайда болатын аса қанығуды, соған
сәйкес тұнбаның біркелкі түспеуін түгел
жоя алмайды. Сондықтан тұнба түсіргіштің
концентрациясын азайтудың және біркелкі,
үздіксіз баяу алудың бір әсерлі жолы –
пайда болатын реагент әдісін пайдалану.
Бұл әдісте ерітіндіге тікелей тұнба
түсіргіш құйылмай оның орнына ерітіндіде
баяу, реакция нәтижесінде тұнба түсіргіш
беретін зат қосылады. Тұнбатүсіргіш
ион зерттейтін зерттейтін ерітіндіде
ептеп аз мөлшерде пайда болады. Бұл
салыстырмалы аса қанығу мәнін азайтуға
мүмкіншілік береді. Мысалы, барий ионын
BaSO4 түрінде тікелей күкірт қышқылын
құйып тұндырудың орнына диметилсульфат,
не сульфаамин қыщқылын қосып тұндыруға
болады. Бұл жағдайда ерітіндіде жүретін
протолитикалық реакцияның нәтижесінде
тұнбаға түсіргіш алынады: +
+ ↔
↔ +
+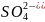 +2C
+2C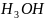
HS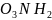 +2
+2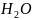 ↔
↔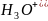 +
S
+
S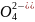 +
N
+
N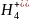
Тұнбаға түсіргіштің ерітіндінің бар көлемінде беркелкі ,үздіксіз аз жылдамдықпен пайда болуы бір жерде асақанығуды түгелдей жояды, сонымен қатар жүйедегі кристалдану орталығының санын азайтады, бұл ірі кристалды таза тұнба алуға мүмкіншілік береді.
Көптеген қышқылдық ортада еритін гидроксидтерді, не әлсіз қышқылдың тұздарын (корбонаттар, оксолаттар, сульфидтер, т.б.) гомогенді ерітіндіден түсіру ыңғайлы. Бұл жағдайда тұндыратын зат пен тұнбаға түсіргішті қышқыл ортада араластырады. Қышқыл ортада тұнба түзілмейді. Содан кейін ерітіндіге жүйедегі протондарды байланыстыратын зат қосады. Нәтижесінде ерітіндінің бар көлемінде қышқылдық біркелкі, ептеп азаяды, бұл ірі кристалды тұнбалар алуға жағдай жасайды.
Сонымен кристалды тұнаны тұндырудың мынадай ережелерін тұжырымдауға болады:
1) тұндыруды сұйытылған ерітіндіден жүргізу;
2) тұнба түзгішті ептеп, тамшылап қосу;
3) бір жерде аса қанығуды болдырмау үшінтұнбатүзгіштің ерітіндісін үздіксіз арадастырған ерітіндіге қосу керек;
4) тұндыруды ыстық ерітінділерден жүргізу керек;\
5) баның ерігіштігін арттыратын зат қосу керек;
6) тұнбаны үстіндегі ерітіндімен бірнеше сағатқа қалдыру.
Келтірілген жағдайдарды қаншалықты сақтағанмен кейде ірі кристалдармен қатар өте ұсақ кристалдардың біраз мөлшері түзілуі мүмкін. Сондықтан қайтымсыз структуралық өзгерістер жүруі үшін тұнбаның үстіндегі ерітіндісімен бірнеше уақытқа қалдырады. Бұл жағдайда кристалдарды ірілендіретін және әбден жетілдіретін процестер жүреді.
Кристалдардың
ірілену себебі бірдей жағдайда ұсақ
кристалдардың ерігіштігінен басым
болғанында. Мысалы, тәжірибелік жолмен
BaS тің ұсақ кристалдарының ерігіштігі
(диаметрі 0,04 мк) бірдей температурада
ірі кристалдардың ерігіштігінен мың
еседей басым екені анықталған. Ұсақ
кристалдардың еруі ірі кристалдардың
әрмен қарай өсуіне себеп болады, яғни
рекристаллизациялану процесі жүреді.
тің ұсақ кристалдарының ерігіштігі
(диаметрі 0,04 мк) бірдей температурада
ірі кристалдардың ерігіштігінен мың
еседей басым екені анықталған. Ұсақ
кристалдардың еруі ірі кристалдардың
әрмен қарай өсуіне себеп болады, яғни
рекристаллизациялану процесі жүреді.
Аморфты тұнбалар – егер тұнбаның ерігіштігі өте аз болса, ерітінділерді араластырғанда лезде үлкен салыстырмалы асақанығу пайда болуын жою мүмкін емес, сондықтан кристалдану орталығы түзілу процесі басым болып, тұнба өте ұсақ жиі коллоидты түрде пайда болады. Мысалы, аналитикалық жағдайда Fe(3), Cr(3), Al(OH)3 және көптеген ауыр металдардың сульфидтері , олардың ерігіштігі төмен болғандықтан коллоидты түрде бөлінеді. Жиі пайда болған жаман еритін ұсақ бөлшектер ұзақ уақыт коллоидты ерітінді түзіп, тұнбаға бөлінбеуі мүмкін. Коллоидты бөлшектердің бір-бірімен қосылмай ерітіндіде жүруінің бір себебі, ол бөлшектердің аттас электрлік зарядталғандығында. Зарядтардың әсеріне коллоидты бөлшектер тебіседі, бұл тебісу олардың қосылып ірі агрегаттар түзуіне кедергі жасайды. Коллоидты бөлшектердің зарядтары сол бөлшектердің катиондарды не аниондарды адсорбциялау нәтижесінде пайда болады. Жиі біртектес иондар адсорбцияланады, яғни жаман еритін бөлшектердің крисалдық торына кіретін иондар. Сондықтан жаман еритін бөлшектердің адсорциялық қабаты әр түрлі зарядталған иондардың екі қабатынан тұрады, сондықтан оны қос электрлік қабат деп атайды. Коллоидты бөлшектердің заряды адсорбциялық қабаттағы қарама-қарсы иондардың жалпы заряды алғашқы адсорбцияланған иондардың жалпы зарядын жоймағандықтан пайда болады. Коллоидты бөлшектерге адсорбцияланып оларды зарядтайтын соған сәйкес тұрақтылығын арттыратын заттар стабилизаторлар деп аталады.келтірілген мысалдарға H2S, KI, AgNO3 стабилизаторлар қызметін атқарады. Коллоидты ерітінділердің тұрақтылығы зарядты бөлшектер пайда болуымен қатар коллоидты сольватты (гидратты) қабат түзуіне де байланысты. Сольватация не ерігіштің молекулаларының адсорбциялануы осы молекулалардың дипольдік моментімен анықталады. Нәтижесінде коллоидты бөлшектер сольваттық қабаттармен қоршалады да бөлшектердің бір-бірімен жақындауына соған байланысты агрегеттар түзуіне мүмкіндік бермейді. Көптеген коллоидты жүйелердің бөлшектерін ірілету онша қиын емес. Коллоидтардың коагуляциялану процесі бұл бөлшектердің бір-бірімен тебісу күштерін азайтқанда жүреді. Ол үшін ерітіндіні қыздырып араластырады. Коагуляцияланған тұнба аморфты тұнба деп аталады. Бұл тұнба ұсақ бөлшектерден тұрғандықтан беткі қабаты үлкен болады. Егер белгілі жағдай жасаса фильтрлеуге және жууға ыңғайлы біршама таза аморфты тұнба алуға болады. Ол жағдайлар :
концентрленген ерітінділерден тұндыру;
Ыстық ерітінділерден араластырып тұндыру;
Электролит-коагулятор қатысында тұндыру;
Тұнба түсісімен ерітінідні суылтып тікелей фильтрлеу.
